м.
Легко воспламеняющееся и светящееся в темноте вещество, содержащееся в некоторых минералах и играющее важную роль в жизнедеятельности животных и растений; химический элемент.
м.
Легко воспламеняющееся и светящееся в темноте вещество, содержащееся в некоторых минералах и играющее важную роль в жизнедеятельности животных и растений; химический элемент.
ФО́СФОР, фосфора, мн. нет, муж. (греч. phosphoros - светоносный) (хим.). Химический элемент, легко воспламеняющееся и светящееся в темноте вещество, находящееся в составе некоторых минералов, в костях животных, в животных и растительных тканях. Красный фосфор (применяется в спичечном производстве). Препараты фосфора (применяются как лечебное средство и как удобрение).
ФО́СФОР, -а, муж. Химический элемент, содержащийся в нек-рых минералах, в костях животных, в животных и растительных тканях. Красный ф. Белый ф. (легковоспламеняющийся и светящийся в темноте).
| прил. фосфорный, -ая, -ое.
ФОСФОР - муж. химически добываемое, простое (несложное) вещество, самосветное, крайне горючее. Фосфорные спички; - кислота, 4-я степень окисленья. Фосфористый запах; - кислота, 3-я степень. Фосфороводородный газ в тепле сам собою загорается, вспыхивая в виде болотных огней. Фосфорокислая известь есть в костях животных. Фосфороватая (фосфорноватая) кислота, хим. 2-я степень окисленья; фосфороватистая, 1-я степень, слабейшая. Фосфорический свет, фосфоричество, фосфоресценция, самосвет, свет предмета собою, от себя, без освещенья, без горенья. Фосфорический свет моря, слизней. Фосфоризовать, издавать фосфорический свет, светить собою, от себя и без огня. Фосфоризованье, ·сост. по гл.
ФО́СФОР1́, -а, м
Вещество, химический элемент, содержащийся в некоторых минералах, в костях животных, в животных и растительных тканях, играющий важную роль в жизнедеятельности животных и растений.
Из-за содержания в рыбе большого количества фосфора она является важным и необходимым продуктом в питании.
ФО́СФОР2́, -а, м
Белое легко воспламеняющееся и святящееся голубовато-зеленоватым светом в темноте вещество.
При работе с фосфором следует учитывать, что это легко воспламеняющееся вещество и быть осторожными.
ФО́СФОР -а; м. [от греч. phōsphoros - светоносный] Химический элемент (P), играющий важную роль в жизнедеятельности животных и растений (содержится в некоторых минералах, в костях животных, в животных и растительных тканях). Красный ф. Чёрный ф. В рыбе много фосфора. Ф. нужен для укрепления костей. Белый ф. (легковоспламеняющееся и светящееся в темноте вещество). Море светится, сияет фосфором (светится ночью зеленоватым светом из-за обилия микроорганизмов).
◁ Фо́сфорный (см.).
* * *
фо́сфор (лат. Phosphorus), химический элемент V группы периодической системы. Назван от греч. phōsphóros - светоносный. Образует несколько модификаций - белый фосфор (плотность 1,828 г/см3, tпл 44,14°C), красный фосфор (плотность 2,31 г/см3, tпл 593°C), и др. Белый фосфор легко самовоспламеняется, светится в темноте (отсюда название), ядовит; красный менее активен химически, ядовит. Добывают из апатитов и фосфоритов. Главный потребитель - сельское хозяйство (фосфорные удобрения); применяется в спичечном производстве, металлургии (раскислитель и компонент некоторых сплавов), в органическом синтезе и др. Присутствует в живых клетках в виде орто- и пирофосфорной кислот и их производных.
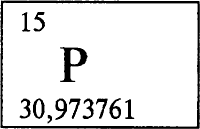
* * *
ФОСФОР - ФО́СФОР (лат. - Phosphopus), Р (читается «пэ»), химический элемент с атомным номером 15, атомная масса 30,973762. Расположен в группе VA в 3 периоде периодической системы. Имеет один стабильный нуклид 31Р. Конфигурация внешнего электронного слоя 3s2р3. В соединениях проявляет степени окисления от -3 до +5. Валентности от III до V. Самая устойчивая степень окисления в соединениях +5.
Радиус нейтрального атома P 0,134 нм, радиус ионов: Р3- 0,186 нм, Р3+ 0,044 нм (координационное число 6) и Р5+- 0,017 нм (координационное число 4) и 0,038 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома P равны 10,486, 19,76, 30,16, 51,4 и 65 эВ. Сродство к электрону 0,6 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 2,10. Неметалл.
История открытия
Первым в свободном состоянии фосфор получил в 1669 гамбургский алхимик Х. Бранд (есть сведения, что аналогичное по свойствам вещество было получено еще в 12 веке арабским алхимиком Бехилем). В поисках философского камня (см. ЭЛИКСИР) он прокалил в закрытом сосуде сухой остаток от выпаривания мочи с речным песком и древесным углем. После прокаливания сосуд c реагентами начал светиться в темноте белым светом (это светился фосфор, восстановленный из его соединений, содержащихся в моче).
В 1680 светящийся в темноте фосфор (от греческого «фосфорос» - светоносный) получил англичанин Р. Бойль. (см. БОЙЛЬ Роберт) В последующие годы было установлено, что фосфор содержится не только в моче, но и в тканях головного мозга, в костях скелета. Наиболее простой метод получения фосфора прокаливанием костяной золы с углем был предложен в 1771 К. Шееле (см. ШЕЕЛЕ Карл Вильгельм). Элементарную природу фосфора установил в конце 18 века А. Л. Лавуазье. (см. ЛАВУАЗЬЕ Антуан Лоран)
Нахождение в природе
Содержание в земной коре 0,105% по массе, что значительно превосходит содержание, например, азота (см. АЗОТ). В морской воде 0,07 мг/л. В свободном виде в природе фосфор не встречается, но он входит в состав 200 различных минералов. Наиболее известны фосфорит (см. ФОСФОРИТЫ) кальция Са3(РО4) 3, апатиты (см. АПАТИТЫ) (фторапатит 3Са3 (РО4 ) 3 ·СаF2, или, Ca5 (PO 4 )3F), монацит (см. МОНАЦИТ),бирюза (см. БИРЮЗА). Фосфор входит в состав всех живых организмов.
Получение
Производство фосфора осуществляется электротермическим восстановлением его из фосфоритов и апатитов при 1400-1600°C коксом в присутствии кремнезема:
2Са3(РО4)2 + 6SiO2 + 10C = P4 + 6CaSiO3 + 10CO
4Са5(РО4)3F +21SiO2 +30C = 3P4 + 20CaSiO3 + 30CO + SiF4
Выделяющиеся пары Р4 далее обрабатывают перегретым водяным паром для получения термической фосфорной кислоты Н3РО4:
Р4 + 14Н2О = 4Н3РО4 + 8Н2
При десублимации паров Р4 образуется белый фосфор. Его перерабатывают в красный фосфор нагреванием без доступа воздуха при температуре 200-300°C в реакторах, снабженных шнековым измельчителем реакционной массы.
Особенности строения аллотропных модификаций и их физические свойства
Элементарный фосфор существует в нескольких аллотропных модификациях, главные из которых: белая (фосфор III), красная (фосфор II) и черная (фосфор I).
Белый фосфор - воскообразное, прозрачное вещество, с характерным запахом. Состоит из тетраэдрических молекул Р4, которые могут свободно вращаться. Белый фосфор обладает кубической кристаллической решеткой молекулярного типа, параметр ячейки а = 1,851 нм. Плотность 1,828 кг/дм3. Температура плавления 44,14°C, температура кипения 287°C. Существует две формы белого фосфора: a-модификация, с кубической кристаллической решеткой, при -76,9°C переходит в b-модификацию, кристаллическая решетка которой не установлена и отсутствует свободное вращение молекул Р4. Диэлектрик. Растворяется в этиловом спирте, бензоле, сероуглероде CS2.
Нагревая белый фосфор без доступа воздуха при 250-300°C получают красный фосфор. Примеси натрия, иода и селена и УФ-лучи ускоряют переход одной модификации в другую.
Красный фосфор аморфен, имеет цвет от алого до темно-коричневого и фиолетового. Существует несколько кристаллических форм с различными свойствами. Кристаллический красный фосфор (фосфор Гитторфа) получают охлаждая насыщенный при температуре 600°C раствор красного фосфора в расплавленном свинце. Он обладает моноклинной решеткой, параметры элементарной ячейки а = 1,02 нм, в = 0,936 нм, с = 2,51 нм, угол b 118,8°. Плотность красного фосфора 2,0-2,4 кг/дм3. Диэлектрик. При нагревании красный фосфор испаряется в виде молекул Р4, конденсация которых приводит к образованию белого фосфора.
При нагревании белого фосфора до 200-220°C под давлением 1,2 ГПа образуется кристаллический черный фосфор. Решетка построена из волокнистых слоев с пирамидальным расположением атомов. Наиболее устойчивая разновидность черного фосфора имеет орторомбическую решетку, параметры а = 0,3314 нм, в = 0,4376 нм, с = 1,0478 нм. Плотность черного фосфора 2,702 кг/дм3. Внешне похож на графит; полупроводник, диамагнитен. При нагревании до 560-580°C превращается в красный фосфор. Черный фосфор малоактивен, с трудом воспламеняется.
Химические свойства
Фосфор в соединениях главным образом ковалентен. Фосфор обладает свободными 3d-орбиталями, что приводит к образованию донорно-акцепторных связей. Наиболее активен белый фосфор. Он окисляется на воздухе. Окисление происходит по механизму цепных реакций и сопровождается хемолюминесценцией. При горении фосфора в избытке кислорода получается P2O5, который образует димеры Р4О10 и тетрамеры Р8О20. При недостатке кислорода получается P2O3. Самовоспламеняется на воздухе за счет выделяющейся при окислении теплоты. Красный фосфор на воздухе окисляется медленно, не самовоспламеняется. Черный фосфор на воздухе не окисляется.
Оксид фосфора(V) - кислотный оксид. Он реагирует с водой с выделением большого количества теплоты. При этом сначала образуется полимерная метафосфорная кислота (НРО3)n. При обработке горячей водой она превращается в трехосновную ортофосфорную кислоту средней силы Н3РО4:
Р4О10 + 2Н2О = (НРО3)4; (НРО3)4 + 4Н2О = 4Н3РО4
или Р2О5 + 3Н2О = 2Н3РО4
Фосфор взаимодействует с галогенами с выделением большого количества тепла. С F, Cl, Br образует тригалогениды и пентагалогениды, с I - только триодид РI3. Все галогениды фосфора легко гидролизуются до ортофосфорной Н3РО4, фосфористой Н3РО3 и галогеноводородной кислот:
РСl5 + 4Н2О = Н3РО4 + 5НСl
PI3 + 3H2O = H3PO3 + 3HI
Тригалогениды фосфора представляют собой трехгранную пирамиду, в основании которой расположены атомы галогенов, а в вершине находится атом фосфора. Молекула пентагалогенида представляет собой две трехгранные пирамиды, имеющие общую грань. Получены оксигалогениды фосфора РОF3, РОСl3 и РОBr3.
С серой фосфор образует сульфиды Р4S3, Р4S5, Р4S7, Р4S10. Известны оксисульфиды фосфора: P2O3S2, P2O2S3, P4O4S3, P6O10S5, P4O4S3. Реагирует фосфор с Se и Te, образует соединения с Si и C (PC3).
С водородом непосредственно в реакцию не вступает. При взаимодействии с разбавленным раствором гидроксида калия КОН образуется газообразный фосфин РН3:
4Р + 3КОН +3Н2О = 3КН2РО2 + РН3
Как примесь при этом образуется также дифосфин Р2Н4. Оба фосфина имеют характерный запах тухлой рыбы.
Фосфин РН3 по химическим свойствам напоминает аммиак NH3, но менее устойчив.
Фосфор при сплавлении реагирует с металлами. С щелочноземельными образует ионные фосфиды М3Р2,разлагающиеся при контакте с водой:
Mg3P2 + 6H2O = 3Mg(OH)2+ 2PH3,
Са3Р2 + 6Н2О = 3Са(ОН)2 + 2РН3
Со переходными металлами фосфор образует металлоподобные фосфиды Mn3P, FeP, Ni2P.
Фосфор входит в состав неорганических кислот. Это ортофосфорная кислота Н3РО4 (ее соли - ортофосфаты, моногидрофосфаты, Na2HPO4 и дигидрофосфаты, Са(Н2РО4)2); метафосфорная кислота (НРО3)n (ее соли - метафосфаты), одноосновная фосфорноватистая кислота Н3РО2 (ее соли - гипофосфиты, NaН2РО2), двухосновная фосфористая кислота Н3РО3 (ее соли - фосфиты, Na2HPO3).
Фосфор входит в состав органических эфиров, спиртов и кислот: фосфиновых RRP(O)OH, фосфонистых RH2PO2 и фосфоновых RP(O)(OH)2, где R и R - органические радикалы.
Применение
Белый фосфор используется при изготовлении фосфорной кислоты Н3РО4 (для получения пищевых фосфатов и синтетических моющих средств). Применяется при изготовлении зажигательных и дымовых снарядов, бомб.
Красный фосфор используют в изготовлении минеральных удобрений, спичечном производстве. Фосфор применяется в производстве сплавов цветных металлов как раскислитель, служит легирующей добавкой. Используется в производстве магнитомягких сплавов, при получении полупроводниковых фосфидов. Соединения фосфора служат исходными веществами для производства медикаментов.
Содержание в организме
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·СаF2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 1-2 г. При недостатке фосфора в организме развиваются различные заболевания костей.
Физиологическое действие
Соединения фосфора токсичны. Смертельная доза белого фосфора - 50-150 мг. Попадая на кожу, белый фосфор дает тяжелые ожоги. Боевые отравляющие вещества зарин, зоман, табун являются соединениями фосфора. Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2-3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении - промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе 0,03 мг/м3. Пыль красного фосфора, попадая в легкие, вызывает пневмонию.
ФОСФОР (лат. Phosphorus) - Р, химический элемент V группы периодической системы Менделеева, атомный номер 15, атомная масса 30,97376. Название от греч. phosphoros - светоносный. Образует несколько модификаций - Белый фосфор (плотность 1,828 г/см³, tпл 44,14 .С), красный фосфор (плотность 2,3 г/см³, tпл 590 .С) и др. Белый фосфор легко самовоспламеняется, светится в темноте (отсюда название), ядовит; красный менее активен химически, ядовит. Добывают из апатитов и фосфоритов. Главный потребитель - сельское хозяйство (фосфорные удобрения); применяется в спичечном производстве, металлургии (раскислитель и компонент некоторых сплавов), в органическом синтезе и др. Присутствует в живых клетках в виде орто- и пирофосфорной кислот и их производных.
-----------------------------------
ФОСФОР (греч. светоносный) - в греческой мифологии божество утренней зари, одно из прозвищ Венеры. В римской мифологии - Люцифер.
-а, м.
Химический элемент, легко воспламеняющееся и светящееся в темноте вещество, содержащееся в некоторых минералах, в организме животных и растений.
Белый фосфор. Красный фосфор.
[От греч. φωσφόρος - светоносный]
P (phosphorus),
неметаллический химический элемент, член семейства азота (N, P, As, Sb, Bi) - VA подгруппы периодической системы элементов. Соединения фосфора используют как удобрения, моющие средства, фармацевтические препараты, безопасные спички, опреснители воды. Открыт в 1669 Х.Брандом, гамбургским алхимиком и лавочником в процессе поиска философского камня. При нагревании смеси белого песка и выпаренной мочи он получил белое твердое вещество, светящееся в темноте и самопроизвольно воспламеняющееся на воздухе. В 1771 К.Шееле получил это вещество в большом количестве при нагревании костной золы (фосфат кальция), смешанной с углем и песком.
Распространенность в природе. Фосфор широко распространен в природе и составляет 0,12% земной коры. Он входит в состав белков растительного и животного происхождения. Человеческий скелет содержит примерно 1400 г фосфора, мышцы - 130 г, мозг и нервы - 12 г. Фосфор составляет существенную долю в химическом составе растений и поэтому является важным удобрением. Основным сырьем для производства удобрений служат апатит CaF2Ч3Ca3(PO4)2 и фосфориты, основой которых являются фосфат кальция Ca3(PO4)2. Элементный фосфор получают электротермическим восстановлением при 1400-1600° С из фосфоритов и апатитов в присутствии SiO2. Апатит добывают в России, Бразилии, Финляндии и Швеции. Крупным источником фосфора является фосфоритовая руда, в больших количествах добываемая в США, Марокко, Тунисе, Алжире, Египте, Израиле. Гуано, другой источник фосфора, добывают на Филиппинах, Сейшельских островах, в Кении и Намибии.
Свойства. Фосфор имеет три аллотропические модификации. Белый в чистом виде (или желтый - товарный продукт) фосфор октаэдрической структуры очень реакционноспособен, фосфоресцирует, на холоду хрупкий, но при температуре выше 15° С настолько мягок, что режется ножом. Он нерастворим в воде, и его хранят в воде, так как на воздухе он самовоспламеняется. Фосфор растворяется в сероуглероде, эфире и скипидаре. Белый фосфор сильно ядовит, даже в малых дозах смертелен. Красный пластинчатый фосфор (плотность 2,3 г/см3) менее реакционноспособен. Он не загорается до 240° С, не плавится при нагревании и не растворяется в воде и сероуглероде. Красный фосфор относительно нетоксичен, и поэтому его используют в производстве спичек. Ниже 1500° С фосфор имеет состав P4, а выше 1700° C - P2. Белая модификация может переходить в красную при нагревании в отсутствие воздуха. Белый фосфор, находящийся в горячей воде, энергично окисляется при пропускании кислорода. При этом образуются фосфорные кислоты. Еще одна модификация фосфора - черный фосфор - чешуйчатое кристаллическое вещество, напоминающее графит. Он получается нагреванием белого фосфора под давлением. Его плотность 2,25-2,69 г/см3. Черный фосфор - полупроводник. СВОЙСТВА ФОСФОРА
Атомный номер 15 Атомная масса 30,97376 Изотопы
стабильные 31
нестабильные 32, 33
Температура плавления, ° С 44,14 (бел.) Температура кипения, ° С 280 (бел.) Температура самовоспламенения, ° С 44 (бел.) Плотность, г/см3 1,83 (бел.), 2,3 (красн.), 2,25-2,69 (черн.) Содержание в земной коре, (масс.) 0,12 Степени окисления -3, +3, +5 (реже -2, 0, +1, +2) Свободный фосфор очень активен, особенно белый, который на воздухе самовозгорается. При горении образует густой белый дым, что используется для создания дымовых завес. Фосфор непосредственно реагирует со многими простыми веществами (с кислородом, галогенами, серой, со многими металлами) с выделением большого количества теплоты. Все эти свойства ярче выражены у белого фосфора, красный фосфор реагирует не столь энергично, черный - с трудом вступает в химические реакции.
Соединения фосфора.
Фосфин PH3 - бесцветный газ с запахом чеснока. Очень ядовит. Сгорает с образованием фосфорного ангидрида P2O5. С наиболее сильными кислотами (HClO4, HCl) образует соли фосфония PH4+ - очень непрочные соединения, которые при действии воды разлагаются на фосфин и HCl. Хлорид фосфора(III) PCl3 - жидкость, кипящая при 75° С. Под действием воды полностью разлагается на HCl и фосфорную кислоту H3PO3. Хлорид фосфора(V) PCl5 - твердое белое вещество. Получается при пропускании хлора в PCl3. Водой разлагается на HCl и фосфорную кислоту H3PO4. Аналогичные соединения образуются с бромом, иодом и фтором, но соединение PI5 неизвестно. Оксид фосфора(III) P2O3 (устар. фосфористый ангидрид) - белое кристаллическое вещество, плавящееся при 23,8° С. Образуется при медленном окислении или горении фосфора при ограниченном доступе кислорода. Молекулярная формула при низких температурах - P4O6. Медленно реагирует с холодной водой с образованием фосфористой кислоты H3PO3. И P2O3, и H3PO3 - сильные восстановители. Оксид фосфора(V) P2O5 (устар. фосфорный ангидрид) - белое снегообразное вещество, образуется при горении фосфора на воздухе. Молекулярная формула в парах P4O10. Возгорается при 35° С, плавится при 420° С. Очень гигроскопичен; на воздухе, поглощая влагу, расплывается, образуя метафосфорную кислоту. Применяется как осушитель газов и жидкостей, не взаимодействующих с ним, как агент конденсации и дегидрации в химических реакциях синтеза, катализатор полимеризации изобутилена, компонент фосфатных стекол. Фосфорная (ортофосфорная) кислота H3PO4 - бесцветное прозрачное кристаллическое вещество, плавится при 42,35° С, хорошо растворима в воде. Трехосновная кислота, образует средние (фосфаты) и кислые (гидрофосфаты) соли. Дигидрофосфаты растворимы в воде; гидрофосфаты и фосфаты растворимы лишь в случае солей щелочных металлов и аммония. Соли фосфорной кислоты входят в состав простых фосфорных удобрений - суперфосфата Ca(H2PO4)2, преципитата CaHPO4 - и сложных минеральных удобрений - аммофоса, нитрофоски и др.
Органические соединения фосфора содержат связь P-C. Имеют широкий спектр применения в качестве лекарственных препаратов, экстрагентов, пластификаторов, гидравлических жидкостей, теплоносителей, инсектицидов.
См. также
ЛИТЕРАТУРА
Астахов К.В. Фосфор. М., 1972 Корбридж Д. Фосфор. Основы химии, биохимии, технологии. М., 1982
ФОСФОР (Phosphorus), P, химический элемент V группы периодической системы, атомный номер 15, атомная масса 30,97376; неметалл белого (светится на воздухе, tпл 44,14°C), красного (tпл 593°C) или черного (tпл 1000°C) цвета. Фосфор используют в производстве фосфорной кислоты и фосфорных удобрений, полупроводниковых материалов, как компонент покрытий стальных изделий и т.д. Белый фосфор применяют для изготовления трассирующих боеприпасов, как дымообразующее и зажигательное средство, красный фосфор - основной компонент обмазки зажигательной поверхности спичечных коробков. Открыт немецким алхимиком Х. Брандом в 1669.
мед. фосфор (phosphorus)
- Необходим для нормальной структуры костей, ногтей и зубов и их крепости.
- Важен для усвоения глюкозы и превращения ее в энергию.
Фосфор содержится в молочных продуктах, мясе, рыбе, зернобобовых.
Недостатка фосфора в организме практически не встречается.
см. тж микроэлементы
фо́сфор, фо́сфоры, фо́сфора, фо́сфоров, фо́сфору, фо́сфорам, фо́сфором, фо́сфорами, фо́сфоре, фо́сфорах
Заимств. в XVIII в. из языка ученой латыни, где оно восходит к греч. phōsphoros «светоносный». Вещество названо по его свойству светиться за счет ранее поглощенной энергии.
ФОСФОР а, м. phosphore m.<гр. phos свет + phoros несущий. Распространенный химический элемент, играющий большую роль в жизнедеятельности животных и растений. Белый, красный, черный фосфор. БАС-1. Бывают натуральные и произведенные искусством фосфоры. Первые суть светящиеся червячки, устрицы, фолады, гнилушки. Карамзин ДВ 12 81. // Сл. 18 5 143. || Разновидность этого элемента - похожее на воск, самовозгорающееся на воздухе ядовитое вещество. БАС-1. И вот она приняла фосфор. Но судьба против нее .. На сцену является доктор, и она спасена. Горький "Ее медовый месяц". - Лекс. Нордстет 1782: фосфо/р; САР 1794: фо/сфор; САН 1847: фо/сфор; Даль-1: фо/сфор и фосфо/р; Уш. 1940: фо/сфор.
ФОСФОР (греч., от phos - свет, и phoros - несущий). Простое тело, желтоватого цвета, легко воспламеняющееся и светящееся в темноте.
- Этот элемент, его первооткрыватель Брант принял в 1669 году за пресловутый философский камень.
- Химический элемент, содержащийся в некоторых минералах, в костях животных, в животных и растительных тканях.
- Может, вы и не помните, что этот элемент имеет номер 15 в таблице Менделеева, но наверняка помните, что его можно было найти на морде собаки Баскервилей.
- «Светоносный» среди химических элементов.
- Светящийся грим собаки Баскервилей.
- Химический элемент, P.
- Какой химический элемент был открыт в результате опытов с человеческой мочой?
- На гербе государства Науру можно увидеть алхимический символ этого элемента, ведь содержащие его минералы когда-то были залогом процветания здешней экономики.
- Вещество, которое получил первым в 1669 году гамбургский химик Брандт, пытаясь найти философский камень.
ФОСФОР (в мифологии) - ФО́СФОР (греч. светоносный), в греческой мифологии божество утренней зари, одно из прозвищ Венеры (см. ВЕНЕРА (в мифологии)). В римской мифологии - Люцифер.
Фо́сфора окси́ды - Наиболее важны Р2О3 (или Р4О6) с tпл 23,9°C и Р2О5 (или Р4О10) с tпл 420°C. Р2О5 - осушитель газов и жидкостей, дегидратирующий агент, катализатор полимеризации изобутилена, компонент фосфатных стёкол и др.
* * *
ФОСФОРА ОКСИДЫ - ФО́СФОРА ОКСИ́ДЫ, Р4О6, (РО2)n, Р4О10. Наиболее важны Р4О6 (фосфористый ангидрид) с tпл 23,9 °С и Р4О10 (фосфорный ангидрид). Последние также обозначают формулами Р2О3 и Р2О5 соответственно. Р2О5 - осушитель газов и жидкостей, дегидратирующий агент, катализатор полимеризации изобутилена, компонент фосфатных стекол и др.
ФОСФОРА ОКСИДЫ - Р4О6, (РО2)n, Р4О10. Наиболее важны Р4О6 (фосфористый ангидрид) с tпл 23,9 .С и Р4О10 (фосфорный ангидрид). Последние также обозначают формулами Р2О3 и Р2О5 соответственно. Р2О5 - осушитель газов и жидкостей, дегидратирующий агент, катализатор полимеризации изобутилена, компонент фосфатных стекол и др.
Фо́сфора хлори́ды - Трихлорид PCl3 - бесцветная дымящая на воздухе жидкость с резким запахом; tпл -90,34°C, tкип 75,3°C; полупродукт в синтезе фосфорорганических соединений. Пентахлорид PCl5 - зеленовато-белые кристаллы; tпл 160°C; хлорирующий агент в органическом синтезе. Фосфора хлориды ядовиты.
* * *
ФОСФОРА ХЛОРИДЫ - ФО́СФОРА ХЛОРИ́ДЫ, трихлорид PCl3 - бесцветная дымящая на воздухе жидкость с резким запахом; tпл 90,34 °С, tкип 75,3 °С; полупродукт в синтезе фосфорорганических соединений. Пентахлорид PCl5 - зеленовато-белые кристаллы; tпл 160 °С (в запаянной трубке); хлорирующий агент в органическом синтезе. Хлориды фосфора ядовиты.
ФОСФОРА Хлориды - трихлорид PCl3 - бесцветная дымящая на воздухе жидкость с резким запахом; tпл 90,34 .С, tкип 75,3 .С; полупродукт в синтезе фосфорорганических соединений. Пентахлорид PCl5 - зеленовато-белые кристаллы; tпл 160 .С (в запаянной трубке); хлорирующий агент в органическом синтезе. Хлориды фосфора ядовиты.
ж.
Свойство некоторых веществ светиться (сначала - под влиянием освещения, а затем - и после прекращения действия света).
ФОСФОРЕСЦЕ́НЦИЯ, фосфоресценции, мн. нет, жен. (от греч. phosphoros - светоносный) (физ.). Свойство некоторых веществ светиться сначала под влиянием освещения, а затем и после прекращения его, в темноте, подобно фосфору.
ФОСФОРЕСЦЕ́НЦИЯ -и; ж. [от греч. phōsphoros - светоносный и лат. -escentia - суффикс, обозначающий слабое действие] Физ. Свечение некоторых веществ, продолжающееся длительное время после того, как прекратится вызвавшее это свечение действие света или действие электрического поля. Ф. - один из видов люминесценции. // Свечение, вызываемое обычно светящимися бактериями. Ф. мяса. Ф. моря.
* * *
фосфоресце́нция - люминесценция более длительная, чем флуоресценция (граница условна). Фосфоресценция может продолжаться после прекращения возбуждения от нескольких мкс до нескольких суток. Наблюдается у кристаллофосфоров, органических люминофоров и жидкостей. Происходит при квантовых переходах из электронных метастабильных состояний в нормальное.
* * *
ФОСФОРЕСЦЕНЦИЯ - ФОСФОРЕСЦЕ́НЦИЯ, люминесценция более длительная, чем флуоресценция (см. ФЛУОРЕСЦЕНЦИЯ) (граница условна). Фосфоресценция может продолжаться после прекращения возбуждения от нескольких микросекунд до нескольких суток. Наблюдается у кристаллофосфоров, органических люминофоров и жидкостей. Происходит при квантовых переходах из электронных метастабильных состояний (см. МЕТАСТАБИЛЬНОЕ СОСТОЯНИЕ) в нормальное.
ФОСФОРЕСЦЕНЦИЯ - люминесценция более длительная, чем флуоресценция (граница условна). Фосфоресценция может продолжаться после прекращения возбуждения от нескольких микросекунд до нескольких суток. Наблюдается у кристаллофосфоров, органических люминофоров и жидкостей. Происходит при квантовых переходах из электронных метастабильных состояний в нормальное.
-и, ж. физ.
Свечение некоторых веществ, продолжающееся длительное время после того, как прекратится вызвавшее это свечение действие света или действие электрического поля.
[От греч. φωσφόρος - светоносный]
фосфоресце́нция, фосфоресце́нции, фосфоресце́нций, фосфоресце́нциям, фосфоресце́нцию, фосфоресце́нцией, фосфоресце́нциею, фосфоресце́нциями, фосфоресце́нциях
ФОСФОРЕСЦИ́РОВАТЬ, фосфоресцирую, фосфоресцируешь, несовер. (физ.). Обладать фосфоресценцией, светиться в темноте. Хорошо фосфоресцируют сернистые соединения кальция, бария и стронция. Фосфоресцирующее вещество.
ФОСФОРЕСЦИ́РОВАТЬ -рую, -руешь; нсв. Обладать фосфоресценцией; светиться в темноте слабым голубовато-зеленоватым светом. Волны моря фосфоресцируют. Некоторые бактерии фосфоресцируют.
◁ Фосфоресци́рование, -я; ср. Ф. светлячков.
-рую, -руешь; несов.
Обладать фосфоресценцией; светиться в темноте слабым голубовато-зеленоватым светом.
Когда вода сбегает, на льду остается зеленоватое фосфорическое свечение. --- Ведь так вот фосфоресцируют волны Индийского океана! Бадигин, Три зимовки во льдах Арктики.
[Рябинин] извлек из-под пальто карманные часы. Фосфоресцирующие стрелки показывали несколько минут шестого. Березко, Ночь полководца.
фосфоресци́ровать, фосфоресци́рую, фосфоресци́руем, фосфоресци́руешь, фосфоресци́руете, фосфоресци́рует, фосфоресци́руют, фосфоресци́руя, фосфоресци́ровал, фосфоресци́ровала, фосфоресци́ровало, фосфоресци́ровали, фосфоресци́руй, фосфоресци́руйте, фосфоресци́рующий, фосфоресци́рующая, фосфоресци́рующее, фосфоресци́рующие, фосфоресци́рующего, фосфоресци́рующей, фосфоресци́рующих, фосфоресци́рующему, фосфоресци́рующим, фосфоресци́рующую, фосфоресци́рующею, фосфоресци́рующими, фосфоресци́рующем, фосфоресци́ровавший, фосфоресци́ровавшая, фосфоресци́ровавшее, фосфоресци́ровавшие, фосфоресци́ровавшего, фосфоресци́ровавшей, фосфоресци́ровавших, фосфоресци́ровавшему, фосфоресци́ровавшим, фосфоресци́ровавшую, фосфоресци́ровавшею, фосфоресци́ровавшими, фосфоресци́ровавшем
ФОСФОРИЗОВАТЬ phosphoriser. Издавать фосфорический свет, светить собою, от себя и без огня. Даль.
Фосфорила́зы - ферменты, катализирующие в клетках присоединение остатка фосфорной кислоты к углеводам и другим веществам. Играют ключевую роль в мобилизации запасных углеводов, участвуя в расщеплении крахмала и гликогена.
* * *
ФОСФОРИЛАЗЫ - ФОСФОРИЛА́ЗЫ, ферменты, катализирующие в клетках присоединение остатка фосфорной кислоты к углеводам и др. веществам. Играют ключевую роль в мобилизации запасных углеводов, участвуя в расщеплении крахмала и гликогена.
ФОСФОРИЛАЗЫ - ферменты, катализирующие в клетках присоединение остатка фосфорной кислоты к углеводам и др. веществам. Играют ключевую роль в мобилизации запасных углеводов, участвуя в расщеплении крахмала и гликогена.
Фосфорили́рование - введение в органическое соединение остатка какой-либо фосфорной кислоты (обычно ортофосфорной Н3РО4), например:
С2Н5ОН+ClP(O)(OCH3)2→С2Н5OP(O)(ОСН3)2+HCl.
Так называемое биологическое фосфорилирование играет важную роль в обмене веществ (в процессах окисления, при синтезе белков, нуклеиновых кислот и др.).
* * *
ФОСФОРИЛИРОВАНИЕ - ФОСФОРИЛИ́РОВАНИЕ, введение в органическое соединение остатка какой-либо фосфорной кислоты (обычно ортофосфорной Н3РО4) или ее производных, напр.:
C2H5OH + CIP(O)(OCH3)2 ® C2H5OP(O)(OCH3)2 + HCl.
Т. н. биологическое фосфорилирование играет важную роль в обмене веществ (в процессах окисления, при синтезе белков, нуклеиновых кислот и др.).
ФОСФОРИЛИРОВАНИЕ - введение в органическое соединение остатка какой-либо фосфорной кислоты (обычно ортофосфорной Н3РО4) или ее производных, напр.:C2H5OH + CIP(O)(OCH3)2 ? C2H5OP(O)(OCH3)2 + HCl.Т. н. биологическое фосфорилирование играет важную роль в обмене веществ (в процессах окисления, при синтезе белков, нуклеиновых кислот и др.).
ФОСФОРИСТЫЕ КИСЛОТЫ - ФО́СФОРИСТЫЕ КИСЛО́ТЫ: ортофосфористая Н3РО3, пирофосфористая Н4Р2О5 и метафосфористая НРО2. Н3РО3 в безводном состоянии - бесцветные гигроскопические кристаллы, tпл 74 °С. Фосфористые кислоты и их соли применяют как восстановители.
ФОСФОРИСТЫЕ КИСЛОТЫ: ортофосфористая Н3РО3 - пирофосфористая Н4Р2О5 и метафосфористая НРО2. Н3РО3 в безводном состоянии - бесцветные гигроскопические кристаллы, tпл 74 .С. Фосфористые кислоты и их соли применяют как восстановители.
ФО́СФОРИСТЫЙ -ая, -ое.
1. Содержащий фосфор. Ф. чугун. Ф-ая кислота. Ф-ая сера. Ф. водород.
2. = Фосфори́ческий. Ф. свет.
-ая, -ое.
1. Содержащий фосфор.
Фосфористый чугун. Фосфористая кислота.
2. То же, что фосфорический.
Зеленым фосфористым светом Мерцают цифры на щите. Сурков, Ночники.
фо́сфористый, фо́сфористая, фо́сфористое, фо́сфористые, фо́сфористого, фо́сфористой, фо́сфористых, фо́сфористому, фо́сфористым, фо́сфористую, фо́сфористою, фо́сфористыми, фо́сфористом, фо́сфорист, фо́сфориста, фо́сфористо, фо́сфористы, фо́сфористее, пофо́сфористее, фо́сфористей, пофо́сфористей