АТО, ато ж, атожно, нареч., южн. а как же, как иначе; да, так, вестимо. Будешь ли завтра? Ато или ато-ништо.
| Неужели, неужто. Старуха-то померла. "Ато ж?"
| Ато употр. и как союз: ан, лих. Я найду его. "Ато, не найдешь!".
АТО, ато ж, атожно, нареч., южн. а как же, как иначе; да, так, вестимо. Будешь ли завтра? Ато или ато-ништо.
| Неужели, неужто. Старуха-то померла. "Ато ж?"
| Ато употр. и как союз: ан, лих. Я найду его. "Ато, не найдешь!".
АТО (3*) част. То же, что ать:
Изѩслав же... рекъ брате ѣди к митрополиту. и съзови Кы˫аны всѣ. ато молвита си мужа. лесть Черниговски(х) кнѩзии. ЛЛ 1377, 105 (1147); и ре(ч) Володимеръ к митрополиту. се прислалъ || бра(т) мои в҃ мужа Кы˫анина. ато молвѩть бра(т)ѣ своеи. Там же, 105-105 об. (1147); и приѣхавъше видѣша Игорѩ лежаща. и рекоста се оуже Игорѩ есте оубили. ато похорони(м) тѣло его. Там же, 106 (1147).
м.
Коралловый остров, имеющий форму кольца - иногда разорванного - с мелководной лагуной внутри (обычно в Индийском и Тихом океанах).
АТОЛЛ - муж. коралловый остров незамкнутым кольцом; кольчатая, лагунная гряда, остров, выведенный исподволь мельчайшими черепокожными, с озером или лагуном посредине (лагуну позволительно переделать в русское лагун).
АТО́ЛЛ -а; м. [англ. atoll]. Коралловый остров кольцеобразной формы с мелководной лагуной внутри (преимущественно в Индийском и Тихом океанах).
* * *
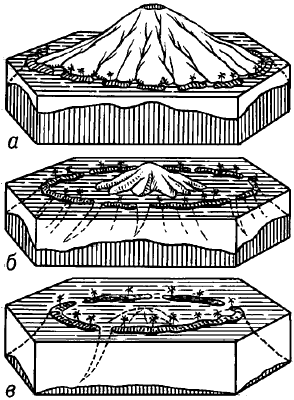
ато́лл - коралловое сооружение, имеющее форму сплошного или разорванного кольца, окружающего мелководную лагуну. Основанием для атолла служит обычно вершина подводного вулкана (рис. а, б, в). Распространены в тропических широтах Тихого и Индийского океанов.
* * *
АТОЛЛ - АТО́ЛЛ, коралловое сооружение, имеющее форму сплошного или разорванного кольца, окружающего мелководную лагуну (см. ЛАГУНА).
Основанием для атолла служит обычно вершина подводного вулкана. Распространены в тропических широтах Тихого и Индийского океанов.
АТОЛЛ - коралловое сооружение, имеющее форму сплошного или разорванного кольца, окружающего мелководную лагуну. Основанием для атолла служит обычно вершина подводного вулкана. Распространены в тропических широтах Тихого и Индийского океанов.
-а, м.
Коралловый остров, имеющий форму сплошного или разорванного кольца.
Взгляды наши были устремлены на коралловые атоллы, обрамленные перистой бахромой кокосовых пальм. Новиков-Прибой, Цусима.
[англ. atoll из мальдивск.]
АТОЛЛ - коралловый риф кольцеобразной формы, окружающий акваторию. Коралловые рифы распространены в тропических и субтропических широтах, причем наиболее широко - в Тихом и Индийском океанах. Слово "атолл" произошло от названия, используемого у народов Океании для рифов, образующих цепь небольших островов, возвышающихся на 4-6 м над поверхностью воды. Иногда рифы бывают затоплены, а между отдельными их частями имеются глубокие проливы. Озероподобные акватории внутри атоллов называются лагунами. Обычно их глубина 18-30 м, но иногда достигает 90 м.
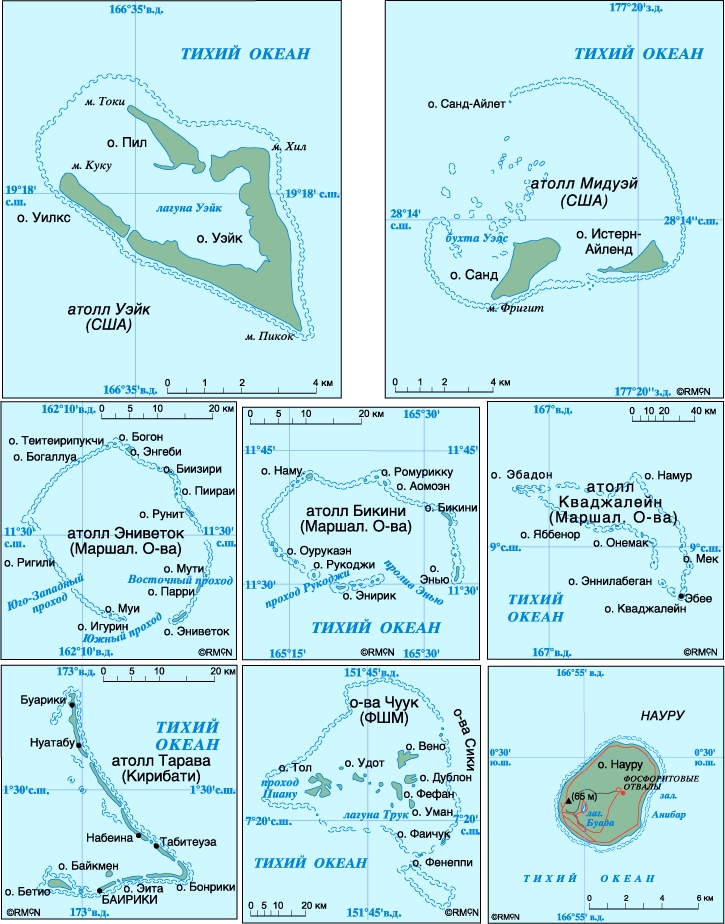
Карты атоллов Уэйк, Мидуэй, Эниветок, Бикини, Кваджалейн, Тарава, Чуук и Науру в Тихом океане.
Строение. Основным материалом, из которого построены коралловые рифы, является известняк, образовавшийся в результате аккумуляции скелетов морских животных и растений, содержащих карбонат кальция, главным образом кораллов и водоросли кораллина. Островки, разбросанные вдоль рифов, обычно состоят из известняковых обломков и крошки - продуктов волновой деятельности. Нередко из этого материала под воздействием ветра формируются небольшие дюны. Внешний берег большинства атолловых островов представляет собой довольно узкую полосу окаймляющих рифов, часто имеющих ровную кайму из массивных известковых водорослей розового цвета и крутые узкие пляжи, сложенные обломками известняка. За береговым валом пляжа крупнообломочный материал сменяется щебнем, который далее по мере измельчения заменяется гравием. В центре островка часто находится понижение, заполненное засоленной прокрашенной гумусом почвой. Внутренняя часть островка обычно сложена крупнозернистым коралловым песком или мелким гравием, а центральные участки пляжа - тонким известковым песком. Если атолл полностью поднят над уровнем моря, то слагающие его известняки обычно выветриваются и образуют шероховатую поверхность - "макатеа". Там очень близок уровень грунтовых вод, и мелкие колодцы часто копают близ центра островков. Если островок большой или выпадает много осадков, то грунтовые воды почти пресные, если же он мал или расположен в районе с небольшим количеством дождевых осадков, то грунтовые воды солоноватые или соленые.
Флора. Растительный покров является наиболее примечательной характеристикой поверхности атоллов. Он разрежен и чаще всего состоит из нескольких видов широко распространенных травянистых растений и древесных пород, обитающих в прибрежной полосе. В распределении растительности наблюдается определенная зональность по направлению от внешнего края атолла к внутреннему. Она может быть в общих чертах описана для всего Индо-Тихоокеанского региона, где атоллы особенно многочисленны, а их флора однотипна. Внешняя зона представлена кустарниками, среди которых преобладает сцевола кустарниковая (Scaevola frutescens). Далее следуют леса, в основном из таких галофитов, как мессершмидия серебристая (Messerschmidia argenta) и панданус кровельный (Pandanus tectorius). Еще дальше от берега становится меньше галофитов, и появляются кордия (Cordia), пизония большая (Pisonia grandis), охрозия (Ochrosia) и другие виды. В центре в более мезофитных условиях первичный растительный покров состоял, вероятно, из таких деревьев, как гетарда великолепная (Guettarda speciosa), гибискус липовидный (Hibiscus tiliacens), фикусы, пизонии, панданусы, баррингтония азиатская (Barringtonia asiatica), терминалии (Terminalia) и др. На большинстве островов эти леса впоследствии были замещены плантациями кокосовых пальм и хлебного дерева. Для внутренней зоны пляжей характерна узкая полоса из таких деревьев, как эрнандия, калофиллум, панданус, теспезия, кордия. На песчаных косах между островками обычно встречаются суриана приморская (Suriana maritima) и сцевола, а на выходах скальных пород - пемфис кисловатый (Pemphis acidula). Местами во внутренних частях островков встречаются переувлажненные понижения, причем на некоторых из них они приурочены к твердым породам. В таких условиях встречаются некоторые древесные породы, типичные для мангровых болот. Другие островки заболочены и безлесны, на них доминируют злаки и осоки. На обитаемых островках из этих депрессий вынимают грунт, и заполняют их перегноем, а затем используют для выращивания таро, сахарного тростника и других растений. Вследствие засоленности почвы немногие (за исключением перечисленных выше) культурные растения могут расти на низких коралловых островках. Таро, хлебное дерево и кокосы - основная пища населения, кроме того, кокосы являются источником питьевой воды.
Прочие природные ресурсы. Подавляющее большинство атоллов заселено, и там выращивание сельскохозяйственных культур зависит от потенциального плодородия обедненных питательными веществами засоленных почв. Основной культурой являются кокосы. Наряду с вышеперечисленными растениями основу пищевого рациона населения составляют рыба и моллюски, которыми изобилуют лагуны, рифы и прилегающие открытые акватории. Предметами торговли являются также гуано, жемчуг, раковины для изготовления пуговиц и сушеные голотурии. Наиболее плодородны возвышающиеся над уровнем моря крупные атоллы, особенно если они приурочены к очень влажным районам. Они отличаются гораздо более пышной растительностью, более богатой флорой и намного более разнообразным набором сельскохозяйственных культур. По-видимому, все это связано с меньшей засоленностью почв. На поднятых атоллах часто встречаются крупные месторождения фосфоритов (образовавшихся, вероятно, из древних залежей гуано). К таким атоллам относятся острова Макатеа, Науру, Ошен, Ангаур. Залежи гуано на многих атолловых островах сформировались в результате жизнедеятельности морских птиц - олуш, фрегатов, крачек и тропических птиц, которые здесь и размножаются. Кроме перечисленных птиц и сухопутных крабов, в том числе пальмового вора, наземная фауна бедна: доминируют крысы, а в западной части Тихого океана многочисленны крыланы (плодоядные летучие мыши). Воды изобилуют черепахами, лангустами, гигантскими двустворчатыми моллюсками, многими видами рыб. Богатая фауна рифов включает множество видов беспозвоночных.
Известные атоллы. Наиболее крупными группами атоллов в Индийском океане являются Мальдивские и Лаккадивские о-ва; в Тихом океане - острова Каролинские, Маршалловы, Гилберта в Микронезии, Туамоту и другие в Полинезии; большое количество атоллов разбросано по всей Меланезии. В Атлантическом океане имеется несколько атоллов в группе Малых Антильских о-вов, кроме того, Багамские о-ва включают ряд нетипичных атоллов. Наиболее крупным по площади атоллом (с относительно небольшой лагуной в центре) является о.Рождества в экваториальной части Тихого океана. Самая большая лагуна расположена, по-видимому, на атолле Кваджалейн (Маршалловы о-ва), хотя почти такие же по размерам лагуны встречаются и на некоторых других атоллах.
См. также КОРАЛЛОВЫЕ РИФЫ.
ЛИТЕРАТУРА
Равикович А.И. Современные и ископаемые рифы. М., 1954 География атоллов юго-западной части Тихого океана. М., 1973
АТОЛЛ (от малайского адол - замкнутый), коралловая постройка с мелкой лагуной посередине, через один или несколько проливов соединяющаяся с океаном. Основанием для атолла служит обычно вершина подводного вулкана. Распространены в тропических широтах Тихого (самый крупный атолл в мире, площадь 2850 км2, - Квайлейн, Маршалловы острова) и Индийского океанов.
сущ., кол-во синонимов: 9
бикини (5)
диего-гарсия (1)
макатеа (1)
мидуэй (2)
науру (4)
остров (218)
пукапука (1)
риф (6)
фунафути (3)
ато́лл
(англ. atoll мальдивск.) коралловый остров кольцеобразной формы, внутри заключающий мелководную лагуну, обычно соединяющуюся узким каналом с открытым морем; атоллы распространены гл. обр. в тропической части тихого и индийского океанов.
АТОЛЛ а, м. atoll m., англ. Коралловый остров. Атолловый ая, ое. Иногда в нору просовывались щупальца спрута, который, видимо, методично обшаривал атолловую банку. А. Ким Рыба Simplicitas. // НМ 1997 4 102. - Лекс. Даль: атол; Толль 1863: атолл; САН 1891: ато/лл.
- «Бублик» из коралловых рифов.
- Остров без начала и конца.
- «Окантовка» лагуны.
- Остров без середины.
- Остров, похожий на бублик.
- Остров кольцом.
- Остров с дыркой.
- Коралловый остров.
- Остров погибших кораллов.
- Бикини как географический объект.
- Естественное сооружение из кораллов.
ато́лловый, ато́лловая, ато́лловое, ато́лловые, ато́ллового, ато́лловой, ато́лловых, ато́лловому, ато́лловым, ато́лловую, ато́лловою, ато́лловыми, ато́лловом, ато́ллов, ато́ллова, ато́ллово, ато́лловы, ато́лловее, поато́лловее, ато́лловей, поато́лловей
АТОЛЛОН а, м. atollon. геогр. Атолл. Сл. 18. Атоллоны - отдельные острова, образующие кольца атолла. Они часто имеют собственную лагуну или представляют собой неполное кольцо, открывающееся в сторону главной лагуны широким каналом. ГС 1978. Каждой Атоллон содержит в себе великое множество островов. Ист. Бюфф. 1 239. - Лекс. Сл. 18: атоллон 1785.
I м.
1. Мельчайшая электрически нейтральная частица химического элемента, являющаяся носителем его свойств.
2. разг.
Атомная энергия.
II м.
Мельчайшая структурная единица чего-либо; частица.
А́ТОМ, атома, муж. (греч. atomos, букв. неделимый). Мельчайшая частица материи (в атомистической теории предполагалась неделимой; ест.). Молекула воды состоит из двух атомов водорода и одного атома кислорода.
|| перен. Ничтожная величина, одна из многих незначительных частей какого-нибудь целого (книжн.).
А́ТОМ, -а, муж. Мельчайшая частица химического элемента, состоящая из ядра и электронов.
| прил. атомный, -ая, -ое и атомарный, -ая, -ое. Атомный вес. Атомное ядро. Атомная физика (раздел физики, в к-ром изучается строение и состояние атомов). Атомная энергия. Атомная электростанция. Атомная бомба. Атомарный кислород. Атомный век (период развития общественной жизни и науки, характеризующийся открытием атомной энергии).
АТОМ - муж., греч. неделимое; вещество в крайних пределах делимости своей, незримая пылинка, из каких будто бы составлены все тела, всякое вещество, как бы из песчинок.
| Неизмеримая, бесконечно малая пылинка, ничтожное количество.
| У химиков слово атом принимает значение меры сродства тел: один атом кислорода поглощает один, два, три атома железа, значит: вещества эти соединяются в таком кратном отношении. Атомизм муж. атомистическое, атомическое учение, в физике, принимающее за основание, что всякое вещество состоит из неделимых атомов; атомистика жен. наука, знание это; атомист муж. ученый, который держится этого убеждения. Ему противополагается динамик, динамическая школа, отвергающая предел делимости вещества и признающая его за выражение, проявление сил в нашем мире.
А́ТОМ, -а, м
Мельчайшая частица химического элемента, сохраняющая его свойства и состоящая из ядра и электронов.
Атом - носитель свойств химического элемента.
А́ТОМ -а; м. [от греч. atomos - неделимый].
1. Мельчайшая частица химического элемента, сохраняющая его свойства. Строение атома. Меченые атомы (изотопы, применяемые при изучении процессов, происходящих в биологических, механических системах).
2. Публиц. Об атомной энергии, её источниках и потребителях. Мирный, смертоносный а. А. на службе человека.
3. чего. Книжн. Наименьшая структурная единица чего-л.; частица. Клетки - атомы жизни.
◁ А́томный (см.).
* * *
а́том (от греч. átomos - неделимый), мельчайшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны, образующие электронные оболочки, размеры которых (≈10-8см) определяют размеры атома. Ядро атома состоит из протонов и нейтронов. Число электронов в атоме равно числу протонов в ядре (заряд всех электронов атома равен заряду ядра), число протонов равно порядковому номеру элемента в периодической системе. Атомы могут присоединять или отдавать электроны, становясь отрицательно или положительно заряженными ионами. Химические свойства атома определяются в основном числом электронов во внешней оболочке; соединяясь химически, атомы образуют молекулы. Важная характеристика атома - его внутренняя энергия, которая может принимать лишь определенные (дискретные) значения, соответствующие устойчивым состояниям атома, и изменяется только скачкообразно путём квантового перехода. Поглощая определенную порцию энергии, атом переходит в возбуждённое состояние (на более высокий уровень энергии). Из возбуждённого состояния атом, испуская фотон, может перейти в состояние с меньшей энергией (на более низкий уровень энергии). Уровень, соответствующий минимальной энергии атома, называют основным, остальные - возбуждёнными. Квантовые переходы обусловливают атомные спектры поглощения и испускания, индивидуальные для атома всех химических элементов.
* * *
АТОМ - А́ТОМ (от греч. atomos - неделимый), мельчайшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны, образующие электронные оболочки, размеры которых (АТОМ10-8 см) определяют размеры атома. Ядро атома состоит из протонов и нейтронов. Число электронов в атоме равно числу протонов в ядре (заряд всех электронов атома равен заряду ядра), число протонов равно порядковому номеру элемента в периодической системе. Атомы могут присоединять или отдавать электроны, становясь отрицательно или положительно заряженными ионами. Химические свойства атомов определяются в основном числом электронов во внешней оболочке; соединяясь химически, атомы образуют молекулы. Важная характеристика атома - его внутренняя энергия, которая может принимать лишь определенные (дискретные) значения, соответствующие устойчивым состояниям атома, и изменяется только скачкообразно путем квантового перехода (см. КВАНТОВЫЕ ПЕРЕХОДЫ). Поглощая определенную порцию энергии, атом переходит в возбужденное состояние (на более высокий уровень энергии (см. УРОВНИ ЭНЕРГИИ)). Из возбужденного состояния атом, испуская фотон, может перейти в состояние с меньшей энергией (на более низкий уровень энергии). Уровень, соответствующий минимальной энергии атома, называется основным, остальные - возбужденными. Квантовые переходы обусловливают атомные спектры (см. АТОМНЫЕ СПЕКТРЫ) поглощения и испускания, индивидуальные для атомов всех химических элементов.
АТОМ (от греч. atomos - неделимый) - мельчайшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное Ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны, образующие электронные оболочки, размеры которых (~10-8 см) определяют размеры атома. Ядро атома состоит из протонов и нейтронов. число электронов в атоме равно числу протонов в ядре (заряд всех электронов атома равен заряду ядра), число протонов равно порядковому номеру элемента в периодической системе. Атомы могут присоединять или отдавать электроны, становясь отрицательно или положительно заряженными ионами. Химические свойства атомов определяются в основном числом электронов во внешней оболочке; соединяясь химически, атомы образуют молекулы. Важная характеристика атома - его внутренняя энергия, которая может принимать лишь определенные (дискретные) значения, соответствующие устойчивым состояниям атома, и изменяется только скачкообразно путем квантового перехода. Поглощая определенную порцию энергии, атом переходит в возбужденное состояние (на более высокий Уровень энергии). Из возбужденного состояния атом, испуская фотон, может перейти в состояние с меньшей энергией (на более низкий Уровень энергии). Уровень, соответствующий минимальной энергии атома, называется основным, остальные - возбужденными. Квантовые переходы обусловливают атомные спектры поглощения и испускания, индивидуальные для атомов всех химических элементов.
-а, м.
Наименьшая частица химического элемента, которая является носителем его химических свойств.
◊
- меченые атомы
[От греч. ’άτομος - неделимый]
АТОМ (от греч. atomos - неделимый), наименьшая возможная частица любого из простейших химических веществ, называемых элементами. Понятие атома, как и само слово, - древнегреческого происхождения, но только в 20 в. истинность атомной гипотезы была твердо установлена. Основная идея, остававшаяся привлекательной для научного и поэтического воображения во все века, состоит в том, что за непрерывными изменениями наблюдаемого мира кроется некий неизменный мир. Этот мир прост, ибо каждый из атомов в точности тождествен всем остальным атомам того же рода, обладает сравнительно простой структурой и существовал от начала времен. Эти идеи с некоторыми оговорками можно рассматривать как концентрированное выражение самой сути даже абстрактной и изощренной современной теории. Подобно самим атомам, они являются наиболее стойкими из всех идей античной науки. См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ. По-видимому, первыми начали проповедовать атомистическое учение философ Левкипп с острова Милет в 5 в. до н.э. и его более известный ученик Демокрит из Абдеры. И хотя их работы не сохранились, за исключением отдельных фрагментов, все же ясно, что они исходили из небольшого числа простых физических гипотез, а соображения, которые их привели к этим гипотезам, были достаточно абстрактными. По Демокриту, вся природа состоит из атомов, мельчайших частиц вещества, покоящихся или движущихся в абсолютно пустом пространстве. Все атомы имеют простую форму, а атомы одного сорта тождественны; разнообразие природы отражает разнообразие форм атомов и разнообразие способов, которыми атомы могут сцепляться между собой. И Демокрит, и Левкипп учили, что, начав двигаться, атомы затем движутся по законам природы. Эта мысль, если ее последовательно придерживаться, приводит к строго детерминистскому взгляду на природу, в которой случай и свобода воли не играют никакой роли, хотя нет никаких документальных подтверждений того, что основатели атомистической теории доходили до такого вывода. Наиболее трудным для древних греков был вопрос о физической реальности основных понятий атомизма. В каком смысле можно было говорить о реальности пустоты, если она, лишенная вещества, не может обладать никакими физическими свойствами? Ответ Левкиппа был безоговорочен: "то, что есть [[т.е. атомы]], не более реально, чем то, чего нет [[т.е. пустота]]". Аристотель и многие другие находили это утверждение логически неприемлемым. Идеи Левкиппа и Демокрита не могли служить удовлетворительной основой теории вещества и в принципиальном физическом плане, поскольку не объясняли, ни из чего сделаны атомы, ни почему атомы неделимы. В "Тимее", написанном через поколение после Демокрита, Платон предложил чисто платоново решение этих проблем: "мельчайшие частицы" (из осторожности он не называл их атомами) принадлежат не царству материи, а царству геометрии; они представляют собой различные телесные геометрические фигуры, ограниченные плоскими треугольниками. Хотя платоново решение может показаться метафизической уверткой, попыткой избежать ответа на физический вопрос, Платон, как увидим, с его поразительным чутьем на научный факт подошел к современным идеям гораздо ближе, чем Демокрит. Через тысячу лет умозрительные построения древних греков проникли в Индию и были восприняты некоторыми школами индийской философии, правда, с одной характерной и важной поправкой. В западной философии вплоть до конца 1920-х годов считалось, что атомистическая теория должна стать конкретной, объективной основой теории материального мира. Индийская же философия всегда воспринимала объективный материальный мир как иллюзию, и когда атомизм появился в Индии, он принял форму теории, согласно которой реальностью в мире обладает процесс, а не субстанция, что мы присутствуем в мире как звенья процесса, а не как сгустки вещества, и что атомистическими являются именно процессы, особенно порождающие наши ощущения. Хотя для западного ума воспринимать индийские тексты, понимать их и тем более соглашаться с тем, что в них написано, - занятие трудное, все же, как мы увидим, восточные идеи содержат в себе зародыши современного научного образа мыслей. Как бы то ни было, и Платон, и индийские философы имели ответы на центральный вопрос атомистического учения Демокрита: если природа в конечном счете состоит из мельчайших, но имеющих конечные размеры частиц, то почему их нельзя разделить, по крайней мере мысленно, на еще более мелкие части, которые стали бы предметами дальнейшего рассмотрения? Ответ в обоих случаях гласил, что атомистическая реальность не лежит в царстве обычной субстанции. Минули многие века, прежде чем эти альтернативы стало возможно исследовать научными средствами. Но и сегодня мы имеем довольно туманные представления о том, каковы должны быть характер и содержание удовлетворительной теории материи. Идеи Демокрита дошли до нас главным образом через сочинение римского поэта Тита Лукреция Кара (ок. 96 - 55 до н.э.) - обширную поэму О природе вещей (De rerum natura), содержательно и красочно повествующую о происхождении и природе земных вещей. Лукреций подробно излагает атомистическую теорию, дошедшую до него от Левкиппа и Демокрита через учение Эпикура Самосского (ок. 341-270 до н.э.). Он выстраивает факты, свидетельствующие в пользу атомистической теории; ветер, дующий с огромной силой, хотя никто не может видеть его, должно быть, состоит из частиц, слишком малых для того, чтобы их можно было видеть. Мы можем ощущать вещи на расстоянии по запахам, звукам и теплу, хотя все это распространяется, оставаясь невидимым. Для примера Лукреций говорит об одежде, впитывающей влагу на морском берегу у самой воды: "И... на морском берегу, разбивающем волны, Платье сыреет всегда, а на солнце вися, оно сохнет; Видеть, однако, нельзя, как влага на нем оседает, Да и не видно того, как она исчезает от зноя. Значит, дробится вода на такие мельчайшие части, Что недоступны они совершенно для нашего глаза." (Пер. Ф.Петровского, кн. 1, 300-310.)
И хотя сегодня обычно никто не мыслит звук и тепло как состоящие из атомов, другие примеры, приводимые Лукрецием, и с современной точки зрения служат вполне приемлемым подтверждением гипотезы существования атомов. Лукреций связывает свойства вещей со свойствами составляющих их атомов: атомы жидкости малы и округлы, поэтому жидкость течет так легко и проникает сквозь пористое вещество, тогда как атомы твердых веществ имеют крючки, которыми они сцеплены между собой. Точно так же различные вкусовые ощущения и звуки различной громкости и тембра состоят из атомов соответствующих форм - от простых и гармоничных до извилистых и нерегулярных. Лукреций, один из немногих римлян, питавших интерес к чистой науке, был к тому же первым из великих римских поэтов. Но его идеи, как и идеи его учителя Эпикура, допускают интерпретацию, которую можно было бы назвать материалистической: например, представление о том, что Бог, запустив единожды атомный механизм, более не вмешивается в его работу или что душа умирает вместе с телом. Поэтому учения Лукреция и Эпикура были осуждены церковью и оставались почти неизвестными в средние века. Никаких известных рукописей Лукреция, датированных 9-15 вв., не сохранилось, а те немногие фрагменты атомистической философии, которые дошли до нас с того времени, скорее всего представляют плод собственных умозаключений средневековых мыслителей, опирающихся на туманную традицию. В конце 16 в. итальянский философ Дж. Бруно (ок. 1548-1600) странствовал по Европе, проповедуя картину мироздания, в основе которой лежали взгляды Коперника и Лукреция. В обществе, все еще находившемся под сильным влиянием церкви, проповеди Бруно звучали необычайно новаторски и дерзко, и Бруно был приговорен к сожжению на костре. Однако его взгляды не оказали большого влияния на современную науку. Что же касается атомов Бруно, то они имели мало общего с атомами Лукреция, представляя собой философские абстракции, более напоминающие монады Лейбница. Некоторые из первых атомистических представлений, носящих уже современную окраску, появились в сочинении Галилея (1564-1642) Пробирных дел мастер (Il Saggiatore, 1623). Переход был кратким, но явственно ощутимым: вещество состоит из частиц, которые не пребывают в состоянии покоя, а под воздействием тепла движутся во все стороны; тепло - не что иное, как движение частиц. Структура частиц сложна, и если лишить любую частицу ее материальной оболочки, то изнутри брызнет свет. Галилей был первым, кто, хотя и в фантастической форме, представил строение атома, и первым, кто интуитивно угадал важную связь между теориями света и атома, - связь, давшую много открытий в 20 в.
См. также СВЕТ. Относительным забвением сочинений Лукреция, возможно, объясняется, почему Лукрецию уделялось мало внимания как в эпоху Возрождения. Но есть еще одна причина, связанная с утверждением более высокого стандарта знания. Древние не оставили нам в наследство никакого учения о том, что представляют собой атомы, а с пробуждением интереса к этому предмету данный вопрос приобрел первостепенное значение. Первые сведения о свойствах отдельных атомов были почерпнуты из химических опытов в начале 18 в. В античности широкое хождение имела теория, традиционно приписываемая Эмпедоклу (492-432 до н.э.), согласно которой вся материя в конечном счете сводится к четырем элементам (земле, воздуху, огню и воде), смешанным в разных пропорциях. Но такая теория отнюдь не была химической; элементы в античности были придуманы для объяснения таких физических свойств, как влажность и сухость, тепло и холод, стремление к подъему и падению. Никто никогда не рассматривал всерьез возможность того, что существуют только четыре разновидности атомов. Античное представление об атоме, когда его удалось сформулировать явно со всеми подробностями, оказалось более близким нашему представлению о молекуле, ибо в древности предполагалось, что каждое вещество с его особыми свойствами состоит из атомов своего вида. В средние века алхимики (бывшие почти единственными представителями той категории людей, которых ныне называли бы чистыми учеными) правильно идентифицировали такие химические элементы, как сера и ртуть, и ошибочно некоторые другие. Но атомистическая теория в мышлении алхимиков занимала весьма незначительное место, оставаясь в основном достоянием философов.
Научные основы. Научные основы современной атомистической теории были заложены к середине 17 в.; возрождением и распространением эпикурейской философии активно занимался П.Гассенди (1592-1655) в институте Коллеж-де-Франс. В 1758 итальянский иезуит Р.Боскович (1711-1787) высказал плодотворную идею, согласно которой каждый из атомов испытывает со стороны других атомов силы двух типов: короткодействующую силу притяжения (половинки сломанной палки уже не притягивают друг друга) и еще более короткодействующую и более интенсивную силу отталкивания (большинство твердых тел сопротивляется сжатию сильнее, чем растяжению). Между тем в 1738 швейцарский математик и физик Д.Бернулли (1700-1782) использовал атомистическую теорию для объяснения одного из известных свойств газов: если газ сжимать при постоянной температуре, то его давление Р повышается, а объем V уменьшается, причем так, что произведение PV остается постоянным. В своих рассуждениях Бернулли исходил из того, что атомы газа очень малы, что они очень быстро и хаотически движутся и что давление газа есть следствие многочисленных очень слабых ударов атомов о стенки сосуда. Доказательство Бернулли сегодня можно было бы усовершенствовать, но его основные идеи остались бы неизменными.
См. также МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ. Величайший ученый той эпохи И. Ньютон (1643-1727) проявлял живой интерес к атомной гипотезе, хотя разработкой детальной атомистической теории не занимался. На первый взгляд это кажется удивительным, но не следует забывать, что Ньютон обладал необычайно развитой интуицией, позволявшей ему безошибочно выбирать то, что наиболее существенно и чем в науке надлежит в первую очередь заниматься. Ньютон несомненно сознавал, что без качественного улучшения экспериментальной техники физический подход в атомистике (в отличие от химического) позволит получить лишь скудные и разрозненные обрывки знаний. К концу жизни он резюмировал свои взгляды в следующем отрывке из четвертого издания "Оптики" (Optics, 1730):
"При размышлении о всех этих вещах мне кажется вероятным, что Бог вначале дал материи форму твердых, массивных, непроницаемых, подвижных частиц таких размеров и фигур и с такими свойствами и пропорциями в отношении к пространству, которые более всего подходили бы к той цели, для которой он создал их. Эти первоначальные частицы, являясь твердыми, несравнимо тверже, чем всякое пористое тело, составленное из них, настолько тверже, что они никогда не изнашиваются и не разбиваются в куски. Никакая обычная сила не способна разделить то, что создал сам Бог при первом творении. Так как частицы продолжают оставаться целыми, они могут составлять тела той же природы и сложения на века. Если бы они изнашивались или разбивались на куски, то природа вещей, зависящая от них, изменялась бы. Вода и земля, составленные из старых изношенных частиц и их обломков, не имели бы той же природы и строения теперь, как вода и земля, составленные из целых частиц вначале. Поэтому природа их должна быть постоянной, изменения телесных вещей должны проявляться только в различных разделениях и новых сочетаниях частиц; сложные тела могут разбиваться не в середине твердых частиц, но там, где эти частицы расположены рядом и только касаются в немногих точках". (Пер. С.И.Вавилова)
Многое здесь заимствовано из учения Лукреция, но есть одно важное отличие: если Лукреций и его предшественники объясняли сцепление между атомами крючками и другими особенностями внешней формы атомов, то Ньютон, следуя Гассенди, объясняет сцепление силами взаимного притяжения, аналогичными в общих чертах гравитации, но гораздо более интенсивными. Ньютон высказал также гипотезу о корпускулярной природе света. И хотя эти взгляды Ньютона полностью согласуются с современными представлениями, его аргументы по существу были ложными. Тем не менее интуиция, которая привела Ньютона к размышлениям о материи и свете как о взаимосвязанных сущностях и к осознанию того, что если одна из этих сущностей имеет корпускулярную природу, то и другая тоже должна состоять из корпускул, по праву может считаться примером высочайшего взлета научной интуиции. Связав воедино "атомы Демокрита и корпускулы света Ньютона", У.Блейк, отнюдь не бывший поклонником ньютоновской науки, проник в ее логику глубже, чем многие дружественно настроенные оппоненты. Систематическое развитие точных знаний об атомах началось в химии и, можно сказать, с работы Р.Бойля (1627-1691) Скептический химик (Sceptical Chymist, 1661). Бойлю мы обязаны осознанием важной роли химических элементов, "некоторых первообразных и простых, или совершенно не смешанных, тел, которые не состоят ни из каких других тел или друг из друга, но служат ингредиентами, из которых состоит все, что принято называть идеально смешанными телами, и на которые эти тела могут быть разложены в конечном счете". В работе Бойля впервые в истории химии была сформулирована программа - систематическая идентификация элементов и анализ соединений, и через полстолетия Дж.Дальтон (1766-1844) в Новой системе химической философии (A New System of Chemical Philosophy, 1808-1827) изложил общую атомистическую теорию химии, во многом соответствующую современным представлениям. В теории Дальтона считалось, что всякое чистое химическое соединение состоит из одинаковых молекул. (Как мы уже отмечали, эти молекулы до некоторой степени соответствуют атомам древнегреческих философов.) Каждая молекула состоит из атомов определенных химических элементов, но физические свойства соединений, как правило, имеют мало общего со свойствами составляющих их элементов. В работе Дальтона связь между традиционными представлениями об атоме и элементе была сформулирована явно. Постепенное накопление химических знаний и усовершенствование техники эксперимента в 18 и 19 вв. привели к получению и исследованию многочисленных образцов, состоящих из самых различных атомов, известных ныне; но свойства атомов как индивидуальных объектов практически не были известны. Все, что можно было получить, сводилось к грубым оценкам масс и размеров атомов (первые - в интервале 10-24-10-22 г, вторые - порядка 10-8 см; первая хорошая оценка размеров молекул была получена в 1805 Т.Юнгом (1773-1829) на основе молекулярной теории капиллярного притяжения). Почти невообразимую малость этих размеров можно проиллюстрировать следующим примером. Если бы молекулы одного грамма воды можно было каким-нибудь способом пометить, а затем размешать во всей воде, имеющейся на земном шаре, то каждый грамм воды содержал бы несколько десятков меченых молекул. Непостижимо малые величины и сугубо косвенные аргументы были способны убедить лишь тех, кто и без того был убежден в правильности атомно-молекулярной теории, и еще в 1900 такие выдающиеся консерваторы, как физик Э.Мах (1838-1916) и химик В.Оствальд (1853-1932), могли отрицать, что атомистическая гипотеза отвечает некоей реальной истине. Решающий аргумент пришел с совершенно неожиданной стороны, когда в 1905 молодой немецкий физик А.Эйнштейн (1879-1955) показал, что наблюдаемые количественные особенности лабораторного курьеза, известного под названием броуновского движения, могут быть полностью объяснены атомной теорией. Броуновское движение наблюдается, когда взвешенный в воде или воздухе очень тонкий (мелкодисперсный) порошок (например, цветочная пыльца) рассматривается в микроскоп. Частицы порошка "пляшут", совершая хаотические движения, что объясняется столкновениями частиц с молекулами среды. Как показал Эйнштейн, в действительности картина не столь проста; даже микроскопическая частица порошка столь велика, что за секунду успевает претерпеть миллионы столкновений с молекулами среды, и наблюдаемая картина в действительности представляет собой статистические флуктуации усредненной силы, действующей на частицы при столкновениях с молекулами. Тем не менее явление в целом поддается теоретическому анализу. Было показано, что формулы Эйнштейна, выведенные на основе атомистической теории, полностью соответствуют действительности. Особая важность броуновского движения заключается в том, что оно представляет собой один из редких случаев, когда наблюдаемый мир пересекается с атомным миром и характерный атомный процесс становится непосредственно или почти непосредственно доступным органам чувств. Понадобилось много лет, чтобы открыть такое явление, но вскоре после того, как его возможность была осознана, были открыты другие сходные явления и сторонники атомистической теории получили целый ряд убедительных, прямых и согласующихся между собой доказательств правильности атомистической теории. Такие приборы, как сцинтилляционный детектор, счетчик Гейгера - Мюллера, камера Вильсона, разными способами решают проблему наблюдаемости явлений на уровне атомных масштабов.
См. также
ДЕТЕКТОРЫ ЧАСТИЦ. Следует также упомянуть об экспериментальных результатах спектрального анализа света. Было установлено, что если атомы газа бомбардировать быстро движущимися частицами, то они испускают свет определенной длины волны (явление, аналогичное возбуждению гармонических тонов в музыке, но гораздо более сложное). Определенность и неизменность строения спектров атомов говорит о том, что спектры должны отражать какое-то характерное поведение атомов при столкновениях. Детальная информация о спектрах дает возможность экспериментально проверить любую теорию строения атома, которая только может возникнуть.
См. также СПЕКТРОСКОПИЯ.
Проблемы интерпретации. До 1911 не было выдвинуто ни одной логически последовательной, непротиворечивой теории строения атома. Но в 1911 Э.Резерфорд (1871-1937) провел в Кавендишской лаборатории Кембриджского университета эксперименты, которые со всей определенностью показали, что атом в какой-то мере напоминает миниатюрную солнечную систему: его основная масса сосредоточена в положительно заряженном ядре, вокруг которого обращаются электроны, образуя облако очень малой массы. Не прошло и года, как Н.Бор (1885-1962), прибывший тогда из Дании к Резерфорду в качестве стажера, показал, как можно было бы модифицировать ньютоновскую механику, чтобы с приемлемой точностью количественно объяснить спектр водорода, простейшего из атомов.
См. также АТОМА СТРОЕНИЕ. Согласно модели Резерфорда и Бора, атом водорода состоит из тяжелого положительно заряженного ядра (называемого протоном) и примерно в 1840 раз более легкого и отрицательно заряженного электрона, движущегося вокруг ядра по круговой или эллиптической орбите. И протон, и электрон рассматривались как почти не имеющие размеров, как материальные точки, удерживаемые вместе силой притяжения разноименных электрических зарядов. Примененная к такой системе ньютоновская механика утверждает, что при соответствующим образом выбранной начальной энергии атом может иметь любые размеры. Но атомы водорода имеют вполне определенные размеры - порядка 10-8 см в диаметре. Бор ясно понимал, что законы Ньютона не могут объяснить устойчивости такой системы, как атом; действительно, из численных констант теории - масс и зарядов ядра и электрона - невозможно образовать величину, имеющую размерность длины как характерного размера атома. Но такую величину можно построить, если дополнить законы механики постоянной Планка h, которая входит в формулы, описывающие некоторые оптические явления в микроскопическом масштабе. Величины h, e и me имеют следующие значения и размерности:
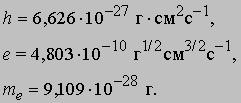
Здесь me - масса электрона, масса протона mp = 1,67*10 -24 г. Из этих констант можно составить единственно возможную комбинацию с размерностью длины h2/mee2. Бор показал, что постоянную Планка h нужно ввести в атомную механику, потребовав, чтобы момент импульса электрона, обращающегося вокруг ядра, был равен целому кратному числа h/2p, и что в таком случае теория могла бы воспроизвести все основные свойства атома водорода. Как показали вычисления, диаметр атома водорода равен: (1/2p2)(h2/mee2) = 1,058*10 -8 см, что согласуется с экспериментом. Кроме того, была выведена формула для наблюдаемых в спектре водорода линий, тоже великолепно согласующаяся со всеми экспериментальными данными. Идеи Бора позволили не только количественно подтвердить механику атома водорода, но и заложить первые ясные основы теории, исходя из фундаментальных физических принципов. При определенных дополнительных допущениях теория Бора позволила объяснить, по крайней мере в общих чертах, почему каждый элемент обладает характерными химическими и физическими свойствами. К 1925 возникла весьма любопытная ситуация. Теория Бора была расширена и углублена, что позволило хотя бы качественно объяснить ряд атомных и радиационных явлений и принять во внимание различные модификации простейшей модели. Кроме того, включение в теорию крайне важного открытия, сделанного в 1925 С.Гаудсмитом и Дж.Уленбеком (они показали, что, обращаясь вокруг ядра, электрон одновременно имеет собственный момент, позволило сделать первые шаги в понимании тех сложных изменений, которые претерпевает спектр атома в сильном магнитном поле. Вместе с тем 13 лет развития, начиная с 1911, не дали даже намека на решение некоторых казавшихся элементарными вопросов. Например, остались загадкой строение и спектр гелия, атом которого отличается от атома водорода лишь тем, что вокруг его ядра движутся два электрона. Кроме того, никто не мог привести более глубокого обоснования постулатов и правил Бора, если не считать констатации того, что они часто дают правильный ответ. Но в течение следующих двух лет после 1925 новые фундаментальные идеи позволили существенно прояснить ситуацию. Эти идеи воплотились в теории, называемой ныне квантовой механикой. Подробнее с ней можно ознакомиться в статье КВАНТОВАЯ МЕХАНИКА ; мы же упомянем здесь лишь о том, что теория относительности показала неадекватность прежних интуитивных представлений о времени и пространстве, а квантовая механика убедительно продемонстрировала необходимость пересмотра распространенных представлений классической механики. Причиной пересмотра стал вывод, доминировавший на протяжении всей истории атомистических теорий: обычные человеческие органы чувств не дают надлежащей основы для понимания явлений, происходящих в микроскопических масштабах. Весь наш опыт познания механических явлений имеет дело с макроскопическими совокупностями атомов, в которых свойства отдельных атомов как таковые не проявляются, а потому не нужно удивляться, что такие понятия, как местоположение, движение и т.д., выведенные из обычного опыта (осмысленные в структуре ньютоновской механики), просто не подходят для обсуждения проблем атомных явлений. Новая теория, развитая независимо Л.де Бройлем (1923) и Э.Шредингером (1926), с одной стороны, и В.Гейзенбергом и М.Борном (1925) - с другой, и расширенная затем П.Дираком, В.Паули и многими другими учеными, по праву стала считаться шедевром теоретической физики нашего века, шедевром, по глубине мысли и широте своих далеко идущих следствий превосходящим даже теорию относительности. Внутренняя непротиворечивость квантовой механики и ее взаимосвязь с другими направлениями теоретической физики были основательно осмыслены Н.Бором. Эти проблемы занимали его до конца жизни. Квантовая механика почти сразу же ответила на все вопросы старой теории Бора: было показано, что постулированные им правила с необходимостью следуют из новой теории; удалось разобраться в строении гелия и более сложных атомов; оказалось, что спин (собственный момент) частиц на удивление просто связан с ее соответствующей релятивистской формулировкой. Кроме того, по сути впервые стало возможным объяснить природу химических сил, т.е. причину, по которой два или более атомов оказываются тесно связанными (образуя молекулу, обладающую свойствами, отличными от свойств любого из образующих ее атомов). Разумеется, это не означает, будто в указанной области не осталось нерешенных вопросов, ибо новые законы не могут объяснить сами себя; их объяснение - дело будущей теории. Теория де Бройля началась с загадки двойственной природы света. Если одни многочисленные эксперименты, проводимые с 1800, убедительно доказали, что свет распространяется в пространстве в виде волн, то другие, выполненные более чем сто лет спустя, столь же убедительно продемонстрировали, что в некоторых ситуациях луч света ведет себя как пучок частиц. Точное соответствие между волновыми и корпускулярными свойствами пучка света было установлено в работах А.Эйнштейна, А.Комптона и других ученых, показавших, что световая волна с частотой n и длиной волны l взаимодействует с веществом так, как если бы свет состоял из частиц (называемых фотонами, или квантами) с энергией

и импульсом
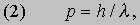
где h - постоянная Планка. Известно, что величины n и l для света связаны между собой соотношением
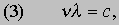
где с - скорость света; из равенства (3) следует [[если (1) разделить на (2) и подставить полученное выражение для nl в (3)]], что

Таким образом, это соотношение между энергией и импульсом, уже известное из теории электромагнитного излучения Максвелла и применимое к пучку света, рассматриваемому как целое, с самого начала включено в теорию отдельных квантов. См. также СВЕТ. Де Бройль усмотрел в двойственной природе света возможность объединить физические представления о свете и веществе. Вещество, в конечном счете, состоит из частиц. Но если свет тоже проявляет себя как частицы, то нельзя ли предположить, что при определенных обстоятельствах и вещество должно вести себя как волны? Отталкиваясь от релятивистского аргумента, который мы не будем здесь воспроизводить, де Бройль решил сохранить соотношения (1) и (2), заменив, однако, для свободных частиц формулу (4) соотношением между кинетической энергией и импульсом для частиц с массой m:
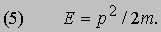
Новое соотношение между частотой и длиной волны имеет вид
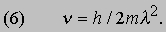
В заключение своей первой статьи де Бройль высказал предположение, что если его гипотеза верна, то соответствующие эксперименты должны обнаружить волновые явления интерференции и дифракции для вещества, аналогичные таким же явлениям для света. Теория де Бройля сразу же указала на физическую подоплеку постулата Бора о моменте импульса. Предположим, что электрон движется вокруг ядра по орбите, на которой укладывается ровно n полных длин волн (рис. 1). Если орбита имеет форму окружности радиусом а, то это означает, что
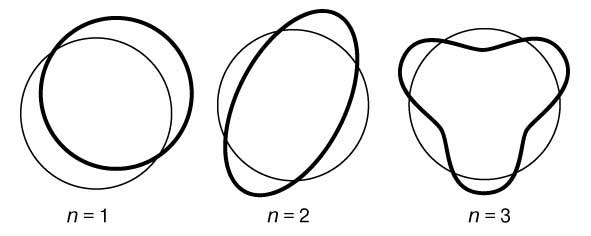
Рис. 1. СТОЯЧИЕ ВОЛНЫ ДЕ БРОЙЛЯ, укладывающиеся вдоль круговой орбиты. Орбита показана тонкой линией, n - число полных волн, укладывающихся вдоль нее.
2pa = nl (n = 1, 2, 3,...) или, с учетом (1), 2pa = nh /p. Преобразуя последнее соотношение, приведем его к виду
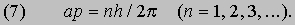
Величина, стоящая в левой части равенства (7), есть не что иное, как орбитальный момент импульса электрона; следовательно, равенство (7) - математическое выражение гипотезы Бора. Экспериментально гипотеза де Бройля была проверена в опытах (1927) Дж. П. Томсона в Англии и К.Дэвиссона и Л.Джермера в США. В этих экспериментах пучок электронов дифрагировал на кристаллическом веществе, что позволило непосредственно измерить длину волны электрона как функцию его импульса и тем самым проверить соотношение p = h /l. В следующие несколько лет были проведены другие эксперименты, показавшие, что волновыми свойствами обладают не только электроны, но и нейтроны и даже целые атомы. В результате блестящая догадка де Бройля получила убедительное, более чем достаточное подтверждение.
Современная точка зрения. У работы де Бройля, несмотря на ее достоинства, был один весьма серьезный недостаток. Традиционные теории света и вещества имели значительный успех потому, что в их основе лежали уравнения движения - особые системы дифференциальных уравнений, с помощью которых по состоянию в данный момент можно определить ее будущее состояние. Простые правила де Бройля не ведут непосредственно к таким уравнениям, равно как и умалчивают о том, какого рода волна обладает свойствами, определяемыми соотношениями (1) и (6). Уравнения движения были выведены почти одновременно Шредингером, работавшим над обобщением теории де Бройля, и Гейзенбергом, который совершенно независимо пытался придать всей квантовой механике более абстрактную форму, чтобы можно было сохранить существенные элементы и опустить все необоснованные экстраполяции нашего повседневного опыта в мир микроскопических явлений. Теории Гейзенберга и Шредингера, внешне очень различные, оказались лишь разными математическими способами выражения одних и тех же законов, дав возможность написать уравнения движения, из которых затем было выведено количественное подтверждение многих известных атомных явлений. Следующим шагом в развитии квантовой механики стало осознание ее существенно статистического характера. Еще в 1924 Эйнштейн высказал предположение о том, что волны де Бройля могут быть в некотором смысле волнами вероятности. Через два года М.Борн, учитель и сотрудник Гейзенберга, нашел точное и общее аналитическое выражение этой мысли. Шредингер ввел греческую букву y (пси) для обозначения "волновой функции" - зависящей от координат и времени переменной, которая в определенных ситуациях носит простой колебательный характер, т.е. представляет собой волну, удовлетворяющую соотношениям (1) и (6). Функция y в общем случае комплекснозначная, и поэтому было трудно понять, каков ее физический смысл. Борн постулировал, что наблюдаемой величиной является не функция y, а величина |y|2, т.е. произведение функции на комплексно-сопряженную величину, а численное значение |y|2 в какой-либо точке пропорционально вероятности найти частицу в этой точке, если мы попытаемся там ее обнаружить. Гипотеза Борна при всей ее простоте и, казалось бы, правильности поставила, однако, больше вопросов, чем помогла решить. Дело в том, что если теория не может дать определенного ответа, а вынуждена в некоторых случаях ограничиться указанием вероятности события, то создается впечатление, что она в каком-то смысле является всего лишь приближением к некоторой более фундаментальной теории, позволяющей делать точные предсказания. Но разве главная задача теоретической физики не заключается в создании такой теории? В 1927 Гейзенберг дал совершенно неожиданный ответ на такую критику квантовой теории. Путем простых рассуждений, основанных на анализе некоторых особых экспериментальных ситуаций, он показал, что точные измерения не всегда возможны даже в принципе и что эта существенная неизбежная неопределенность точнейшим образом отражается в вероятностной структуре квантовой механики. Лучше понять, в чем здесь дело, позволяет конкретный пример, впервые приведенный Бором. Согласно квантовой механике, при одновременном указании положения и импульса частицы существует некоторая неопределенность, выражаемая формулой
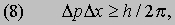
где Dр и Dх - неопределенности в импульсе р частицы и ее координате х, измеряемой в направлении движения. Бор проделал мысленный эксперимент по определению величин х и р с помощью микроскопа. Хорошо известно, что изображение в микроскопе неизбежно в какой-то мере расплывчато из-за дифракции света в линзах, а это приводит к неопределенности Dх в измеренном положении частицы. Однако эту неопределенность можно уменьшить, если использовать свет с меньшей длиной волны, поскольку тогда изображение становится более четким. Но возникает новая трудность: в силу соотношения (2) у кванта света с меньшей длиной волны больше импульс, и даже если измерению подлежит только один квант, сталкивающийся с частицей, то это столкновение вносит существенную неопределенность в импульс, коль скоро положение точно измерено. Вычисляя неопределенности, нетрудно убедиться в том, что они удовлетворяют неравенству (8), и, таким образом, чем точнее выполняется измерение одной величины, тем большая неопределенность вносится в данные о другой. Подкрепленное многими другими аналогичными рассуждениями, подтвержденное опытом и не имеющее ни одного "контрпримера", соотношение неопределенностей Гейзенберга представляет собой закон природы, который существует совершенно независимо от теории, способствовавшей его открытию. Взгляды Гейзенберга и Бора на природу физического мира, открывшуюся в законах квантовой механики, привели к согласованной картине взаимоотношений теории и эксперимента, или, кратко говоря, физического содержания квантовой теории. Квантовая механика представляется теперь вполне корректной теорией, по крайней мере в круге явлений, к которым она должна применяться. Она выражена в весьма совершенной форме и сомнительно, чтобы ее самосогласованность была нарушена. Современная атомная теория революционизировала химические исследования, поскольку дала точную количественную интерпретацию по крайней мере наиболее простых химических фактов. Квантовая механика позволила также многое понять в биологических и даже генетических явлениях. Квантовая механика заменяет атомную модель Резерфорда и Бора другой, на первый взгляд совершенно иной моделью, поскольку в нее существенным образом входит элемент вероятности. И действительно, квантовая механика (хотя она начинается с определенных и не содержащих никаких неоднозначностей уравнений) дает возможность вычислить относительную вероятность нахождения электрона в заданной точке пространства и с за
Модель атома бора.
АТОМ (от греческого atomos - неделимый), наименьшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны, образуя электронные оболочки. Линейные размеры атома ~10-8 см. Ядро атома состоит из положительно заряженных протонов и нейтронов. Заряд ядра определяет атомный номер элемента в периодической системе, для нейтрального атома он равен по величине суммарному заряду электронов. Присоединяя или отдавая электрон, атом становится положительно или отрицательно заряженным ионом. Большинство свойств атомов определяется числом электронов в его внешней электронной оболочке. При возникновении между атомами химических и других связей могут образовываться молекулы твердого тела и жидкости. Внутренняя энергия атома может принимать лишь определенные значения, соответствующие устойчивым состояниям атома, и изменяется только скачкообразно - путем квантовых переходов, при которых атом поглощает или испускает энергию определенными порциями, соответствующими разности энергий начальных и конечных состояний (уровней энергии).
Атом, а, м.
** Мирный атом.
Ядерная энергия, используемая в мирных целях
• Мирный атом станет обеспечивать горячей водой крупные города страны. Лен. пр., 05.02.82. Работает мирный атом. Пр., 26.12.82. Тепло мирного атома (Веч. Лен.). Новиков, 23.
физ. нейтральная частица; положительный заряд ее ядра компенсируется зарядами обращающихся вокруг ядра электронов
Двухкилограммовый атом. Жарг. шк. Шутл.-ирон. Двойка по химии. (Запись 2003 г.).
Мирный атом. Публ. Устар. Патет. Ядерная энергия, используемая в мирных целях. Новиков, 23.
См. малость...
▲ элемент
атом - мельчайшая электронейтральная частица простого вещества; часть молекулы.
атомный.
↓ МАТЕРИАЛЫ, АГРЕГАТ
Заимств. в Петровскую эпоху из греч. яз., в котором atomos «неделимый» - из a «не» и temnō «делю, ломаю». Атом до середины XIX в. ученые считали неделимой частицей вещества.
Атом - с точки зрения современной науки это слово совершенно неправильное. С древних времен и до середины XIX века ученые считали, что атом - мельчайшая неделимая частица вещества. Потом было доказано, что он состоит из ядра и других более мелких элементарных частиц. А название осталось прежним, производным от греческого atomos - неделимый. Но не в имени же суть! От названия свойства атома никак не меняются.
АТОМ -а м. atome m.
1. Мельчайшая неделимая частица вещества. Атомы не могут быть вечны. Кантемир О природе. Ампер полагает, что каждая неделимая частица материи (атом) содержит неотъемлемое от нея количество электричества. ОЗ 1848 56 8 240. Да будет всюду трепетать Атомов торжество! РВ 1903 1 211. Атом - прах, несекомое. Попытка замены заимствования. Копорская Славянизмы 96.
2. перен. Небольшая частица чего-л. (обычно о чувстве, состоянии, процессе). БАС-2. Сверху черная, безграничная бездна, прорезываемая молниями; кругом воздух, наполненный крутящимися атомами пыли, - все это представляло неизобразимый хаос. Салт. Ист. одного города. Каждый атом <племени> живая и деятельная монада. 1877. Е. Марков Горные мечты. // М. 2 138. Анюта задумалась; идеи быстро сменялись в ее уме, но неясные и неопределенные, как атомы хаоса. Е. Ган Напрасный дар. // Сердца 134. Но кто же разберет, что в этих наслоениях принадлежит ему и что другим атомам рабочей массы. Салт. Похороны. // ОЗ 1878 9 1 273. Еврей может верить в Бога, как никто другой, он создан для веры, он ее каталогизировал, расписал каждый атом. А. Найман Славный конец бесславных поколений. // Октябрь 1997 11 44. - Норм. Физики говорят "ато/м", "ато/мный", и даже считают "а/томный" и "ато/мный" различаются не только по сфере употребления, но и по значению. Неделя 1989 44 19. - Лекс. Сл. 18: атом 20-е гг. 18 в; Вейсман 1731; САР 1789: Атом; Брокг.: атомный вес; Уш. 1935: ато/мный; СИС 1937: а/томный.
АТОМ (греч. atomos, от а - отриц. част., и tome, tomos - отдел, отрезок). Бесконечно малая неделимая частица, совокупность которых составляет всякое физическое тело.
- «Мирный» виновник чернобыльской катастрофы.
- Мал, да удал (энергетич.).
- «Мирный» чернобылец.
- Молекулярный кирпичик.
- «Одним матом не расколешь ...».
- Крупица мироздания.
- Что такое изотоп?
- Из чего состоит мир, по мнению древнегреческого учёного Демокрита?
- Хотя он и «неделимый», но его можно разделить на ядро и электронную оболочку.
- Невидимая порция вещества.
- Мельчайшая частица химического элемента.
- Мельчайшая электронейтральная частица.
- При потере или присоединении электронов он превращается в ион.
- Самая энергичная частица.
- Его строение напомнило Эрнесту Резерфорду Солнечную систему.
- Понятие, впервые введённое древнегреческим учёным Левкиппом для обозначения мельчайших единиц бытия.
- Точка с ненулевой мерой.
- В программировании - уникальная для системы величина.
- Наимельчайшая песчинка в крайних пределах своей делимости.
- Имя робота из фильма «Живая сталь».
- В математической логике - простейший случай формулы.
- Имя канадского кинорежиссёра Эгояна.
- Фильм Игоря Гостева «Меченый ...».
- Буква А в АЭС.
АТОМА СТРОЕНИЕ - раздел физики, изучающий внутреннее устройство атомов. Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы. Они имеют массивное ядро, состоящее из протонов и нейтронов, вокруг которого в пустом пространстве движутся электроны. Атомы очень малы - их размеры порядка 10-10-10-9 м, а размеры ядра еще примерно в 100 000 раз меньше (10-15-10-14 м). Поэтому атомы можно "увидеть" только косвенным путем, на изображении с очень большим увеличением (например, с помощью автоэлектронного проектора). Но и в этом случае атомы не удается рассмотреть в деталях. Наши знания об их внутреннем устройстве основаны на огромном количестве экспериментальных данных, которые косвенно, но убедительно свидетельствуют в пользу сказанного выше. Представления о строении атома радикально изменились в 20 в. под влиянием новых теоретических идей и экспериментальных данных. В описании внутреннего строения атомного ядра до сих пор остаются нерешенные вопросы, которые служат предметом интенсивных исследований. В следующих разделах излагается история развития представлений о строении атома как целого; строению ядра посвящена отдельная статья (АТОМНОГО ЯДРА СТРОЕНИЕ), поскольку эти представления развивались в значительной степени независимо. Энергия, необходимая для исследования внешних оболочек атома, относительно невелика, порядка тепловой или химической энергии. По этой причине электроны были экспериментально обнаружены задолго до открытия ядра. Ядро же при его малых размерах очень сильно связано, так что разрушить и исследовать его можно только с помощью сил, в миллионы раз более интенсивных, нежели силы, действующие между атомами. Быстрый прогресс в понимании внутренней структуры ядра начался лишь с появлением ускорителей частиц. Именно это огромное различие размеров и энергии связи позволяет рассматривать структуру атома в целом отдельно от структуры ядра. Чтобы составить представление о размерах атома и незаполненности занимаемого им пространства, рассмотрим атомы, составляющие каплю воды диаметром 1 мм.
Если мысленно увеличить эту каплю до размеров Земли, то атомы водорода и кислорода, входящие в молекулу воды, будут иметь в поперечнике 1-2 м. Основная же часть массы каждого атома сосредоточена в его ядре, поперечник которого при этом составил всего 0,01 мм.
АТОМ КАК ЦЕЛОЕ
Историю возникновения самых общих представлений об атоме обычно ведут со времен греческого философа Демокрита (ок. 460 - ок. 370 до н. э.), много размышлявшего о наименьших частицах, на которые можно было бы поделить любое вещество. Группу греческих философов, придерживавшихся того взгляда, что существуют подобные крошечные неделимые частицы, называли атомистами. Греческий философ Эпикур (ок. 342-270 до н.э.) принял атомную теорию, и в первом веке до н.э. один из его последователей, римский поэт и философ Лукреций Кар, изложил учение Эпикура в поэме "О природе вещей", благодаря которой оно и сохранилось для следующих поколений. Аристотель (384-322 до н.э.), один из крупнейших ученых древности, атомистическую теорию не принимал, и его взгляды на философию и науку преобладали впоследствии в средневековом мышлении. Атомистической теории как бы не существовало до самого конца эпохи Возрождения, когда на смену чисто умозрительным философским рассуждениям пришел эксперимент. В эпоху Возрождения начались систематические исследования в областях, именуемых ныне химией и физикой, принесшие с собой новые догадки о природе "неделимых частиц". Р.Бойль (1627-1691) и И.Ньютон (1643-1727) исходили в своих рассуждениях из представления о существовании неделимых частиц вещества. Однако ни Бойлю, ни Ньютону не потребовалось детальной атомистической теории для объяснения интересовавших их явлений, и результаты проведенных ими экспериментов не сказали ничего нового о свойствах "атомов".
Законы Дальтона. Первым действительно научным обоснованием атомистической теории, убедительно продемонстрировавшим рациональность и простоту гипотезы о том, что всякий химический элемент состоит из мельчайших частиц, явилась работа английского школьного учителя математики Дж.Дальтона (1766-1844), статья которого, посвященная этой проблеме, появилась в 1803. Дальтон изучал свойства газов, в частности отношения объемов газов, вступавших в реакцию образования химического соединения, например, при образовании воды из водорода и кислорода. Он установил, что отношения прореагировавших количеств водорода и кислорода всегда представляют собой отношения небольших целых чисел. Так, при образовании воды (H2O) в реакцию с 16 г кислорода вступают 2,016 г газообразного водорода, а при образовании пероксида водорода (H2O2) с 2,016 г водорода соединяются 32 г газообразного кислорода. Массы кислорода, реагирующие с одной и той же массой водорода при образовании этих двух соединений, соотносятся между собой как небольшие числа: 16:32 = 1:2. На основе подобных результатов Дальтон сформулировал свой "закон кратных отношений". Согласно этому закону, если два элемента соединяются в разных пропорциях, образуя разные соединения, то массы одного из элементов, соединяющиеся с одним и тем же количеством второго элемента, соотносятся как небольшие целые числа. По второму закону Дальтона, "закону постоянных отношений", в любом химическом соединении соотношение масс входящих в него элементов всегда одно и то же. Большое количество экспериментальных данных, относящихся не только к газам, но также и к жидкостям и твердым соединениям, собрал Й.Берцелиус (1779-1848), который провел точные измерения реагирующих масс элементов для многих соединений. Его данные подтвердили сформулированные Дальтоном законы и убедительно продемонстрировали наличие у каждого элемента наименьшей единицы массы. Атомные постулаты Дальтона имели то преимущество перед абстрактными рассуждениями древнегреческих атомистов, что его законы позволяли объяснить и увязать между собой результаты реальных опытов, а также предсказать результаты новых экспериментов. Он постулировал, что 1) все атомы одного и того же элемента тождественны во всех отношениях, в частности, одинаковы их массы; 2) атомы разных элементов имеют неодинаковые свойства, в частности, неодинаковы их массы; 3) в соединение, в отличие от элемента, входит определенное целое число атомов каждого из составляющих его элементов; 4) в химических реакциях может происходить перераспределение атомов, но ни один атом не разрушается и не создается вновь. (В действительности, как выяснилось в начале 20 в., эти постулаты не вполне строго выполняются, т.к. атомы одного и того же элемента могут иметь разные массы, например водород имеет три такие разновидности, называемые изотопами; кроме того, атомы могут претерпевать радиоактивные превращения и даже полностью разрушиться, но не в химических реакциях, рассматривавшихся Дальтоном.) Основанная на этих четырех постулатах атомная теория Дальтона давала самое простое объяснение законов постоянных и кратных отношений. Хотя законы Дальтона лежат в основе всей химии, ими не определяются фактические размеры и массы атомов. Они ничего не говорят о числе атомов, содержащихся в определенной массе элемента или соединения. Молекулы простых веществ слишком малы, чтобы их можно было взвесить по отдельности, поэтому для определения масс атомов и молекул приходится прибегать к косвенным методам.
Число Авогадро. В 1811 А. Авогадро (1776-1856) выдвинул гипотезу, которая значительно упрощала анализ того, как из элементов образуются соединения, и устанавливала различие между атомами и молекулами. Его мысль состояла в том, что равные объемы газов, находящиеся при одинаковых температуре и давлении, содержат одно и то же число молекул. В принципе намек на это можно найти в более ранней работе Ж.Гей-Люссака (1778-1850), который установил, что отношение объемов газообразных элементов, вступающих в химическую реакцию, выражается целыми числами, хотя и отличными от отношений масс, полученных Дальтоном. Например, 2 л газообразного водорода (молекулы H2), соединяясь с 1 л газообразного кислорода (молекулы O2), образуют 1 л паров воды (молекулы H2O). Истинное число молекул в данном объеме газа чрезвычайно велико, и до 1865 его не удавалось определить с приемлемой точностью. Однако уже во времена Авогадро проводились грубые оценки на основе кинетической теории газов. Очень удобной единицей измерения количества вещества является моль, т.е. количество вещества, в котором столько же молекул, сколько атомов в 0,012 кг самого распространенного изотопа углерода 12С. Один моль идеального газа при нормальных условиях (н.у.), т.е. стандартных температуре и давлении, занимает объем 22,4 л. Число Авогадро - это полное число молекул в одном моле вещества или в 22,4 л газа при н.у. Другие методы, такие, как рентгенография, дают для числа Авогадро N0 более точные значения, нежели полученные на основе кинетической теории. Значение, принятое в настоящее время, таково: 6,0221367Ч1023 атомов (молекул) в одном моле. Следовательно, в 1 л воздуха содержится примерно 3Ч1022 молекул кислорода, азота и других газов. Важная роль числа Авогадро для физики атома связана с тем, что оно позволяет определить массу и приблизительные размеры атома или молекулы. Поскольку масса 22,4 л газообразного H2 составляет 2,016Ч10-3 кг, масса одного атома водорода равна 1,67Ч10-27 кг. Если считать, что в твердом теле атомы расположены вплотную друг к другу, то число Авогадро позволит приближенно оценить радиус r, скажем, атомов алюминия. Для алюминия 1 моль равен 0,027 кг, а плотность - 2,7Ч103 кг/м3. При этом имеем
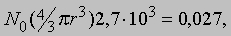
откуда r " 1,6*10-10 м. Так первые оценки числа Авогадро дали представление об атомных размерах.
Открытие электрона. Экспериментальные данные, связанные с образованием химических соединений, подтверждали существование "атомных" частиц и позволили судить о малых размерах и массе отдельных атомов. Однако реальная структура атомов, в том числе и существование еще меньших частиц, составляющих атомы, оставалась неясной до открытия Дж.Дж.Томсоном электрона в 1897. До той поры атом считался неделимым и различие в химических свойствах различных элементов не имело своего объяснения. Еще до открытия Томсона был выполнен ряд интересных экспериментов, в которых другие исследователи изучали электрический ток в стеклянных трубках, наполненных газом при низких давлениях. Такие трубки, названные трубками Гейсслера по имени немецкого стеклодува Г.Гейсслера (1815-1879), который первым начал изготовлять их, испускали яркое свечение, будучи подключены к высоковольтной обмотке индукционной катушки. Этими электрическими разрядами заинтересовался У.Крукс (1832-1919), который установил, что характер разряда в трубке меняется в зависимости от давления, и разряд полностью исчезает при высоком вакууме. Более поздние исследования Ж.Перрена (1870-1942) показали, что вызывающие свечение "катодные лучи" представляют собой отрицательно заряженные частицы, которые движутся прямолинейно, но могут отклоняться магнитным полем. Однако заряд и масса частиц оставались неизвестны и было неясно, одинаковы ли все отрицательные частицы. Огромной заслугой Томсона явилось доказательство того, что все частицы, образующие катодные лучи, тождественны друг другу и входят в состав вещества. С помощью разрядной трубки особого типа, изображенной на рис. 1, Томсон измерил скорость и отношение заряда к массе частиц катодных лучей, позднее названных электронами. Электроны вылетали из катода под действием высоковольтного разряда в трубке. Через диафрагмы D и E проходили только те из них, что летели вдоль оси трубки.
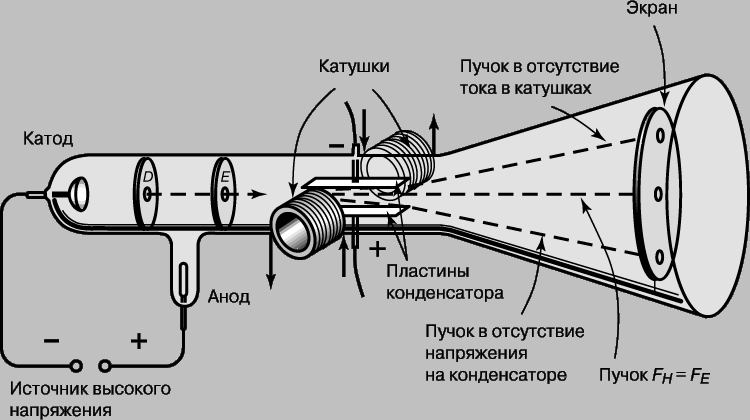
Рис. 1. ОТНОШЕНИЕ ЗАРЯДА К МАССЕ. Трубка, использованная английским физиком Дж.Томсоном для определения отношения заряда к массе для катодных лучей. Эти опыты привели к открытию электрона.
В нормальном режиме эти электроны попадали в центр люминесцентного экрана. (Трубка Томсона была первой "электронно-лучевой трубкой" с экраном, предшественницей телевизионного кинескопа.) В трубке находилась также пара пластин электрического конденсатора, которые, если на них подавалось напряжение, могли отклонять электроны. Электрическая сила FE, действующая на заряд e со стороны электрического поля E, дается выражением FE = eE. Кроме того, в той же области трубки с помощью пары катушек с током могло создаваться магнитное поле, способное отклонять электроны в противоположном направлении. Сила FH, действующая со стороны магнитного поля H, пропорциональна напряженности поля, скорости частицы v и ее заряду e: FH = Hev. Томсон отрегулировал электрическое и магнитное поля так, чтобы полное отклонение электронов было равно нулю, т.е. электронный пучок вернулся в первоначальное положение. Поскольку в этом случае обе силы FE и FH равны, скорость электронов дается выражением
v = E/H. Томсон установил, что эта скорость зависит от напряжения на трубке V и что кинетическая энергия электронов mv2/2 прямо пропорциональна этому напряжению, т.е. mv2/2 = eV. (Отсюда термин "электрон-вольт" для энергии, приобретаемой частицей с зарядом, равным заряду электрона при ускорении разностью потенциалов 1 В.) Комбинируя это уравнение с выражением для скорости электрона, он нашел отношение заряда к массе:
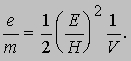
Эти опыты позволили определить отношение e/m для электрона и дали приближенное значение заряда e. Точно величина e была измерена Р.Милликеном, который в своих опытах добивался, чтобы заряженные капельки масла висели в воздухе между пластинами конденсатора. В настоящее время характеристики электрона известны с большой точностью:
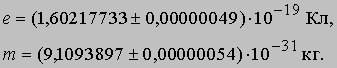
Таким образом, масса электрона значительно меньше массы атома водорода:

Эксперименты Томсона показали, что электроны в электрических разрядах могут возникать из любого вещества. Поскольку все электроны одинаковы, элементы должны различаться лишь числом электронов. Кроме того, малая величина массы электронов указывала на то, что масса атома сосредоточена не в них. Масс-спектрограф Томсона. Вскоре и оставшуюся часть атома с положительным зарядом удалось наблюдать с помощью той же, хотя и модифицированной, разрядной трубки, позволившей открыть электрон. Уже первые эксперименты с разрядными трубками показали, что если катод с отверстием помещается посередине трубки, то через "канал" в катоде проходят положительно заряженные частицы, вызывая свечение люминесцентного экрана, расположенного в противоположном от анода конце трубки. Эти положительные "каналовые лучи" тоже отклонялись магнитным полем, но в направлении, противоположном электронам. Томсон решил измерить массу и заряд этих новых лучей, также используя для отклонения частиц электрическое и магнитное поля. Его прибор для изучения положительных лучей, "масс-спектрограф", схематически изображен на рис. 2. Он отличается от прибора, представленного на рис. 1, тем, что электрическое и магнитное поля отклоняют частицы под прямым углом друг к другу, а потому "нулевое" отклонение получить не удается. Положительно заряженные атомы на пути между анодом и катодом могут потерять один или несколько электронов, и по этой причине могут ускоряться до различных энергий. Атомы одного типа с одинаковыми зарядом и массой, но с некоторым разбросом конечных скоростей, вычертят на люминесцентном экране или фотопластинке кривую линию (отрезок параболы). При наличии атомов с различной массой более тяжелые атомы (с тем же зарядом) будут отклоняться от центральной оси слабее, чем более легкие. На рис. 3 приведена фотография парабол, полученных на масс-спектрографе Томсона. Самая узкая парабола соответствует самому тяжелому однократно ионизованному атому (атому ртути), у которого выбит один электрон. Две самые широкие параболы соответствуют водороду, одна - атомарному H+, а другая - молекулярному H2+, причем оба однократно ионизованы. В некоторых случаях теряются два, три и даже четыре заряда, однако атомарный водород никогда не наблюдался ионизованным более чем однократно. Данное обстоятельство было первым указанием на то, что в атоме водорода только один электрон, т.е. это самый простой из атомов.
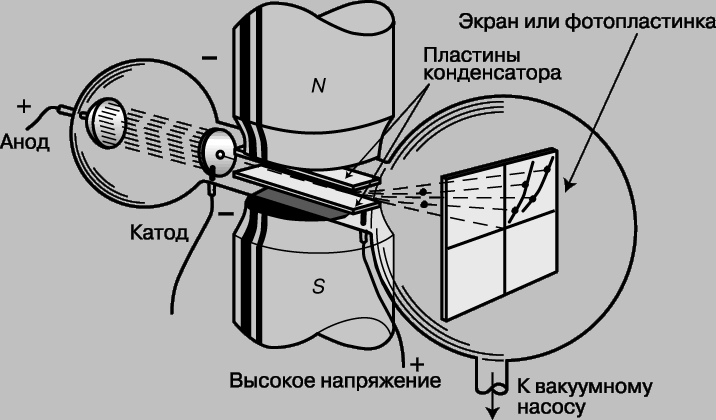
Рис. 2. МАСС-СПЕКТРОГРАФ, использовавшийся Томсоном для определения относительных значений массы различных атомов по отклонению положительных лучей в магнитном и электрическом полях.
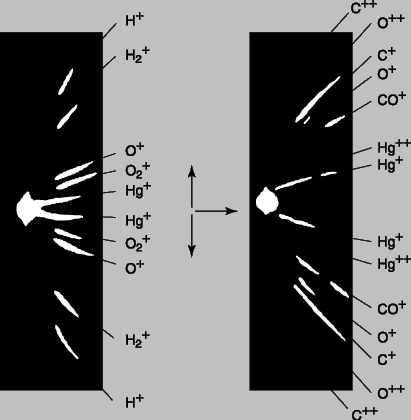
Рис. 3. МАСС-СПЕКТРЫ, фотоснимки с распределением ионизованных атомов пяти веществ, полученные в масс-спектрографе. Чем больше масса атомов, тем меньше отклонение.
Другие доказательства сложной структуры атома. В то самое время, когда Томсон и другие исследователи экспериментировали с катодными лучами, открытие рентгеновского излучения и радиоактивности принесло дополнительные доказательства сложной структуры атома. В 1895 В.Рентген (1845-1923) случайно обнаружил таинственное излучение ("Х-лучи"), проникавшее сквозь черную бумагу, которой он оборачивал трубку Крукса при исследовании зеленой люминесцирующей области электрического разряда. Х-лучи вызывали свечение удаленного экрана, покрытого кристаллическим платиноцианидом бария. Рентген выяснил, что различные вещества разной толщины, введенные между экраном и трубкой, ослабляют свечение, но не гасят его полностью. Это свидетельствовало о чрезвычайно высокой проникающей способности Х-лучей. Рентген установил также, что эти лучи распространяются прямолинейно и не отклоняются под действием электрических и магнитных полей. Возникновение такого невидимого проникающего излучения при бомбардировке электронами различных материалов было чем-то совершенно новым. Было известно, что видимый свет от трубок Гейсслера состоит из отдельных "спектральных линий" с определенными длинами волн и, значит, связан с "колебаниями" атомов, имеющими дискретные частоты. Существенная особенность нового излучения, отличавшая его от оптических спектров, помимо высокой проникающей способности, состояла в том, что оптические спектры элементов с последовательно возраставшим числом электронов полностью отличались друг от друга, тогда как спектры X-лучей очень незначительно изменялись от элемента к элементу. Еще одним открытием, имеющим отношение к строению атома, было то, что атомы некоторых элементов могут спонтанно испускать излучение. Это явление было обнаружено в 1896 А.Беккерелем (1852-1908). Беккерель открыл радиоактивность, используя соли урана в процессе изучения люминесценции солей под действием света и ее связи с люминесценцией стекла в рентгеновской трубке. В одном из опытов наблюдалось почернение фотопластинки, завернутой в черную бумагу и находившейся около урановой соли в полной темноте. Это случайное открытие стимулировало интенсивные поиски других примеров естественной радиоактивности и постановку опытов по определению природы испускаемого излучения. В 1898 П.Кюри (1859-1906) и М.Кюри (1867-1934) обнаружили еще два радиоактивных элемента - полоний и радий. Э.Резерфорд (1871-1937), исследовав проникающую способность излучения урана, показал, что имеются два типа излучений: очень "мягкое" излучение, которое легко поглощается веществом и которое Резерфорд назвал альфа-лучами, и более проникающее излучение, которое он назвал бета-лучами. Бета-лучи оказались тождественными обычным электронам, или "катодным лучам", возникающим в разрядных трубках. Альфа-лучи, как выяснилось, имеют такие же заряд и массу, как и атомы гелия, лишенные двух своих электронов. Третий тип излучения, названный гамма-лучами, оказался сходен с X-лучами, но обладал еще большей проникающей способностью. Все эти открытия ясно показали, что атом не является "неделимым". Он не только состоит из более мелких частей (электронов и более тяжелых положительных частиц), но эти и другие субчастицы, по-видимому, самопроизвольно испускаются при радиоактивном распаде тяжелых элементов. Кроме того, атомы не только испускают излучение в видимой области с дискретными частотами, но и могут так возбуждаться, что начинают испускать более "жесткое" электромагнитное излучение, а именно X-лучи.
Модель атома Томсона. Дж. Томсон, внесший огромный вклад в экспериментальное изучение строения атома, стремился найти модель, которая позволила бы объяснить все его известные свойства. Поскольку преобладающая доля массы атома сосредоточена в его положительно заряженной части, он принял, что атом представляет собой сферическое распределение положительного заряда радиусом примерно 10-10 м, а на его поверхности находятся электроны, удерживаемые упругими силами, позволяющими им колебаться (рис. 4). Суммарный отрицательный заряд электронов в точности компенсирует положительный заряд, так что атом электрически нейтрален. Электроны находятся на сфере, но могут совершать простые гармонические колебания относительно положения равновесия. Такие колебания могут происходить лишь с определенными частотами, которым соответствуют узкие спектральные линии, наблюдающиеся в газоразрядных трубках. Электроны можно довольно легко выбить с их позиций, в результате чего возникают положительно заряженные "ионы", из которых состоят "каналовые лучи" в опытах с масс-спектрографом. X-лучи соответствуют очень высоким обертонам основных колебаний электронов. Альфа-частицы, возникающие при радиоактивных превращениях, - это часть положительной сферы, выбитая из нее в результате какого-то энергичного разрывания атома.

Рис. 4. АТОМ, согласно модели Томсона. Электроны удерживаются внутри положительно заряженной сферы упругими силами. Те из них, которые находятся на поверхности, могут довольно легко "выбиваться", оставляя ионизованный атом.
Однако эта модель вызывала ряд возражений. Одно из них было связано с тем, что, как обнаружили спектроскописты, измерявшие линии испускания, частоты этих линий не являются простыми кратными низшей частоты, как должно быть в случае периодических колебаний заряда. Вместо этого они сближаются с увеличением частоты, как если бы стремились к пределу. Уже в 1885 И.Бальмеру (1825-1898) удалось найти простую эмпирическую формулу, связывающую частоты линий видимой части спектра водорода:
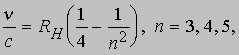
где n - частота, c - скорость света (3*10 8 м/с), n - целое число и RH - некий постоянный множитель. Согласно этой формуле, в данной серии спектральных линий водорода должны отсутствовать линии с длиной волны l меньше 364,56 нм (или с более высокими частотами), отвечающей n = Ґ. Так оно и оказалось, и это стало серьезным возражением против модели атома Томсона, хотя и делались попытки объяснить расхождение различием упругих возвращающих сил для разных электронов. Исходя из модели атома Томсона, было также крайне трудно объяснить испускание атомами рентгеновского или гамма-излучения. Затруднения в модели атома Томсона вызвало и отношение e/m заряда к массе для атомов, потерявших свои электроны ("каналовых лучей"). Самый простой атом - атом водорода с одним электроном и сравнительно массивной сферой, несущей один положительный заряд. Значительно раньше, в 1815, У.Праут высказал предположение, что все более тяжелые атомы состоят из атомов водорода, и было бы понятно, если бы масса атома возрастала пропорционально числу электронов. Однако измерения показали, что отношение заряда к массе для разных элементов неодинаково. Например, масса атома неона примерно в 20 раз больше массы атома водорода, тогда как заряд составляет лишь 10 единиц положительного заряда (у атома неона 10 электронов). Дело обстояло так, как если бы положительный заряд имел переменную массу или же электронов было действительно 20, но 10 из них находились внутри сферы.
Опыты Резерфорда по рассеянию. Затем возникла еще одна трудность. В 1903 Ф.Ленард (1862-1947) ставил опыты с прохождением пучка быстрых электронов сквозь тонкие металлические фольги. В модели атома Томсона почти все пространство заполнено веществом (положительно заряженной частью атома), а потому можно было думать, что сквозь фольгу сможет проникать лишь очень мало электронов. Ленард же обнаружил, что сквозь фольгу проходят почти все электроны. Хотя в эксперименте имелись трудности, связанные с малой массой бомбардирующих частиц, Ленард выдвинул предположение, что масса атома сосредоточена в "динамиде" - его центральной области, значительно меньшей, чем предполагалось. Решающий эксперимент, совершенно изменивший представления о пространственной структуре атома, был проведен Э.Резерфордом и его сотрудниками Х.Гейгером (1882-1945) и Э.Марсденом (1889-1970). Вместо электронов они использовали альфа-частицы, т.к. благодаря своей большей массе (в 7350 раз больше массы электрона) эти частицы не претерпевают заметного отклонения при столкновении с атомными электронами, что позволяет регистрировать только столкновения с положительной частью атома. В качестве источника альфа-частиц был взят радий, а частицы, претерпевавшие рассеяние в тонкой металлической фольге, например золотой, регистрировались по "сцинтилляционным" вспышкам на экране из сульфида цинка, находящемся в затемненной комнате. Схема опыта представлена на рис. 5.
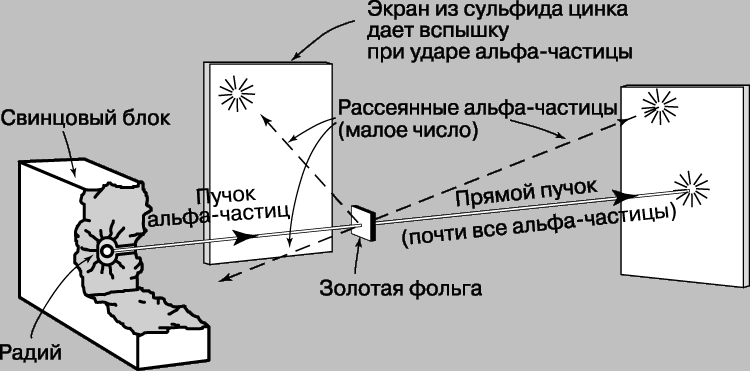
Рис. 5. РАССЕЯНИЕ АЛЬФА-ЧАСТИЦ. Используя прибор такого типа с альфа-частицами, испускаемыми радием, Э.Резерфорд установил, что, хотя основная часть частиц проходит сквозь золотую фольгу, на большие углы рассеивается больше частиц, чем должно быть в соответствии с томсоновской моделью атома. Это было истолковано как указание на то, что в центре атома находится малое ядро.
Согласно модели Томсона, практически все альфа-частицы должны оказываться в пределах очень малого угла относительно своего первоначального направления, поскольку большую часть времени они должны были бы проходить в области почти равномерно распределенного положительного заряда. Хотя результаты Резерфорда согласовались с ожидаемым распределением в области малых отклонений, было зарегистрировано очень много отклонений на углы, гораздо большие, чем предсказывала модель атома Томсона. Столь большие отклонения можно было объяснить лишь тем, что положительная "сердцевина" атома значительно меньше размеров его электронной структуры и, следовательно, альфа-частицы могут очень близко подходить к этой малой положительной сердцевине, встречая при этом очень большие кулоновские силы. Опыты Резерфорда убедительно показали, что весь атом, кроме очень малой массивной сердцевины, или "ядра", как и предполагал Ленард, почти полностью пуст. Исходя из полученных им экспериментальных данных, Резерфорд заключил, что диаметр ядра атома золота составляет не более 6*10-15 м - значение, довольно близкое к современному. Резерфорду удалось, упрощенно рассматривая ядро как точечный центр рассеяния, на основе только электростатики и механики Ньютона вывести формулу для углового распределения рассеянных частиц. Между альфа-частицей с массой M и зарядом 2e, где e - заряд электрона, и ядром с зарядом Ze, где Z - атомный номер элемента, из которого состоит рассеивающее вещество, действует сила электростатического отталкивания 2Ze2/r2, где r - расстояние между зарядами. Угол j, на который происходит рассеяние, зависит от параметра столкновения p, т.е. минимального расстояния, на котором частица прошла бы мимо ядра, если бы не отклонилась. Как видно из рис. 6, наибольшему углу отклонения отвечает наименьший параметр столкновения. Доля альфа-частиц, отклоняющихся на угол j и более, дается выражением
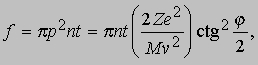
где n - число атомов в 1 см3, t - толщина фольги, M и v - масса и скорость альфа-частицы и Z - заряд ядра. Этот закон рассеяния Резерфорда чаще записывают в виде доли частиц df, которая рассеивается в телесный угол dw в интервале углов от j до j + dj:
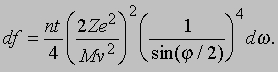
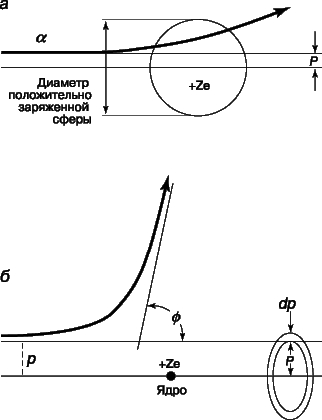
Рис. 6. РАССЕЯНИЕ АЛЬФА-ЧАСТИЦ. а - томсоновская модель атома; б - резерфордовская модель атома с малым плотным ядром.
Эти выражения получили количественное подтверждение для широкого диапазона углов и разных рассеивающих материалов и позволили измерить заряд ядра. Резерфордовская, или ядерная, модель атома, вытеснив томсоновскую модель, явилась важным этапом на пути создания квантовой механики. Детальные эксперименты, выполненные Гейгером и Марсденом в 1913, не оставили и тени сомнения в том, что картина атома с малым массивным ядром в центре электронной структуры значительно больших размеров верна не только качественно, но и количественно. Некоторые детали, перенесенные из томсоновской модели, такие, как существование в ядре электронов, позднее также были отброшены.
Квантовая теория Бора. Н. Бор (1885-1962) работал в 1912-1913 у Резерфорда, когда тот проводил опыты по рассеянию, и вернулся в 1913 в Копенгаген с множеством новых идей. Требовал своего объяснения ряд явлений, помимо только что открытых в "ядерных" экспериментах по рассеянию. Теперь, когда была отвергнута томсоновская модель атома, узкие, дискретные спектральные линии в излучении разрядных трубок и эмпирические закономерности в их частотах казались еще менее понятными. Был и другой атомный эффект, открытый в 1887 Г.Герцем (1857-1894), а именно фотоэффект. Суть его в том, что свет, падающий на свежеочищенную поверхность металла, выбивает из нее электроны, если частота света достаточно высока. Для каждого металла имеется своя пороговая частота. Опыты показали, что тормозящее электростатическое поле, уменьшающее до нуля ток фотоэлектронов, не зависит от интенсивности света, но зависит от его длины волны. Электромагнитная теория, согласно которой свет представляет собой электромагнитные волны, оказалась не в состоянии объяснить это, поскольку по этой теории для испускания электрона с любой скоростью атому нужно только достаточно долго поглощать энергию. В 1905 А.Эйнштейн (1879-1955) предложил объяснение фотоэффекта, которое полностью согласовалось с экспериментальными данными, но требовало коренного пересмотра существовавшей концепции света как волнового процесса. Эйнштейн предположил, что свет переносит энергию порциями, которые называются фотонами или квантами света, причем их энергия дается выражением E = hn, где n - частота света, а h - "постоянная Планка", равная 6,626Ч10-34 ДжЧс. Попадая на поверхность металла, фотон передает всю свою энергию электрону. Поскольку электрон связан с поверхностью электростатическими силами, ему для вылета необходима энергия W ("работа выхода"), а остальная часть полученной электроном энергии превращается в его кинетическую энергию, т.е. hn = W + 1/2mv2. Гипотеза Эйнштейна объясняла, почему кинетическая энергия фотоэлектронов зависит от частоты света, а число испускаемых электронов - от его интенсивности. Как часто происходит с научными открытиями, оказалось, что гипотеза "квантов" Эйнштейна имеет в своей основе более раннюю теорию. М.Планк (1858-1947) первым привлек идею квантования для объяснения наблюдаемого спектрального состава излучения нагретых тел. Ему удалось объяснить спектр, предположив, что гармонические осцилляторы поглощают и излучают лишь дискретные порции энергии hn. Бор блестяще применил квантовую гипотезу к описанию орбит электронов в атомах и их излучения. Он отбросил идею о том, что электроны ведут себя подобно осцилляторам, а вместо этого представил динамику атома в виде движения электронов по орбитам вокруг ядра, наподобие движения планет по орбитам вокруг Солнца. Сила электростатического притяжения электрона ядром является центростремительной силой, заставляющей электрон двигаться по круговой орбите радиуса r со скоростью v. В общем случае ядра с зарядом Ze имеем
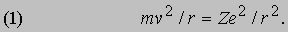
В таком силовом поле (когда сила обратно пропорциональна расстоянию до центра притяжения) кинетическая энергия движения всегда равна - 1/2 потенциальной энергии:
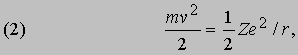
а полная энергия, т.е. сумма кинетической и потенциальной энергий, равна:
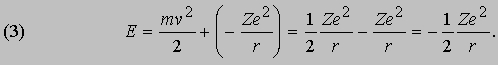
Эти соотношения следуют из обычных законов механики и электростатики. Бор, в дополнение к ним, сформулировал следующие постулаты, составляющие основу квантовой теории атома. I. Разрешены только такие круговые орбиты, для которых момент импульса равен целому числу в единицах постоянной Планка, деленной на 2p. (Момент импульса тела l, движущегося по круговой орбите, равен произведению его массы m на скорость v и радиус орбиты r.) Таким образом,
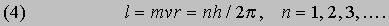
II. Хотя, согласно электромагнитной теории, любая заряженная частица, движущаяся с ускорением, должна испускать излучение, электроны не испускают излучения, двигаясь по своим орбитам внутри атома. Излучение возникает только при переходе электрона с одной квантованной орбиты на другую. III. Частота этого излучения определяется изменением полной энергии, т.е. разностью энергий атома в начальном и конечном состояниях: hn = E2 - E1. Эти условия квантования энергии приводят к дискретным орбитам электронов. Решая уравнение (2) относительно скорости и подставляя в (4), получаем
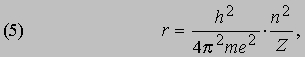
или, если ввести "боровский радиус" a0 = h2/4p2me2 " 5,29*10-11 м,
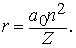
I прил.
1. соотн. с сущ. атом I, связанный с ним
2. Состоящий из отдельных атомов [атом I], не соединенных в молекулы.
II прил.
Состоящий из отдельных частиц: прерывистый, дробный, разрозненный, не целостный.
АТОМА́РНЫЙ -ая, -ое.
1. Спец. Состоящий из отдельных атомов, не соединённых в молекулы; существующий в таком виде. А. водород, кислород.
2. Книжн. Дробный, разрозненный, нецелостный. А-ая картина мира. А-ые представления о жизни Вселенной.
-ая, -ое. спец.
прил. к атом.
Есть дозиметры, меряющие дозу в веществе той же плотности, что и живая ткань, даже имеющем тот же атомарный состав. Лучник, Невидимый современник.
||
Существующий в виде отдельных, рассеянных атомов.
Атомарный водород и кислород в атмосфере Марса.
атома́рный, атома́рная, атома́рное, атома́рные, атома́рного, атома́рной, атома́рных, атома́рному, атома́рным, атома́рную, атома́рною, атома́рными, атома́рном, атома́рен, атома́рна, атома́рно, атома́рны, атома́рнее, поатома́рнее, атома́рней, поатома́рней
атомарный
- ая, ое (нем. atomar < греч. atomos неделимый).
физ.
1. Относящийся к структуре атома.
2. Существующий в виде отдельных, рассеянных атомов. А. водород.
Атомград, а, м.
О городе, в котором большинство жителей связано с работами в области атомной энергетики.
• Летом 1955 года здесь появились строители. Их встретили дремучий лес, богатая рыбой река Черемшан. Такой щедрой и красивой сохранили природу жители атомграда и теперь (Огонек). СМ-77, 24.
атомиза́тор, атомиза́торы, атомиза́тора, атомиза́торов, атомиза́тору, атомиза́торам, атомиза́тором, атомиза́торами, атомиза́торе, атомиза́торах
атомизатор
[от гр.] - прибор для тонкого распыления жидкости; применяется для дезинфекции, покрытия поверхностей красками и лаками и т.д.
АТОМИЗАТОР а, м. atomiser. Прибор для тонкого распыления жидкости; применяется для дезинфекции, покрытия поверхностей красками, лаками и т. п. СИС 1954. - Лекс. СИС 1964: атомиза/тор.