прил.
1. соотн. с сущ. иридий, связанный с ним
2. Свойственный иридию, характерный для него.
3. Сделанный из иридия.
прил.
1. соотн. с сущ. иридий, связанный с ним
2. Свойственный иридию, характерный для него.
3. Сделанный из иридия.
ири́диевый, ири́диевая, ири́диевое, ири́диевые, ири́диевого, ири́диевой, ири́диевых, ири́диевому, ири́диевым, ири́диевую, ири́диевою, ири́диевыми, ири́диевом, ири́диев, ири́диева, ири́диево, ири́диевы, ири́диевее, поири́диевее, ири́диевей, поири́диевей
м.
Химический элемент, тяжёлый тугоплавкий металл серебристо-белого цвета, применяемый для нанесения защитных покрытий.
ИРИ́ДИЙ, иридия, мн. нет, муж. (иностр.) (хим.). Редко встречающийся химический элемент - тяжелый металл, близкий к платине.
ИРИДИЙ, ирид муж. весьма твердый, беловатый металл, находимый обычно в сплаве с осмием и вместе с платиной. Иридиевый, иридовый, к металлу иридию относящийся. Иридистый, содержащий примесь иридия.
ИРИ́ДИЙ -я; м. [от греч. iris (iridos) - радуга] Химический элемент (Ir), тяжёлый тугоплавкий редкоземельный металл серовато-белого цвета (используется для нанесения защитных покрытий). Добыча иридия.
◁ Ири́диевый, -ая, -ое. И. сплав. И. кончик пера.
* * *
ири́дий (лат. Iridium), химический элемент VIII группы периодической системы, относится к платиновым металлам. Плотность 22,65 г/см3, tпл 2447°C. Применяют для нанесения защитных покрытий. Компонент сплавов с Pt, Os и др. (химическая аппаратура, эталоны мер, детали измерительных приборов, напайка «вечных перьев»). Название от греческого íris - радуга.
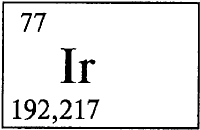
* * *
ИРИДИЙ - ИРИ́ДИЙ (лат. Iridium, от греческого «ирис» - радуга), Ir (читается «иридий»), химический элемент с атомным номером 77, атомная масса 192,22. Состоит из смеси двух стабильных изотопов 193Ir (62,7% по массе) и 191Ir (37,3%). Расположен в VIIIB группе, в 6 периоде периодической системы элементов. Входит в триаду осмий (см. ОСМИЙ)-иридий-платина, (см. ПЛАТИНА) является платиновым металлом. Конфигурация внешней и предвнешней электронных оболочек 5s2p6d76s2. Степени окисления от +1 до +6 (валентности I-VI). Наиболее характерны степени окисления +3 и +4.
Радиус атома 0,135 нм, ионный радиус иона Ir2+ - 0,089 нм, иона Ir3+ - 0,082 нм, Ir4+ - 0,077 нм, Ir5+- 0,071 нм. Энергии последовательной ионизации 9,1 и 17,0 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 2,2.
Иридий - тяжелый серебристо-белый металл.
История открытия
Открыт в 1804 английским химиком С. Теннантом (см. ТЕННАНТ Смитсон), который изучал состав платиновых минералов.
Нахождение в природе
Иридий - очень редкий элемент, содержание в земной коре 1·10-7% по массе. В природе встречается в виде сплавов с осмием (осмистый иридий), платиной, родием (см. РОДИЙ), рутением (см. РУТЕНИЙ) и другими платиновыми металлами (см. ПЛАТИНОВЫЕ МЕТАЛЛЫ). В рассеянной форме (10-4% по массе) содержится в сульфидных медно-никелевых железосодержащих рудах.
Получение
Основной источник иридия - анодные шламы медно-никелевого производства. Полученный шлам обогащают. Потом, действуя на него царской водкой (см. ЦАРСКАЯ ВОДКА), при нагревании переводят в раствор платину, палладий (см. ПАЛЛАДИЙ (химический элемент)), родий, иридий и рутений в виде хлоридных комплексов H2[PtCl6], H2[PdCl4], H3[RhCl6], H2[IrCl6] и H2[RuCl6]. Осмий остается в нерастворимом осадке. Из полученного раствора добавлением хлорида аммония NH4Cl сначала осаждают комплекс платины (NH4)2[PtCl6], а затем комплекс иридия (NH4)2[IrCl6] и рутения (NH4)2[RuCl6]. При прокаливании (NH4)2[IrCl6] на воздухе получают металлический иридий:
(NH4)2[IrCl6] = Ir + N2 + 6HCl + H2.
Физические и химические свойства
Иридий - тяжелый серебристо-белый металл (плотность при 20 °C 22,65 кг/дм3). Решетка кубическая гранецентрированная, а= 0,38387 нм. Температура плавления 2447 °C, кипения 4380 °C. В ряду стандартных потенциалов расположен правее водорода (см. ВОДОРОД). На воздухе иридий устойчив, с кислотами-неокислителями и водой не реагирует.
Отличается высокой химической стойкостью. С неметаллами взаимодействует только в мелкораздробленном состоянии при температуре красного каления. Взаимодействие с кислородом (см. КИСЛОРОД) происходит только при температуре выше 1000 °C, при этом образуется диоксид иридия IrO2.
Оксиды иридия не растворяются в воде, кислотах и щелочах.
Компактный иридий при температурах до 100 °C не реагирует со всеми известными кислотами и их смесями, в том числе и с царской водкой. Для перевода этих металлов в растворимые в воде хлорокомплексы порошок, содержащий эти металлы, хлорируют при нагревании в присутствии комплексообразователя NaCl:
Ir + 2Cl2 + 2NaCl = Na2[IrCl6]
Гидроксид Ir(OH)4 (IrO2·2H2O) образуется при нейтрализации растворов хлороиридатов(IV) в присутствии окислителей. Осадок Ir2O3·xH2O выпадает при нейтрализации щелочью хлороиридатов (III) и легко окисляется на воздухе до IrO2. Гидроксиды иридия практически не растворяются в воде. В растворимую форму оксиды иридия переводят, окисляя их в присутствии комплексообразователя:
IrO2 + 4HCl + 2NaCl = Na2[IrCl6] + 2H2O.
Высшая степень окисления +6 проявляется у иридия в гексафториде IrF6. Это очень сильный окислитель, способный окислить даже воду:
2IrF6 + 10H2O = 2Ir(OH)4 + 12HF + O2,
или NO:
NO + IrF6 = NO+[IrF6]- .
Как и для других d-элементов, для иридия характерно образование комплексных соединений с координационным числом 6. Известно большое число иридийорганических соединений со связью Ir-C.
Применение
Из чистого иридия изготавливают тигли для выращивания монокристаллов, фольгу для неамальгамирующихся катодов, ответственные детали контрольно-измерительных приборов. Иридий используется для иридирования поверхностей изделий. Радиоактивный изотоп 192Ir используют в качестве портативного источника g-излучения для радиографических исследований трубопроводов и радиотерапии онкологических заболеваний. До 1960 международным эталоном метра служил изготовленный из платино-иридиевого сплава брус, находящийся в Международном бюро мер и весов в Севре. На одной из плоскостей этого бруса нанесены два штриха, на расстоянии 1 м друг от друга.
ИРИДИЙ (лат. Iridium) - Ir, химический элемент VIII группы периодической системы, атомный номер 77, атомная масса 192,22, относится к платиновым металлам. Плотность 22,65 г/см³, tпл 2447 .С. Применяют для нанесения защитных покрытий. Компонент сплавов с Pt, Os и др. (химическая аппаратура, эталоны мер, детали измерительных приборов, напайка "вечных перьев"). Название от греч. iris - радуга.
-я, м.
Химический элемент, тяжелый тугоплавкий металл серовато-белого цвета.
[От греч. ’ι̃ρις, ’ίριδος - радуга]
ИРИДИЙ (Iridium), Ir, химический элемент VIII группы периодической системы, атомный номер 77, атомная масса 192,22; относится к платиновым металлам. Открыт английским химиком С. Теннантом в 1804.
ИРИДИЙ (от греч. iris - радуга). Металл, из группы платины, соединения которого отличаются радужными цветами.
- Платиновый металл.
- «Радуга» среди химических элементов.
- Химический элемент, Ir.
- Из этого химического элемента изготавливают тигли для выращивания монокристаллов.