сущ., кол-во синонимов: 1
конкремент (8)
ЛИТИЕВЫЕ РУДЫ - ЛИ́ТИЕВЫЕ РУ́ДЫ. Главные минералы: сподумен (см. СПОДУМЕН), петалит, лепидолит (см. ЛЕПИДОЛИТ), амблигонит (см. АМБЛИГОНИТ), циннвальдит (см. ЦИННВАЛЬДИТ) и др. Встречаются в гранитных пегматитах (см. ПЕГМАТИТ) и грейзенах (см. ГРЕЙЗЕН) . Содержание Li2O в руде 0,2-1,2%. Главные месторождения: Маноно-Китотоло (см. МАНОНО-КИТОТОЛО) (Демократическая Республика Конго), Кингс-Маутин (США).
ЛИТИЕВЫЕ РУДЫ. Главные минералы: сподумен - петалит, лепидолит, амблигонит, циннвальдит и др. Встречаются в гранитных пегматитах и грейзенах. Содержание Li2O в руде 0,2-1,2%. Главные месторождения: Маноно-Китотоло (Заир), Кингс-Маутин (США).
Ли́тиевые ру́ды {-} - главные минералы: сподумен, петалит, лепидолит, амблигонит, циннвальдит и др. Встречаются в гранитных пегматитах и грейзенах. Содержание Li2O в руде 0,2-1,2%. Главные месторождения: Маноно-Китотоло (Демократическая Республика Конго), Кингс-Маунтин (США).
прил.
1. соотн. с сущ. литий, связанный с ним
2. Свойственный литию, характерный для него.
3. Содержащий в себе литий.
ли́тиевый, ли́тиевая, ли́тиевое, ли́тиевые, ли́тиевого, ли́тиевой, ли́тиевых, ли́тиевому, ли́тиевым, ли́тиевую, ли́тиевою, ли́тиевыми, ли́тиевом, ли́тиев, ли́тиева, ли́тиево, ли́тиевы, ли́тиевее, поли́тиевее, ли́тиевей, поли́тиевей
ЛИ́ТИЙ, лития, мн. нет, муж. (от греч. lithios - каменный) (минер., хим.). Химический элемент - серебристобелый, мягкий, очень легкий щелочный металл, не встречающийся в природе в чистом виде, а только в виде солей.
ЛИ́ТИЙ, -я, м
Химический элемент, мягкий (легко режется ножом), очень легкий щелочной металл серебристо-белого цвета (в природе в чистом виде не встречается); на воздухе легко окисляется.
Литий применяется в металлургии, как теплоноситель - в ядерных реакторах, используется в медицине, в химических источниках тока, при изготовлении термостойкой керамики, специальных стекол и др.
ЛИ́ТИЙ -я; м. [от греч. lithos - камень, минерал] Химический элемент (Li), мягкий, очень лёгкий щелочной металл серебристо-белого цвета (в природе в чистом виде не встречается).
◁ Ли́тиевый, -ая, -ое.
* * *
ли́тий (лат. Lithium), химический элемент I группы периодической системы, относится к щелочным металлам. Название от греч. líthos - камень (открыт в минерале петалите). Серебристо-белый, самый лёгкий из металлов; плотность 0,533 г/см3, tпл 180,5°C. Химически очень активен, окисляется при обычной температуре; реагирует с азотом, образуя нитрид Li3N. Минералы - сподумен, лепидолит и др. Изотоп Li - единственный промышленный источник для производства трития. Литий используют для раскисления, легирования и модифицирования сплавов (например, аэрона, склерона), как теплоноситель в ядерных реакторах, компонент сплавов на основе Mg и Al, анод в химических источниках тока; некоторые соединения лития входят в состав пластичных смазок, специальных стёкол, термостойкой керамики, используются в медицине.
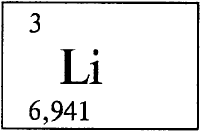
* * *
ЛИТИЙ - ЛИ́ТИЙ (лат. Lithium), Li, химический элемент с атомным номером 3, атомная масса 6,941. Химический символ Li читается так же, как и название самого элемента.
Литий встречается в природе в виде двух стабильных нуклидов (см. НУКЛИД)6Li (7,52% по массе) и 7Li (92,48%). В периодической системе Д. И. Менделеева литий расположен во втором периоде, группе IA и принадлежит к числу щелочных металлов (см. ЩЕЛОЧНЫЕ МЕТАЛЛЫ). Конфигурация электронной оболочки нейтрального атома лития 1s22s1. В соединениях литий всегда проявляет степень окисления +1.
Металлический радиус атома лития 0,152 нм, радиус иона Li+ 0,078 нм. Энергии последовательной ионизации атома лития 5,39 и 75,6 эВ. Электроотрицательность по Полингу 0,98, самая большая у щелочных металлов.
В виде простого вещества литий - мягкий, пластичный, легкий, серебристый металл.
История открытия и получение
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном (см. АРФВЕДСОН Юхан Август)сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене (см. СПОДУМЕН)LiAl[Si2O6] и в лепидолите (см. ЛЕПИДОЛИТ)KLi1.5Al1.5[Si3AlO10](F,OH)2. Свое название получил из-за того, что был обнаружен в «камнях» (греч. Litos - камень). Характерное для соединений лития красное окрашивание пламени впервые наблюдал немецкий химик Х.Г.Гмелин в 1818 году. В этом же году английский химик Г. Дэви (см. ДЭВИ Гемфри) электролизом расплава гидроксида лития получил кусочек металла. Получить свободный металл в достаточных количествах удалось впервые только в 1855 году путем электролиза расплавленного хлорида:
2LiCl = 2Li + Cl2
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Нахождение в природе
Литий довольно широко распространен в земной коре, его содержание в ней составляет 6,5·10-3% по массе. Как уже упоминалось, основные минералы, содержащие литий, - это петалит (содержит 3,5-4,9 % Li2O), сподумен (6-7 % Li2O), лепидолит (4-6 % Li2,O) и амблигонит (см. АМБЛИГОНИТ)LiAl [PO4] - 8-10 % Li2,O. В виде примеси литий содержится в ряде породообразующих минералов, а также присутствует в рапе некоторых озер и в минерализованных водах. В морской воде содержится около 2·10-5 % лития.
Физические и химические свойства
Из металлов литий самый легкий, его плотность 0,534 г/см3 . Температура плавления 180,5°C, температура кипения 1326°C. При температурах от -193°C до температуры плавления устойчива кубическая объемно центрированная модификация лития с параметром элементарной ячейки а=0,350 нм.
Из-за небольшого радиуса и маленького ионного заряда литий по своим свойствам больше всего напоминает не другие щелочные металлы, а элемент группы IIA магний (см. МАГНИЙ). Литий химически очень активен. Он способен взаимодействовать с кислородом и азотом воздуха при обычных условиях, поэтому на воздухе он быстро окисляется с образованием темного налета продуктов взаимодействия:
4Li + O2 = 2Li2O,
6Li + N2 = 2Li3N
При контактах с галогенами литий самовоспламеняется при обычных условиях. Подобно магнию, нагретый литий способен гореть в CO2:
4Li + CO2 = C + 2Li2O
Стандартный электродный потенциал Li/Li+ имеет наибольшее отрицательное значение (E°298 = -3,05 B) по сравнению со стандартными электродными потенциалами других металлов. Это обусловлено большой энергией гидратации маленького иона Li+, что значительно смещает равновесие в сторону ионизации металла:
Liтвердый Li+раствор + e
Для слабо сольватирующих растворителей значение электродного потенциала лития соответствует его меньшей химической активности в ряду щелочных металлов.
Соединения лития - соли - как правило, бесцветные кристаллические вещества. По химическому поведению соли лития несколько напоминают аналогичные соединения магния или кальция. Плохо растворимы в воде фторид LiF, карбонат Li2CO3, фосфат Li2PO4, хорошо растворим хлорат лития LiClO3 - это, пожалуй, одно из самых хорошо растворимых соединения в неорганической химии (при 18°C в 100 г воды растворяется 313,5 г LiClO3).
Оксид лития Li2O - белое твердое вещество - представляет собой типичный щелочной оксид. Li2O активно реагирует с водой с образованием гидроксида лития LiOH.
Этот гидроксид получают электролизом водных растворов LiCl:
2LiCl + 2H2O = 2LiOH + Cl2 + H2
LiOH - сильное основание, но оно отличается по свойствам от гидроксидов других щелочных металлов. Гидроксид лития уступает им в растворимости. При прокаливании гидроксид лития теряет воду:
2LiOH = Li2O + H2O
Большое значение в синтезе органических и неорганических соединений имеет гидрид лития LiH, который образуется при взаимодействии расплавленного лития с водородом:
2Li + H2 = 2LiH
LiH - ионное соединение, строение кристаллической решетки которого похоже на строение кристаллической решетки хлорида натрия NaCl. Гидрид лития можно использовать в качестве источника водорода для наполнения аэростатов и спасательного снаряжения (надувных лодок и т.п.), так как при его гидролизе образуется большое количество водорода (1 кг LiH дает 2,8 м3 H2):
LiH + H2O = LiOH + H2
Он также находит применение при синтезе различных гидридов, например, борогидрида лития:
BCl3 + 4LiH = Li[BH4] + 3LiCl.
Литий образует соединения с частично ковалентной связью Li-C, т. е. литийорганические соединения. Например, при реакции иодбензола C6H5I с литием в органических растворителях протекает реакция:
C6H5I + 2Li = C6H5Li + LiI.
Литийорганические соединения широко используются в органическом синтезе и в качестве катализаторов.
Применение
Из лития изготовляют аноды химических источников тока, работающих на основе неводных твердых электролитов. Жидкий литий может служить теплоносителем в ядерных реакторах. С использованием нуклида 6Li получают радиоактивный тритий 31H (Т):
63Li + 10n = 31H + 42He.
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий, в черной и цветной металлургии (для раскисления, повышения пластичности и прочности сплавов), для получения пластичных смазок. Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Биологическая роль
Литий в незначительных количествах присутствует в живых организмах, но по-видимому, не выполняет никаких биологических функций. Установлено его стимулирующее действие на некоторые процессы в растениях, способность повышать их устойчивость к заболеваниям.
В организме среднего человека (масса 70 кг) содержится около 0,7 мг лития. Токсическая доза 90-200 мг.
Особенности обращения с литием
Как и другие щелочные металлы, металлический литий способен вызывать ожоги кожи и слизистых, особенно в присутствии влаги. Поэтому работать с ним можно только в защитной одежде и очках. Хранят литий в герметичной таре под слоем минерального масла. Отходы лития нельзя выбрасывать в мусор, для уничтожения их следует обработать этиловым спиртом:
2С2Н5ОН + 2Li = 2С2Н5ОLi + Н2
Образовавшийся этилат лития затем разлагают водой до спирта и гидроксида лития LiOH.
ЛИТИЙ (лат. Lithium) - Li, химический элемент I группы периодической системы, атомный номер 3, атомная масса 6,941, относится к щелочным металлам. Название от греч. lithos - камень (открыт в минерале петалите). Серибристо-белый, самый легкий из металлов; плотность 0,533 г/см³, tплощадь 180,5 .С. Химически очень активен, окисляется при обычной температуре; реагирует с азотом, образуя нитрид Li3N. Минералы - сподумен, лепидолит и др. Изотоп Li - единственный промышленный источник для производства трития. Литий используют для раскисления, легирования и модифицирования сплавов (напр., аэрона, склерона), как теплоноситель в ядерных реакторах, компонент сплавов на основе Mg и Al, анод в химических источниках тока; некоторые соединения лития входят в состав пластичных смазок, специальных стекол, термостойкой керамики, используются в медицине.
-я, м.
Химический элемент, мягкий, очень легкий щелочной металл серебристо-белого цвета, не встречающийся в природе в чистом виде.
[От греч. λίθος - камень, минерал]
ЛИТИЙ (Lithium), Li, химический элемент I группы периодической системы, атомный номер 3, атомная масса 6,941; относится к щелочным металлам, tпл 180,54°C. Литий используют для изготовления анодов для химических источников тока, в производстве меди, сплавов с магнием, алюминием, кремнием, антифрикционных и других сплавов, как теплоноситель в ядерных реакторах; изотоп 6Li - для получения трития. Литий открыл в 1817 шведский химик Ю.А. Арфведсон, впервые получил английский ученый Г. Дэви в 1818.
ЛИТИЙ (лат. lithium, от греч. lithos - камень). Металл белого цвета, открытый в 1817 г. в петалите; все соли его растворимы в воде.
- Щелочной металл.
- Первый металл в таблице Менделеева.
- Металл, который мягче воска и легче дерева.
- Самый легковесный металл.
- Какой металл плавится при температуре тела?
- Самый легкоокисляемый металл.
- Химический элемент, Li.
- «Литос» по-гречески «камень», а какой металл получил шведский химик Арфедсон самым первым из царства камней?
- Батискаф и атомная бомба, пиротехника и лечение психозов - вот области применения этого химического элемента.
- Своё название этот химический элемент получил из-за того, что был обнаружен в камнях.
- Этот щелочной металл был воспет большим любителем химии Куртом Кобэйном.
Литийоргани́ческие соедине́ния - содержат в молекуле атом лития, непосредственно связанный с атомом углерода. Применяются как катализаторы полимеризации (бутиллитий C4H9Li и др.) при получении бутадиеновых и изопреновых каучуков, в органической синтезе.
* * *
ЛИТИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ - ЛИТИЙОРГАНИ́ЧЕСКИЕ СОЕДИНЕ́НИЯ, содержат в молекуле атом лития, непосредственно связанный с атомом углерода. Применяются как катализаторы полимеризации (бутиллитий C4H9Li и др.) при получении бутадиеновых и изопреновых каучуков, в органическом синтезе.
ЛИТИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ - содержат в молекуле атом лития, непосредственно связанный с атомом углерода. Применяются как катализаторы полимеризации (бутиллитий C4H9Li и др.) при получении бутадиеновых и изопреновых каучуков, в органическом синтезе.
Лити́нский Генрих Ильич (1901-1985), композитор, заслуженный деятель искусств РСФСР (1957), народный артист Якутской АССР и Татарской АССР (1964). Ученик Р. М. Глиэра. Автор (совместно с М. Н. Жирковым) первых якутских музыкально-сценических произведений: оперы «Нюргун Боотур» (1946), балета «Полевой цветок» (1947). Профессор Московской консерватории (с 1933), Музыкально-педагогического института им. Гнесиных (с 1947).
Лити́нский Генрих Ильич (1901—1985), композитор, заслуженный деятель искусств РСФСР (1957), народный артист Якутской АССР и Татарской АССР (1964). Ученик Р. М. Глиэра. Автор (совместно с М. Н. Жирковым) первых якутских музыкально-сценических произведений: оперы «Нюргун Боотур» (1946), балета «Полевой цветок» (1947). Профессор Московской консерватории (с 1933), Музыкально-педагогического института имени Гнесиных (с 1947).
ЛИТИЯ - жен., церк. молитвенное священнодействие, совершаемое вне храма или в притворе его.
| Краткое молитвословие об упокоении душ усопших. Литийный, к литии относящийся
Лития́ (от греч. litē - усердная молитва), 1) часть всенощного богослужения накануне православных праздников. Совершается также во время похорон, поминовения умерших и во время крестного хода.
2) Краткая церковная служба в притворе христианского храма.
* * *
ЛИТИЯ - ЛИТИЯ́ (от греч. lite - усердное моление):
1) часть великой Вечерни (см. ВЕЧЕРНЯ) на праздничном Всенощном бдении (см. ВСЕНОЩНОЕ БДЕНИЕ), во время которой совершается исхождение в притвор для освящения хлеба, пшеницы, вина и елея. Усиленное моление выражается в многократном воззвании «Господи, помилуй». В древности лития совершалась вне храма. В настоящее время может совершаться вне храма в случае народных бедствий или в дни памяти избавления от них, соединяясь тогда с молебном и крестным ходом.
2) лития заупокойная, краткое моление об умерших, которое совершается в притворе после Вечерни и Утрени (см. УТРЕНЯ).
ЛИТИЯ (от греч. lite - просьба - моление), 1) обряд в христианстве, отпевание умершего при выносе тела из дома, в ходе погребальной процессии и на могиле.
2) Краткая церковная служба в притворе христианского храма.
ЛИТИЯ́ (от греч. λιτη - просьба, усердное моление) - особое богослужеб. действо (или самостоят. богослужение), тесно связ. с литанией. В древности - моление вне храма. В наст. время различаются: 1) "Л. вне монастыря"; 2) Л. на Великой Вечерне, во время Всенощного бдения, совершаемая в храмовом притворе; при этом освящается хлеб, пшеница, вино и елей. Исхождение в притвор символизирует полное исхождение из храма в древности; 3) Л. по окончании праздничной и воскресной Утрени; 4) "Л. за упокой" - краткое богослужение мемориального характера, совершаемое при разл. обстоятельствах и в разное время.
Лития, и, ж.
Род краткого богослужения.
► Сладкий час успокоенья: Звон литии, псалмопенья Свято-горские молчат. // Тютчев. Стихотворения //*
ЗАУПОКОЙНАЯ ЛИТИЯ.
B́ сущ см. Приложение II
(в христианстве: краткая молитва об усопших)
литии́
литии́
литию́
литие́й́
о литии́
мн.
литии́
лити́й́
лития́м́
литии́
лития́ми
о лития́х́
Мир вам, рощи, луг и липы,
Литии́ медовый ладан.
Всё принявшему с улыбкой
Ничего от вас не надо.
С. А. Есенин, «О товарищах веселых…»
Заповедей не блюла, не ходила к причастью.
- Видно, пока надо мной не пропоют литию́, -
Буду грешить - как грешу - как грешила: со страстью!
Господом данными мне чувствами - всеми пятью!
М. И. Цветаева, «Заповедей не блюла, не ходила к причастью…»
Сведения о происхождении слова:
Слово происходит от греческого λιτή ‘молитва’ с ударением на втором слоге.
Сведения о старой норме ударения:
Некоторые старинные словари приводят лити́я, однако норма ударения в данном слове изменилась.
"Узелок на память":
Если постановка ударения в этом слове затрудняет вас, то, возможно, поможет ассоциация лития́ - помина́ние: у обоих слов ударение падает на третий слог.
молитвенное священнодействие, совершаемое вне храма или в притворе его; краткое молитвословие в успокоение душ усопших (Даль)
См. молитва...
лития́
литья́ "молебен, краткая молитва за упокой души", др.-русск., ст.-слав. литиС© λιτή (Супр., Син. патер. ХI в.; см. Срезн. II, 24). Из греч. λιτή "рrосеssiо ессlеsiаstiса" (Дюканж); см. Фасмер, ИОРЯС 12, 2, 253; Гр.-сл. эт. 115; Бернекер 1, 725; Мi. ЕW 171.
Ли́тия гидрокси́д - LiOH, сильное основание (щёлочь). Бесцветные кристаллы. Хорошо растворим в воде. Применяют в щелочных аккумуляторах, для получения смазок, соединения лития, как поглотитель CO2 в противогазах, подводных лодках, самолётах и космических кораблях.
* * *
ЛИТИЯ ГИДРОКСИД - ЛИ́ТИЯ ГИДРОКСИ́Д, LiOH, сильное основание (щелочь). Бесцветные кристаллы. Хорошо растворим в воде. Применяют: в щелочных аккумуляторах, для получения смазок; соединения лития, как поглотитель CO2 в противогазах, подводных лодках, самолетах и космических кораблях.
ЛИТИЯ ГИДРОКСИД - LiOH, сильное основание (щелочь). Бесцветные кристаллы. Хорошо растворим в воде. Применяют: в щелочных аккумуляторах, для получения смазок; соединения лития, как поглотитель CO2 в противогазах, подводных лодках, самолетах и космических кораблях.