Мужское имя.
Искусный охотник; меткий стрелок, снайпер. Диалектальные варианты: Миргун, Маргун.
м.
Химический элемент, серебристо-белый хрупкий металл, встречающийся в природе в виде соединений (оксидов, карбонатов и т.п.).
МА́РГАНЕЦ, марганца, мн. нет, муж. (итал. manganese - марганцевая руда) (хим.). Хрупкий металл розовато-белого цвета.
МА́РГАНЕЦ, -нца, муж. Химический элемент, металл серебристо-белого цвета.
| прил. марганцевый, -ая, -ое и марганцовый, -ая, -ое. Марганцевая руда.
МАРГАНЕЦ - муж. металл манган, марган; черно-бурый окисел его, употребляемый в разных производствах, особ. для добыванья кислорода.
| Черный (железистый?) подзем известковой почвы. Марганцевый, к нему относящийся, его содержащий; руды этого металла носят названия марганцевого блеска, бленды, пены и пр. Марганцеватая вениса, содержащая немного марганца. Марганцевистая кислота, низшая степень окисления, а марганцевая - высшая.
МА́РГАНЕЦ, -нца, м
Химический элемент, тяжелый металл серебристо-белого цвета.
Главным потребителем марганца является металлургическая промышленность, где он используется при получении легированных сталей и чугунов, марганцевых бронз, манганина и др.
МА́РГАНЕЦ -нца; м. [от нем. Marganez] Химический элемент (Мn), тяжёлый металл серебристо-белого цвета.
◁ Ма́рганцевый, -ая, -ое. М-ое месторождение. М-ая руда. М-ая сталь.
* * *
Ма́рганец - город (с 1938) в Украине. Железнодорожная станция. 54,7 тыс. жителей (1991). Добыча и обогащение марганцевых руд (Никопольский марганцово-рудный бассейн). Предприятия лёгкой, мебельной промышленности. Историко-краеведческий музей.
-----------------------------------
МА́РГАНЕЦ -нца; м. [от нем. Marganez] Химический элемент (Мn), тяжёлый металл серебристо-белого цвета.
◁ Ма́рганцевый, -ая, -ое. М-ое месторождение. М-ая руда. М-ая сталь.
* * *
ма́рганец (лат. Manganum), химический элемент VII группы периодической системы. Название от немецкого Manganerz - ма́рганцевая руда. Серебристо-белый металл; плотность 7,44 г/см3, tпл 1244ºC. Минералы - пиролюзит, псиломелан, манганит и др.; огромны запасы марганца на дне океанов (железомарганцевые конкреции). Марганец в виде сплавов с железом (ферромарганец) и кремнием (силикомарганец) идёт на производство рельсовой и конструкционной стали; им легируют сплавы на основе алюминия, магния и меди.

МАРГАНЕЦ - город (с 1938) на Украине, Днепропетровская обл. Железнодорожная станция. 54,7 тыс. жителей (1991). Добыча и обогащение марганцевых руд (Никопольский марганцоворудный бас.). Предприятия легкой, мебельной промышленности. Историко-краеведческий музей.
-----------------------------------
МАРГАНЕЦ (лат. Manganum) - Mn, химический элемент VII группы периодической системы, атомный номер 25, атомная масса 54,9380. Название от немецкого Manganerz - марганцевая руда. Серебристо-белый металл; плотность 7,44 г/см³, tпл 1244 .С. Минералы - пиролюзит, псиломелан, манганит и др.; огромны запасы марганца на дне океанов (железомарганцевые конкреции). Марганец в виде сплавов с железом (ферромарганец) и кремнием (силикомарганец) идет на производство рельсовой и конструкционной стали; им легируют сплавы на основе алюминия, магния и меди.
МАРГАНЕЦ (Manganum), Mn, химический элемент VII группы периодической системы, атомный номер 25, атомная масса 54,9380; металл, tпл 1244°C. Марганец используют для легирования сталей и получения сплавов на его основе, в производстве микроудобрений. Открыт шведским химиком К. Шееле и получен шведским минералогом Ю. Ганом в 1774.
мед. марганец (manganese)
Компонент (наряду с цинком и медью) ферментативной системы антиоксидантов.
- Необходим для здоровья костей и нервной системы.
см. тж микроэлементы
ма́рганец, ма́рганцы, ма́рганца, ма́рганцев, ма́рганцу, ма́рганцам, ма́рганцем, ма́рганцами, ма́рганце, ма́рганцах
Заимств. в XVIII в. из нем. яз., где Marganerz - сложение Mangan «марганец» и Erz «руда». В рус. яз. в слове произошла метатеза н - р > р - н (ср. тарелка < талерка, см. тарелка). Марганец буквально - «марганцевая руда».
ма́рганец
Из нем. Мanganerz, сближенного со словами на суф. -ец, или непосредственно из ит. manganese - то же; см. Преобр. I, 510; Маценауэр 250.
МАРГАНЕЦ (ново-лат.), marganesium, испорченное слово, произведен. от magneg - магнит, по сходству с ним). Металл сероватого цвета, трудноплавкий, хрупкий встречающийся в черной марганцовой руде.
МАРГАНЕЦ (город) - МА́РГАНЕЦ, город (с 1938) на Украине (см. УКРАИНА), Днепропетровская область (см. ДНЕПРОПЕТРОВСКАЯ ОБЛАСТЬ). Железнодорожная станция. Население 54,7 тыс человек (2001). Добыча и обогащение марганцевых руд (Никопольский марганцоворудный бассейн). Предприятия легкой, мебельной промышленности. Историко-краеведческий музей.
МАРГАНЕЦ (химический элемент) - МА́РГАНЕЦ (лат. Manganum), Mn, химический элемент с атомным номером 25, атомная масса 54,9380. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида (см. НУКЛИД) 55Mn. Конфигурация двух внешних электронных слоев атома марганца 3s2p6d54s2. В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, к которой относятся также технеций (см. ТЕХНЕЦИЙ) и рений (см. РЕНИЙ), и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 (валентность II) до +7 (валентность VII), наиболее устойчивы соединения, в которых марганец проявляет степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0.
Радиус нейтрального атома марганца 0,130 нм, радиус иона Mn2+ - 0,080-0,104 нм, иона Mn7+ - 0,039-0,060 нм. Энергии последовательной ионизации атома марганца 7,435, 15,64, 33,7, 51,2, 72,4 эВ. По шкале Полинга электроотрицательность марганца 1,55; марганец принадлежит к числу переходных металлов. Марганец в компактном виде - твердый серебристо-белый металл.
История открытия
Один из основных материалов марганца - пиролюзит (см. ПИРОЛЮЗИТ)- был известен в древности как черная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле (см. ШЕЕЛЕ Карл Вильгельм) показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану (см. ГАН Юхан Готлиб) , который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале 19 в. для него было принято название «манганум» (от немецкого Manganerz - марганцевая руда).
Нахождение в природе
В земной коре содержание марганца составляет около 0,1 % по массе. В свободном виде марганец не встречается. Из руд наиболее распространены пиролюзит MnO2(содержит 63,2 % марганца), манганит (см. МАНГАНИТ) MnO2·Mn(OH)2 (62,5 % марганца), браунит (см. БРАУНИТ) Mn2O3 (69,5 % марганца), родохрозит (см. РОДОХРОЗИТ) MnCo3 (47,8 % марганца), псиломелан (см. ПСИЛОМЕЛАН) mMnO·MnO2·nH2O (45-60% марганца). Марганец содержат жՐېՐאޭмарганцевые конкреции, которые в больших количествах (сотни миллиардов тонн) находятся на дне Тихого, Атлантического и Индийского океанов. В морской воде содержится около 1,0·10-8 % марганца. Промышленного значения эти запасы марганца пока не имеют из-за сложности подъема конкреций на поверхность.
Получение
Промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление). Иногда в качестве восстановителя используют алюминий или кремний. Для практических целей чаще всего используют ферромарганец, полученный в доменном процессе (см. ст. Железо (см. ЖЕЛЕЗО)) при восстановлении руд железа и марганца коксом (см. КОКС). В ферромарганце содержание углерода составляет 6-8 % по массе. Чистый марганец получают электролизом водных растворов сульфата марганца MnSO4, который проводят в присутствии сульфата аммония (NH4)2SO4.
Физические и химические свойства
Марганец твердый хрупкий металл. Известны четыре кубические модификации металлического марганца. При температурах от комнатной и до 710°C устойчив альфа-Mn, параметр решетки а = 0,89125 нм, плотность 7,44 кг/дм3. В интервале температур 710-1090°C существует бета-Mn, параметр решетки а = 0,6300 нм; при температурах 1090-1137°C - гамма-Mn, параметр решетки а = 0,38550 нм. Наконец, при температуре от 1137°C и до температуры плавления (1244°C) устойчив дельта-Mn с параметром решетки а = 0,30750 нм. Модификаци альфа, бета и дельта хрупкие, гамма-Mn пластичен. Температура кипения марганца около 2080°C.
На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800°C марганец покрывается окалиной, состоящей из внешнего слоя Mn3O4 и внутреннего слоя состава MnO. Марганец образует несколько оксидов: MnO, Mn3O4, Mn2O3, MnO2 и Mn2O7. Все они, кроме Mn2O7, представляющего собой при комнатной температуре маслянистую зеленую жидкость с температурой плавления 5,9°C, твердые кристаллические вещества. Монооксид марганца MnO образуется при разложении солей двухвалентного марганца (карбоната и других) при температуре около 300°C в инертной атмосфере:
MnCO3 = MnO + CO2
Этот оксид обладает полупроводниковыми свойствами. При разложении MnOОН можно получить Mn2O3. Этот же оксид марганца образуется при нагревании MnO2 на воздухе при температуре примерно 600°C:
4MnO2 = 2Mn2O3 + O2
Оксид Mn2O3 восстанавливается водородом до MnO, а под действием разбавленных серной и азотной кислот переходит в диоксид марганца MnO2. Если MnO2 прокаливать при температуре около 950°C, то наблюдается отщепление кислорода и образование оксида марганца состава Mn3O4:
3MnO2 = Mn3O4 + O2
Этот оксид можно представить как MnO·Mn2О3, и по свойствам Mn3О4 соответствует смеси этих оксидов. Диоксид марганца MnO2 - наиболее распространенное природное соединение марганца в природе, существующее в нескольких полиморфных формах. Так называемая бета-модификация MnO2 - это уже упоминавшийся минерал пиролюзит. Ромбическая модификация диоксида марганца, гамма-MnO2 также встречается в природе. Это - минерал рамсделит (другое название - полианит).
Диоксид марганца нестехиометричен, в его решетке всегда наблюдается дефицит кислорода. Если оксиды марганца, отвечающие его более низким степеням окисления, чем +4, - основные, то диоксид марганца обладает амфотерными свойствами. При 170°C MnO2 можно восстановить водородом до MnO. Если к перманганату калия KMnO4 добавить концентрированную серную кислоту, то образуется кислотный оксид Mn2O7, обладающий сильными окислительными свойствами:
2KMnO4 + 2H2SO4 = 2KHSO4 + Mn2O7 + H2O.
Mn2O7 - кислотный оксид, ему отвечает сильная, не существующая в свободном состоянии марганцовая кислота НMnO4. При взаимодействии марганца с галогенами образуются дигалогениды MnHal2. В случае фтора возможно также образование фторидов состава MnF3 и MnF4, а в случае хлора - также трихлорида MnCl3. Реакции марганца с серой приводят к образованию сульфидов составов MnS (существует в трех полиморфных формах) и MnS2. Известна целая группа нитридов марганца: MnN6, Mn5N2, Mn4N, MnN, Mn6N5, Mn3N2.
С фосфором марганец образует фосфиды составов MnР, MnP3, Mn2P, Mn3P, Mn3P2 и Mn4P. Известно несколько карбидов и силицидов марганца. С холодной водой марганец реагирует очень медленно, но при нагревании скорость реакции значительно возрастает, образуется Mn(OH)2 и выделяется водород. При взаимодействии марганца с кислотами образуются соли марганца(II):
Mn + 2HCl = MnCl2 + H2.
Из растворов солей Mn2+ можно осадить плохо растворимое в воде основание средней силы Mn(OH)2:
Mn(NO3)2 + 2NaOH = Mn(OH)2 + 2NaNO3
Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцоватая кислота H2MnO4 и марганцовая кислота HMnO4, соли которых - соответственно, манганаты (например, манганат натрия Na2MnO4) и перманганаты (например, перманганат калия KMnO4). Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще)
2NaI + Na2MnO4 + 2H2O = MnO2 + I2 + 4NaOH,
так и восстановителей
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl.
В водных растворах манганаты диспропорционируют на соединения марганца(+4) и марганца(+7):
3K2MnO4 + 3Н2О = 2KMnO4 + MnO2·Н2О + 4КОН.
При этом окраска раствора из зеленой переходит в синюю, затем в фиолетовую и малиновую. За способность изменять окраску своих растворов К. Шееле назвал манганат калия минеральным хамелеоном. Перманганаты - сильные окислители. Например, перманганат калия KMnO4 в кислой среде окисляет сернистый газ SO2 до сульфата:
2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 + 2H2SO4. При давлении около 10 МПа безводный MnCl2 в присутствии металлоорганических соединений реагирует с оксидом углерода(II) CO с образованием биядерного карбонила Mn2(CO)10.
Применение
Более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления (см. РАСКИСЛЕНИЕ), десульфурации (см. ДЕСУЛЬФУРАЦИЯ) (при этом происходит удаление из стали нежелательных примесей - кислорода, серы), а также для легирования (см. ЛЕГИРОВАНИЕ) сталей, т. е. улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn2(CO)10. Соединения марганца (карбонат, оксиды и другие) используют при производстве ферритных материалов, они служат катализаторами (см. КАТАЛИЗАТОРЫ) многих химических реакций, входят в состав микроудобрений.
Биологическая роль
Марганец - микроэлемент (см. МИКРОЭЛЕМЕНТЫ), постоянно присутствующий в живых организмах и необходимый для их нормальной жизнедеятельности. Содержание марганца в растениях составляет 10-4-10-2 %, в животных 10-3-10-5%, некоторые растения (водяной орех, ряска, диатомовые водоросли) и животные (муравьи, устрицы, ряд ракообразных) способны концентрировать марганец. В организме среднего человека (масса тела 70 кг) содержится 12 мг марганца. Марганец необходим животным и растениям для нормального роста и размножения. Он активирует ряд ферментов, участвует в процессах дыхания, фотосинтеза (см. ФОТОСИНТЕЗ), влияет на проветривание и минеральные обмен.
Человек с пищей получает ежедневно 0,4-10 мг марганца. Недостаток марганца в организме может привести к заболеванию человека. Для обеспечения нормального развития растений в почву вносят марганцевые микроудобрения (обычно в форме разбавленного раствора перманганата калия). Однако избыток марганца для человеческого организма вреден. При отравлении соединениями марганца происходит поражение нервной системы, развивается так называемый марганцевый паркинсонизм. (см. ПАРКИНСОНИЗМ)ПДК в расчете на марганец для воздуха 0,03 мг/м3. Токсическая доза (для крыс) - 10-20 мг.
МАРГАНЦА ОКСИДЫ: MnO - Mn2O3, Mn3O4, MnO2, Mn2O7 (т. н. марганцевый ангидрид), Mn5O8. Встречаются в природе, напр. MnO2 - пиролюзит - исходный продукт для получения марганца и его соединений. MnO2 применяется в производстве элементов Лекланше, катализаторов, как окислитель.
МАРГАНЦА ОКСИДЫ: - МА́РГАНЦА ОКСИ́ДЫ: MnO, Mn2O3, Mn3O4, MnO2, Mn2O7 (т. н. марганцевый ангидрид), Mn5O8. Встречаются в природе, напр. MnO2 - пиролюзит - исходный продукт для получения марганца и его соединений. MnO2 применяется в производстве элементов Лекланше, катализаторов, как окислитель.
-----------------------------------
Ма́рганца окси́ды{:} - MnO, Mn3О4, Mn2О3, Mn5O8, MnO2, Mn2O7 (так называемый марганцевый ангидрид). Встречаются в природе, например. MnO2 - пиролюзит - исходный продукт для получения марганца и его соединений. MnO2 применяется в производстве элементов Лекланше, катализаторов, как окислитель.
ПОДГРУППА VIIB. СЕМЕЙСТВО МАРГАНЦА
МАРГАНЕЦ, ТЕХНЕЦИЙ, РЕНИЙ
Электронная конфигурация этих элементов марганца Mn, технеция Tc, рения Re характерна для переходных металлов. Каждый элемент имеет наполовину заполненную внутреннюю d-оболочку, т.е. имеет пять d-электронов на пяти d-орбиталях и 2 электрона на внешней s-орбитали. Исходя из факта наполовину заполненной каждой d-орбитали можно предсказать некоторые свойства элементов. Соединения марганца(II) отличаются хорошей устойчивостью к окислению и восстановлению, а соединения Mn(III) склонны переходить в соединения Mn(II). Все элементы подгруппы покрываются пассивирующей пленкой; при разрушении пленки Mn становится реакционноспособным и вытесняет водород из кислот HCl и H2SO4. Ни Tc, ни Re не растворяются в кислотах, не являющихся окислителями. Все металлы растворяются в HNO3, причем технеций и рений окисляются до M(VII), образуя HTcO4 и HReO4, а марганец переходит в M(VII) только под действием сильных окислителей. Состояние M(VII) более стабильно для Tc и Re: Mn2O7 при нагревании взрывается, а Re2O7 и Tc2O7 устойчивы даже при выпаривании их растворов. Все элементы подгруппы образуют соединения в низких степенях окисления, но более тяжелые образуют более устойчивые соединения. Состояние в степени окисления V не очень характерно, но некоторые соединения и ионы описаны. В целом Tc по свойствам ближе к Re: оба образуют сходные соединения и комплексные ионы. В подгруппе нет элемента, близкого по свойствам к Mn. Марганец более всего похож по свойствам на железо элемент, стоящий за Mn в ряду переходных металлов. Re отличается исключительно высокой температурой плавления, а по плотности ближе к платиновым металлам, наиболее тяжелым из всех металлов (табл. 14).
Марганец занимает важное место среди стратегических металлов, так как для производства каждой тонны стали требуется ок. 5,5 кг марганца. Большую часть марганца получают из пиролюзита MnO2, который существует в нескольких аллотропных модификациях от относительно хорошо закристаллизованных до почти аморфных. Металл получают восстановлением углеродом или алюминием из диоксида марганца. Руду нагревают до высоких температур в электрических печах в присутствии генераторного газа (влажный CO) с последующей обработкой продукта серной кислотой для получения MnSO4, из которого марганец выделяют электролизом. Эту же соль можно окислить до товарного продукта MnO2, используемого в технологии аккумуляторов. Около 90% Mn идет на производство железомарганцевых сплавов, получаемых термической обработкой смеси MnO2 с углеродом и оксидами железа. Один из двух таких важнейших марганецсодержащих продуктов ферромарганец состава Mn:Fe = 8:2, другой "зеркальный чугун", получаемый из шихты Mn:C:Fe = 25:5:70 в доменной печи и применяемый для раскисления и обуглероживания стали. Марганец связывает серу, содержащуюся в стали, в безопасный для стали MnS. Это очень важно, так как высокая концентрация серы в стали вызывает ее охрупчивание при высоких температурах, что препятствует горячей обработке стали. Марганцевые стали обладают высокими механическими характеристиками и пригодны для изготовления рельсов, сейфов и механизмов, а с добавками Cu, Zn и Sn (бронза) устойчивы к коррозии в морской воде и используются для изготовления корабельных винтов. Большие количества MnO2 определенных модификаций расходуются на производство сухих аккумуляторов. Некоторое количество MnO2 расходуется в производстве стекла для удаления зеленой окраски, вызванной примесью железа. Другое применение марганца в качестве дезинфицирующего средства в виде KMnO4; перманганат калия хороший реагент для количественного анализа многих веществ, например Fe, Ti, иодид-иона и др.
Технеций искусственный элемент. Впервые Tc был получен в 1937 при бомбардировке молибдена нейтронами и дейтерием:
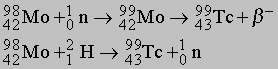
В ядерном реакторе заметные количества Tc получаются из изотопа 9942Mo продукта распада
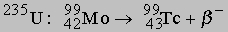
.
Конечным продуктом распада 9943Tc является стабильный изотоп рутения 9944Ru. Для отделения Tc от U их переводят в хлориды, после обработки пероксидом водорода получают UO2Cl2 и действием сероводорода на получившийся раствор с добавлением к нему PtCl4 осаждают Tc2S7 и PtS2. Осадок сульфидов растворяют в гидроксиде аммония, из которого после добавления кислоты перегонкой выделяют Tc2O7. Металлический технеций получают из пертехнетата аммония NH4TcO4, превращая его в оксид и восстанавливая последний водородом.
Рений. Металлический рений получают водородным восстановлением перрената аммония NH4ReO4. В природе рений встречается чаще в рудах молибдена, чем марганца, как можно было бы предполагать исходя из общности их подгруппы. Сегодня рений получают в количестве, достаточном для промышленного применения, например, при каталитическом гидрировании. Термоэлектронная эмиссия рения более технологична, чем у вольфрама, и поэтому находит применение в специальном оборудовании.
Реакции и соединения. Все эти металлы реагируют с галогенами, однако степени окисления, проявляемые марганцем, сильно отличаются от степеней окисления более тяжелых металлов. Марганец не проявляет высоких степеней окисления, образуя лишь MnF2 и MnF3. MnF3 хороший фторирующий агент, он легко разлагается, выделяя фтор, хорошо растворяется в воде, что не характерно для соединений Mn(III), но эти растворы не электропроводны, по-видимому, из-за димеризации. Рений в реакциях со фтором образует соединения с более высокими степенями окисления, например ReF4 и ReF6. При хлорировании марганца получается стабильный и хорошо растворимый в воде MnCl2. MnCl3 и MnCl4 существуют, но легко разлагаются. MnCl4 получается при действии HCl на MnO2 (пиролюзит), однако MnCl4 даже при комнатной температуре разлагается на MnCl2 и Cl2, что можно использовать как удобный метод получения хлора. Рений при взаимодействии с хлором образует трихлорид ReCl3 и пентахлорид ReCl5. Бром и иод с этими металлами образуют галогениды только в низших степенях окисления металла, например MnCl2.
Комплексообразование. Все галогениды металлов подгруппы Mn, принимая электронную пару от галогенид-иона (донора), образуют комплексные ионы и соединения. Вот некоторые примеры. [[ReF6]]2 гексафтороренат(IV), [[ReCl6]]2 гексахлороренат(IV), [[MnCl4]]2 тетрахлороманганат(II), [[ReCl6]] гексахлороренат(V). Галогениды подвергаются гидролизу, образуя оксогалогениды, которые можно получать и другими способами. Соединение MnVIIO3F получается при обработке KMnO4 фтороводородом. Оксохлорид рения(VI) ReOCl4 получается не только при гидролизе ReCl6, но и при действии O2 на ReCl5. Известны оксогалогениды и другого состава, например ReVO2F, ReVIIOF5, ReVIOF4. Ион Mn(II) является комплексообразователем большого количества ионов октаэдрического строения, проявляя в соединениях координационное число 6. Многие ионы и молекулы, способные предоставлять для химической связи электронную пару, образуют такие комплексные соединения. Особый интерес представляют [[Mn(SCN)6]]4 и [[Mn(CN)6]]4, так как эти ионы хорошо восстанавливаются электролитически, образуя с K комплексы одновалентного, а возможно, и нульвалентного марганца.
Оксиды. С увеличением степени окисления уменьшается стабильность оксидов марганца. При прямом окислении марганца получается MnO, но при нагревании образуются Mn2O3, MnO2 и Mn3O4, в чем проявляется сходство марганца с железом. Гептаоксид марганца Mn2O7 образуется при добавлении к KMnO4 сильной кислоты, но даже при низкой температуре он легко разлагается, часто со взрывом. Рений и технеций проявляют сходство, образуя гептаоксиды либо при прямом окислении, либо при действии HNO3 на оксиды в низших степенях окисления. Re2O7 и Tc2O7 значительно стабильнее, чем Mn2O7. Известен также красный оксид рения ReO3.
Амфотерность. Все элементы подгруппы проявляют амфотерные свойства в низких степенях окисления элементов. При нагревании MnO2 с основаниями образуются манганаты: Mn IVO32, голубой MnVO43, зеленый и устойчивый до 500° C MnVIO42, а также фиолетовый MnVIIO4. Манганат(V)-ион MnO43получают несколькими способами, среди которых мягкое восстановление MnO4иодид-ионом, действие основания на KMnO4 при высокой температуре. Соответствующий ион ReO33не так хорошо изучен. Перренаты и рениевая кислота образуются при окислении ReO2: при сплавлении металла или ReO2 со щелочью получается перренат натрия NaReO4; рениевая кислота HReO4 образуется в результате окисления ReO2 хлором. При обычном нагревании ReO2 происходит реакция диспропорционирования с образованием Re0 и Re2O7. Необычную степень окисления I рений проявляет при нагревании перрената с цинком, образуя Kre*4H2O, по-видимому, имеющий структуру плоского квадрата.
Другие соединения. Mn(II) образует с сульфид-ионом бледнорозовый MnS, растворимый в кислотных растворах. MnS2 получается при прямом взаимодействии металла с серой, но Mn не проявляет степень окисления IV, а образует соединение, подобное пириту FeS2. Высшие сульфиды, известные для Re и Tc, имеют соответственно состав Re2S7 и Tc2S7. При прямом синтезе марганца с C, N и Si получаются соответственно Mn3C, Mn5N3, MnSi и Mn2Si.
Ма́рганцевые ру́ды - Главные минералы: пиролюзит (63,2% Mn), псиломелан (45-60%), манганит (62,5%), вернадит (44-52%), браунит (69,5%), гаусманит (72%), родохрозит (47,8%), олигонит (23-32%), родонит (32-41%). Месторождения по происхождению осадочные, реже метаморфогенные и выветривания. Общие мировые запасы 15 млрд. т. Основные запасы марганцевых руд зарубежных стран сосредоточены в ЮАР, Австралии, Бразилии, Габоне.
* * *
МАРГАНЦЕВЫЕ РУДЫ - МА́РГАНЦЕВЫЕ РУ́ДЫ. Главные минералы: пиролюзит (см. ПИРОЛЮЗИТ) (63,2% Mn), псиломелан (см. ПСИЛОМЕЛАН) (45-60%), манганит (см. МАНГАНИТ) (62,5%), вернадит (44-52%), браунит (см. БРАУНИТ) (69,5%), гаусманит (см. ГАУСМАНИТ) (72%), родохрозит (см. РОДОХРОЗИТ) (47,8%), олигонит (23-32%), родонит (см. РОДОНИТ) (32-41%). Месторождения по происхождению осадочные (см. ОСАДОЧНЫЕ МЕСТОРОЖДЕНИЯ), реже метаморфогенные (см. МЕТАМОРФОГЕННЫЕ МЕСТОРОЖДЕНИЯ) и выветривания (см. ВЫВЕТРИВАНИЯ МЕСТОРОЖДЕНИЯ) . Общие мировые запасы св. 15,6 млрд. т. Основные запасы марганцевых руд зарубежных стран сосредоточены в ЮАР, Австралии, Бразилии, Габоне.
МАРГАНЦЕВЫЕ РУДЫ. Главные минералы: пиролюзит (63 -2% Mn), псиломелан (45-60%), манганит (62,5%), вернадит (44-52%), браунит (69,5%), гаусманит (72%), родохрозит (47,8%), олигонит (23-32%), родонит (32-41%). Месторождения по происхождению осадочные, реже метаморфогенные и выветривания. Общие мировые запасы св. 15,6 млрд. т. Основные запасы марганцевых руд зарубежных стран сосредоточены в ЮАР, Австралии, Бразилии, Габоне.
МАРГАНЦЕВЫЕ РУДЫ, содержат Mn свыше 10%. Главные минералы: пиролюзит, псиломелан, манганит, вернадит, браунит, гаусманит, родохрозит. Промышленные месторождения - осадочные и в корах выветривания. Мировые запасы свыше 14 млрд. т. Главные добывающие страны: ЮАР, Украина, Австралия, Габон, Бразилия, Индия.
МА́РГАНЦЕВЫЙ и МАРГАНЦОВЫЙ, марганцовая, марганцовое (хим.). прил. к марганец; содержащий в себе марганец. Марганцевая соль. Марганцевая руда.
-ая, -ое.
прил. к марганец.
Марганцевое месторождение.
||
Содержащий марганец.
Марганцевая руда. Марганцевая сталь.
ма́рганцевый (содержащий марганец; относящийся к марганцу); ма́рганцеваяруда́; ма́рганцевое месторожде́ние
ма́рганцевый и марганцо́вый. В знач. «содержащий марганец (металл)» - ма́рганцевый. Ма́рганцевая руда. В знач. «содержащий марганцовку» - марганцо́вый. Марганцо́вый раствор.
ма́рганцевый, ма́рганцевая, ма́рганцевое, ма́рганцевые, ма́рганцевого, ма́рганцевой, ма́рганцевых, ма́рганцевому, ма́рганцевым, ма́рганцевую, ма́рганцевою, ма́рганцевыми, ма́рганцевом, ма́рганцев, ма́рганцева, ма́рганцево, ма́рганцевы, ма́рганцевее, пома́рганцевее, ма́рганцевей, пома́рганцевей
ма́рганцевый
- содержащий марганец; м. блеск - минерал, сернистый марганец; м. шпат - родохрозит - минерал, углекислый марганец; марганцовокислый калий примен. в медицине как обеззараживающее средство.
марганцо́вистый, марганцо́вистая, марганцо́вистое, марганцо́вистые, марганцо́вистого, марганцо́вистой, марганцо́вистых, марганцо́вистому, марганцо́вистым, марганцо́вистую, марганцо́вистою, марганцо́вистыми, марганцо́вистом, марганцо́вист, марганцо́виста, марганцо́висто, марганцо́висты, марганцо́вистее, помарганцо́вистее, марганцо́вистей, помарганцо́вистей
ж. разг.
Кристаллы или раствор марганцовокислого калия, применяющиеся в качестве обеззараживающего средства.
МАРГАНЦО́ВКА, -и, жен. (разг.). Кристаллы марганцовокислой соли, а также раствор этих кристаллов, употребляемый как дезинфицирующее средство.
МАРГАНЦО́ВКА, -и, ж Разг.
Кристаллы марганцовокислого калия или раствор этих кристаллов как дезинфицирующее средство.
Марганцовку разводят из кристаллов марганцовокислой соли, делая раствор слабой или сильной консистенции.
МАРГАНЦО́ВКА -и; ж. Разг. Кристаллы или раствор марганцовокислого калия. Раствор марганцовки. Протереть руки марганцовкой.
марганцо́вка, марганцо́вки, марганцо́вок, марганцо́вке, марганцо́вкам, марганцо́вку, марганцо́вкой, марганцо́вкою, марганцо́вками, марганцо́вках
МАРГАНЦОВОКИ́СЛЫЙ, -ая, -ое: марганцовокислые соли чёрные с зеленоватым отливом кристаллические вещества, растворимые в воде.
МАРГАНЦОВОКИ́СЛЫЙ -ая, -ое.
◊ Марганцовоки́слый калий. Калиевая соль марганцовой кислоты, имеющая вид тёмно-фиолетовых кристаллов.
-ая, -ое.
◊
марганцовокислый калий
калиевая соль марганцовой кислоты, имеющая вид темно-фиолетовых кристаллов.
марганцо́воки́слый, марганцо́воки́слая, марганцо́воки́слое, марганцо́воки́слые, марганцо́воки́слого, марганцо́воки́слой, марганцо́воки́слых, марганцо́воки́слому, марганцо́воки́слым, марганцо́воки́слую, марганцо́воки́слою, марганцо́воки́слыми, марганцо́воки́слом, марганцо́воки́сл, марганцо́воки́сла, марганцо́воки́сло, марганцо́воки́слы, марганцо́воки́слее, помарганцо́воки́слее, марганцо́воки́слей, помарганцо́воки́слей
МАРГАНЦО́ВЫЙ -ая, -ое.
◊ Марганцо́вая кислота. Сильная неорганическая кислота известная лишь в растворах.
ма́рганцевый и марганцо́вый. В знач. «содержащий марганец (металл)» - ма́рганцевый. Ма́рганцевая руда. В знач. «содержащий марганцовку» - марганцо́вый. Марганцо́вый раствор.
марганцо́вый, марганцо́вая, марганцо́вое, марганцо́вые, марганцо́вого, марганцо́вой, марганцо́вых, марганцо́вому, марганцо́вым, марганцо́вую, марганцо́вою, марганцо́выми, марганцо́вом, марганцо́в, марганцо́ва, марганцо́во, марганцо́вы, марганцо́вее, помарганцо́вее, марганцо́вей, помарганцо́вей
марганцовый
- МАРГАНЦЕВЫЙ и МАРГАНЦОВЫЙ - содержащий марганец; марганцевый блеск - минерал, сернистый марганец; марганцевый шпат - минерал, углекислый марганец; марганцовокислый калий применяется в медицине как обеззараживающее средство.