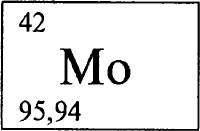Толковый словарь
м.
Химический элемент, твёрдый тугоплавкий металл серебристо-серого цвета, применяемый для производства стали, в электро- и радиотехнике и т.п.
Толковый словарь Ушакова
МОЛИБДЕ́Н [дэ], молибдена, муж. (от греч. molybdos - свинец) (хим.). Химический элемент твердый металл с белым блеском.
Толковый словарь Ожегова
МОЛИБДЕ́Н [дэ ], -а, муж. Химический элемент твёрдый блестящий серебристо-белый металл.
| прил. молибденовый, -ая, -ое.
Словарь существительных
МОЛИБДЕ́Н, -а, м
Химический элемент, твердый тугоплавкий металл с серебристо-белым блеском (применяется в электротехнической промышленности и в виде сплавов в машиностроении).
Благодаря своим свойствам молибден используется для легирования чугунов и сталей как компонент жаропрочных сплавов в авиационной, ракетной и атомной технике, антикоррозийных сплавов в химическом машиностроении.
Энциклопедический словарь
МОЛИБДЕ́Н [дэ́], -а; м. [лат. Molybdaenum] Химический элемент (Mo), твёрдый тугоплавкий металл с серебристо-белым блеском (применяется в электротехнической промышленности и в виде сплавов в машиностроении). Проволока из молибдена.
◁ Молибде́новый, -ая, -ое. М-ые руды. М-ая сталь. М-ая проволока.
* * *
молибде́н (лат. Molybdaenum), химический элемент VI группы периодической системы. Название от греческого mólybdos - свинец (по сходству минералов Mo и Pb). Светло-серый металл, плотность 10,2 г/см3, tпл 2623°C. Химически стоек (на воздухе окисляется при температуре выше 400°C). Главный минерал - молибденит. Более 75% молибдена применяют для легирования чугунов и сталей, используемых в авиа- и автомобилестроении, при изготовлении лопаток турбин и др. Весьма перспективны жаропрочные (для реактивных двигателей) и кислотоупорные (аппараты химической промышленности) сплавы; так, сплав Fe-Ni-Мо стоек ко всем кислотам (кроме HF) до 100°C. Важный конструкционный материал в производстве нитей для электрических ламп и катодов для электровакуумных приборов. Оксиды МоО2, МоО3 - катализаторы нефтехимических и других процессов.
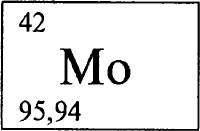
* * *
МОЛИБДЕН - МОЛИБДЕ́Н (лат. Molibdaenum), Mo (читается «молибден»), химический элемент с атомным номером 42, атомная масса 95,94. Природный молибден состоит из семи стабильных изотопов:92Мо (15,86% по массе), 94Мо (9,12%), 95Мо (15,70), 96Мо (16,50%), 97Мо (9,45%), 98Мо (23,75) и 100Мо (9,62% по массе). Конфигурация двух внешних электронных слоев 4s2p6d55s1. Степени окисления от +2 (валентность II) до +6 (VI) - наиболее характерна. Расположен в группе VIВ в 5 периоде периодической системы элементов.
Радиус атома 0,140 нм, радиус иона Mо3+ - 0,083 нм, иона Mо4+ - 0,079 нм, иона Мо5+ - 0,075 нм, иона Мо6+- от 0,055 нм (координационное число 4) до 0,087 (7). Энергии последовательной ионизации 7,10, 16,15, 27,13, 40,53, 55,6 и 71,7 эВ. Работа выхода электрона 4,3 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,8.
История открытия
Открыт в 1778 шведским химиком К. Шееле (см. ШЕЕЛЕ Карл Вильгельм), который прокаливая молибденовую кислоту, получил оксид МоО 3. Восстановив его углем, он получил молибден. Этот металл был загрязнен углем и карбидом молибдена. Чистый молибден в 1817 получил Й. Берцелиус (см. БЕРЦЕЛИУС Йенс Якоб). Название элемента происходит от греч. «молюбдос» - свинец, так как минерал - молибденовый блеск - внешне похож на свинец и его минерал - свинцовый блеск
Нахождение в природе
Содержание в земной коре 3·10 -4 % по массе. В свободном виде молибден не встречается. Известно около 20 минералов молибдена. Важнейшие из них: молибденит (см. МОЛИБДЕНИТ) МоS2, повеллит (см. ПОВЕЛЛИТ) СаМоО4, молибдит Fe(MoO 4)3.nH2O и вульфенит (см. ВУЛЬФЕНИТ) PbMoO4.
Получение
Промышленное получение молибдена начинается с обогащения руд флотационным методом. Полученный концентрат обжигают до образования оксида МоО3:
2МоS2 + 7O2 = 2MoO3 + 4SO2,
который подвергают дополнительной очистке. Далее МоО3 восстанавливают H2. Полученные заготовки обрабатывают давлением (ковка, прокатка, протяжка).
Физические и химические свойства
Молибден - светло-серый металл с кубической объемно центрированной решеткой типа a-Fe, а = 0,314 нм. Температура плавления 2623°C, кипения 4800°C, плотность 10,2 кг/дм3. Парамагнитен. Механические свойства определяются чистотой металла и предшествующей механической и термической обработкой.
При комнатной температуре на воздухе Mo устойчив. Начинает окисляться при 400°C. Выше 600°C быстро окисляется до триоксида МоО3. Этот оксид получают также окислением дисульфида молибдена МоS2 и термолизом молибдата аммония (NH4)6Mo7O24.4H2O.
Мо имеет оксид молибдена (IV) МоО2 и ряд оксидов, промежуточных между МоО3 и МоО2.
С галогенами (см. ГАЛОГЕНЫ) Mo образует ряд соединений в разных степенях окисления. При взаимодействии порошка молибдена или МоО3 с F2 получают гексафторид молибдена МоF6, бесцветную легкокипящую жидкость.
Mo (+4 и +5) образует твердые галогениды МоHal4 и МоHal5 (Hal = F, Cl, Br). С иодом известен только дииодид молибдена MoI2.
Mo образует оксигалогениды: MoOF4, MoOCl4, MoO2F2, MoO2Cl2, MoO2Br2, MoOBr3 и другие.
При нагревании молибдена с серой (см. СЕРА) образуется дисульфид молибдена МоS2, с селеном (см. СЕЛЕН) - диселенид молибдена состава MoSe2. Известны карбиды молибдена Mo2C и MoC - кристаллические высокоплавкие вещества и силицид молибдена МоSi2.
Особая группа соединений молибдена - молибденовые сини (см. МОЛИБДАТЫ). При действии сернистого газа, цинковой пыли, алюминия или других восстановителей на слабокислые (рН 4) суспензии оксида молибдена образуются ярко-синие вещества переменного состава: Мо2О5·Н2О, Мо4О11·Н2О и Мо8О23·8Н2О.
Mo образует молибдаты, соли не выделенных в свободном состоянии слабых молибденовых кислот, хН2О·уМоО3 (парамолибдат аммония 3(NH4)2O·7MoO3·zH2O; СаМоО4, Fe2(МоО4)3 - встречаются в природе). Молибдаты металлов I и III групп содержат тетраэдрические группировки [МоО4].
При подкислении водных растворов нормальных молибдатов образуются ионы MoO3OH-, затем ионы полимолибдатов: гепта-, (пара-) Мо7О266-, тетра-(мета-) Мо4О132-, окта- Мо8О26 4- и другие. Безводные полимолибдаты синтезируют спеканием МоО3 с оксидами металлов.
Существуют двойные молибдаты, в состав которых входят сразу два катиона, например, М+1М+3(МоО4)2, М+15М+3(МоО4)4. Оксидные соединения, содержащие молибден в низших степенях окисления - молибденовые бронзы, например, красная K0,26MoO3 и синяя К0,28МоО3. Эти соединения обладают металлической проводимостью и полупроводниковыми свойствами.
Применение
Молибден используется для легирования сталей, как компонент жаропрочных и коррозионно стойких сплавов. Молибденовая проволока (лента) служит для изготовления нагревателей для высокотемпературных печей, вводов электрического тока в лампочках. Соединения молибдена - сульфид, оксиды, молибдаты - являются катализаторами химических реакций, пигментами красителей, компонентами глазурей. Гексафторид молибдена применяется при нанесении металлического Mo на различные материалы МоSi2 используется как твердая высокотемпературная смазка. Mo входит в состав микроудобрений. Радиоактивные изотопы 93Mo (T1/2 6,95 ч) и 99Mo (T1/2 66 ч) - изотопные индикаторы.
Физиологическое значение
Микроколичества Mo необходимы для нормального развития растений.
Большой энциклопедический словарь
МОЛИБДЕН (лат. Molybdaenum) - Мо, химический элемент VI группы периодической системы, атомный номер 42, атомная масса 95,94. Название от греческого molybdos - свинец (по сходству минералов Мо и Рb). Светло-серый металл, плотность 10,2 г/см³, tпл 2623 .С. Химически стоек (на воздухе окисляется при температуре выше 400 .С). Главный минерал - молибденит. Более 75% молибдена применяют для легирования чугунов и сталей, используемых в авиа- и автомобилестроении, при изготовлении лопаток турбин и др. Весьма перспективны жаропрочные (для реактивных двигателей) и кислотоупорные (аппараты химической промышленности) сплавы; так, сплав Fe-Ni-Mo стоек ко всем кислотам (кроме HF) до 100 .С. Важный конструкционный материал в производстве нитей для электрических ламп и катодов для электровакуумных приборов. Оксиды МоО2, МоО3 - катализаторы нефтехимических и др. процессов.
Академический словарь
-а, м.
Химический элемент, твердый металл с серебристо-белым блеском.
[От греч. μόλυβδος - свинец]
Энциклопедия Кольера
Mo (molibdenium),
металл, член семейства хрома (Cr, Mo, W) - IVB подгруппы периодической системы элементов. Молибден в 1778 был открыт в виде оксида шведским химиком К.Шееле, который и дал ему название, происходящее от греческого слова "молибдос", означающего "свинец" (из-за внешнего сходства минерала свинцовый блеск с молибденитом, из которого Шееле удалось выделить оксид молибдена действием азотной кислоты). В металлическом состоянии, но с примесями впервые его получил П. Гьельм в 1782. Распространенность в природе и получение. Молибден встречается в природе только в виде соединений и не имеет широкого распространения. Наиболее важной рудой является молибденит (MoS2, молибденовый блеск), обширные месторождения которого обнаружены в шт. Колорадо (США). Другими менее важными рудами являются повеллит CaMoO4 и вульфенит PbMoO4. Для получения металла первоначально проводят обжиг молибденита, превращая его в оксид, последний восстанавливают углеродом в электрических печах до металла. Если необходима более высокая чистота металла, оксид восстанавливают алюминием или водородом. СВОЙСТВА МОЛИБДЕНА
Атомный номер 42 Атомная масса 95,94 Изотопы
стабильные 92, 94-98, 100
нестабильные 91, 93, 99, 101, 102, 105
Температура плавления, ° С 2610 Температура кипения, ° С 5560 Плотность, г/см3 10,2 Твердость (по Моосу) 5,5-8,5 Содержание в земной коре, % (масс.) 0,0015 Степени окисления +2, +3, +4, +5, +6
Свойства. Это серебристо-белый, ковкий и пластичный металл. Наличие примесей увеличивает твердость и хрупкость металла. При комнатной температуре молибден не окисляется кислородом воздуха, не реагирует с водой и хлором. Он начинает окисляться при 600° C, а при более высоких температурах реагирует с углеродом, серой и фосфором, образуя карбиды, сульфиды и фосфиды соответственно. Молибден не реагирует с соляной и разбавленной серной кислотами, но хорошо растворим в азотной или горячей серной кислотах.
Соединения. Наиболее устойчивы соединения молибдена в высшей степени окисления. Для молибдена типичны соединения с галогенами и кислородом, например, MoCl2, MoCl3 , MoCl4, MoCl5, Mo2O3, MoO2, Mo2O5, MoO3 и молибдаты металлов типа Na2MoO4. Растворы солей Mo имеют обычно оливково-зеленый цвет.
Оксиды. Известно несколько оксидов молибдена. Оксид молибдена(III) Mo2O3 - черный, твердый, получают его прокаливанием Mo(OH)3 или Mo2O3*3H2O; оксид молибдена(V) Mo2O5 образуется разложением MoO(OH)3 или Mo2O5*3H2O; оксид молибдена(IV) MoO2 получают прокаливанием Mo2O3 на воздухе, а также восстановлением MoO3 водородом или углеродом; оксид молибдена(VI) MoO3, желтовато-белый порошок, образующийся при прокаливании молибденита, плохо растворяется в воде (1:500), давая раствор со слабокислой реакцией.
Молибдаты. Молибдаты типа Na2MoO4 получают спеканием MoO3 с карбонатом или оксидом соответствующего металла. В растворе соли, как правило, нестабильны и образуют полимолибдаты усложненного состава, который зависит от кислотности среды. В щелочных растворах, например, существует ион MoO42-, в умереннокислых - (Mo3O11)4-, а в сильнокислом растворе возможно образование (Mo12O41)10- и (Mo24O78)12-.
Применение. Около 90% добываемого молибдена используется для производства ферросплавов. Инструментальная сталь содержит до 6% Mo, хромовые и никелевые стали - 0,1-0,5%; обычно добавляют немного молибдена в виде оксида, молибдата кальция или ферромолибдена. В целом добавки молибдена придают сталям твердость и прочность (хотя и усиливают ломкость некоторых сталей после закалки) и увеличивают их коррозионную стойкость. Введение молибдена увеличивает прочность на разрыв и улучшает другие свойства, например высокотемпературную прочность, сопротивление скалыванию. Поэтому из молибденовых сплавов изготовляют режущий инструмент и сверла, арматуру, трубы, заводские емкости, работающие с перегретым паром, автомобильные распределительные валы и клапаны. Некоторые молибденовые соединения используются в качестве микроудобрений, красителей кожи и текстиля, пигментов для керамики, применяются в производстве синтетических каучуков, специальных смазок и катализаторов промышленных процессов.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Зеликман А.Н. Молибден. М., 1970 Порай-Кошиц М.А., Атовмян Л.О. Кристаллохимия и стереохимия координационных соединений молибдена. М., 1974
Иллюстрированный энциклопедический словарь
МОЛИБДЕН (латинское Molybdaenum), Mo, химический элемент VI группы периодической системы, атомный номер 42, атомная масса 95,94; металл, tпл 2623 °C. Молибден используют для легирования сталей, как компонент жаропрочных сплавов в авиационной, ракетной и атомной технике, антикоррозионных сплавов в химическом машиностроении. Из молибдена изготовляют различные детали в электротехнике, нагреватели для высокотемпературных печей. Открыт шведским химиком К. Шееле в 1778, чистый металл получен шведским ученым Й. Берцелиусом в 1817.
Практический толковый словарь
мед. молибден (molybdenum)
Микроэлемент.
- Способствует метаболизму жиров и углеводов.
- Жизненно важен для усвоения железа.
- Участвует в производстве мочевой кислоты.
см. тж микроэлементы
Орфографический словарь
Словарь ударений
Трудности произношения и ударения
молибде́н. Произносится [молибдэ́н].
Формы слов для слова молибден
молибде́н, молибде́ны, молибде́на, молибде́нов, молибде́ну, молибде́нам, молибде́ном, молибде́нами, молибде́не, молибде́нах
Синонимы к слову молибден
сущ., кол-во синонимов: 2
Морфемно-орфографический словарь
Грамматический словарь
Словарь галлицизмов русского языка
МОЛИБДЕН а, м. molybdène m. < гр. molybdos свинец. Твердый тугоплавкий металл с серебристо-белым блеском, широко применяемый в электро и радиотехнике. БАС-1. Молибде/новый ая, ое. Крысин 1998. - Лекс. САН 1847: молибде/на; Уш. 1938: молибде/н.
Словарь иностранных слов
МОЛИБДЕН (греч. molibdaine, от molybdos - свинец). Беловатый металл, встречающийся в молибдените, в соединении с серою.
Сканворды для слова молибден
- Химический элемент, металл.
- Металл для легирования сталей.
- Химический элемент, Mo.
- Присутствие этого элемента обозначает буква М в названии марки легированной стали.
- В качестве смазки, работающей при высокой температуре, часто используют дисульфид этого металла шестой группы таблицы Менделеева.
- Его название переводится с греческого как «свинец», и именно он как выяснилось придавал прочность мечам японских самураев и был впервые получен в 1778 году шведским химиком Шееле.
Полезные сервисы