м.
Химический элемент; мягкий, ковкий, серебристо-белый металл, применяемый для пайки, лужения, приготовления сплавов и т.п.
м.
Химический элемент; мягкий, ковкий, серебристо-белый металл, применяемый для пайки, лужения, приготовления сплавов и т.п.
О́ЛОВО, -а, ср. Химический элемент, мягкий ковкий серебристо-белый металл.
| прил. оловянный, -ая, -ое. О. солдатик (игрушечная фигурка солдата).
ОЛОВО - ср. крушец (металл) пепельно-серебристый, белее свинца, весьма мягкий, легкоплавкий, легкий весом, более прочих удобный для паянья и для отливки простых мелких вешиц;
| ·стар. свинец, откуда пословица: Слово олово, веско. Лить олово, святочное гаданье. Только у молодца и золотца, что пуговка оловца! Оловянная кружка или оловянка жен. и оловяник муж. Оловянная руда, - колчедан, - припой. Оловяничник, оловянщик муж. отливающий, работающий оловянную посуду. Оловолей, оловолитель муж., церк. оловогадатель, отливающий олово в воду, для гаданья, предсказаний. Оловянные глаза, мутные и бездушные; оловянный глаз, с бельмом. Оловок муж., зап. карандаш.
О́ЛОВО, -а, ср
Химический элемент, серебристо-белый мягкий ковкий металл.
При обычных условиях олово весьма устойчиво к химическим воздействиям, благодаря чему оно широко употребляется для защиты покрытий (консервных банок, посуды и проч.).
О́ЛОВО -а; ср. Химический элемент (Sn), мягкий ковкий серебристо-белый металл (применяется для пайки, лужения, приготовления сплавов и т.п.).
* * *
о́лово (лат. Stannum), Sn, химический элемент IV группы периодической системы. Серебристо-белый металл, мягкий и пластичный; tпл 231,9°C. Полиморфно; так называемое белое олово (или β-Sn) с плотностью 7,28 г/см3 ниже 13,2°C переходит в серое олово (α-Sn) с плотностью 5,75 г/см3. На воздухе тускнеет, покрываясь плёнкой оксида, стойкой к химическим реагентам. Главные промышленные минералы - касситерит и станнин. Олово - компонент многих сплавов, например, подшипниковых (баббитов), типографских (гарт). Идёт на покрытие других металлов для защиты их от коррозии (лужение), на изготовление белой жести для консервных банок.
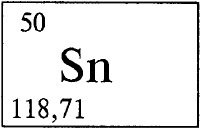
* * *
ОЛОВО - О́ЛОВО (лат. Stannum), Sn, химический элемент с атомным номером 50, атомная масса 118,710). Латинское «stannum» первоначально означало сплав серебра и свинца. «Оловом» в ряде славянских языков называли свинец. Химический символ олова Sn читается «станнум». Природное олово состоит из девяти стабильных нуклидов (см. НУКЛИД) с массовыми числами 112 (в смеси 0,96% по массе), 114 (0,66%), 115 (0,35%), 116 (14,30%), 117 (7,61%), 118 (24,03%), 119 (8,58%), 120 (32,85%), 122 (4,72%), и одного слабо радиоактивного олова-124 (5,94%). 124Sn - бета-излучатель, его период полураспада очень велик и составляет T1/2 = 1016-1017 лет. Олово расположено в пятом периоде в IVА группе периодической системы элементов Д. И. Менделеева. Конфигурация внешнего электронного слоя 5s25p2. В своих соединениях олово проявляет степени окисления +2 и +4 (соответственно валентности II и IV).
Металлический радиус нейтрального атома олова 0,158 нм, радиусы иона Sn2+ 0,118 нм и иона Sn4+ 0,069 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома олова равны 7,344 эВ, 14,632, 30,502, 40,73 и 721,3 эВ. По шкале Полинга электроотрицательность олова 1,96, то есть олово находится на условной границе между металлами и неметаллами.
История открытия
Когда человек впервые познакомился с оловом точно сказать нельзя. Олово и его сплавы известны человечеству с древнейших времен. Упоминание об олове есть в ранних книгах Ветхого Завета. Сплавы олова с медью, так называемые оловянные бронзы (см. БРОНЗА), по-видимому, стали использоваться более чем за 4000 лет до нашей эры. А с самим металлическим оловом человек познакомился значительно позже, примерно около 800 года до нашей эры. Из чистого олова в древности изготовляли посуду и украшения, очень широко применяли изделия из бронзы.
Нахождение в природе
Олово - редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Содержание олова в земной коре составляет, по разным данным, от 2·10-4 до 8·10-3% по массе. Основной минерал олова - касситерит (см. КАССИТЕРИТ) (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (см. СТАННИН) (оловянный колчедан) - Cu2FeSnS4 (27,5 % Sn).
Получение
Для добычи олова в настоящее время используют руды, в которых его содержание равно или немного выше 0,1%. На первом этапе руду обогащают (методом гравитационной флотации или магнитной сепарации). Таким образом удается повысить содержание олова в руде до 40-70%. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Затем полученный таким образом оксид SnO2 восстанавливают углем или алюминием (цинком) в электропечах:
SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Физические и химические свойства
Простое вещество олово полиморфно. В обычных условиях оно существует в виде бета-модификации (белое олово), устойчивой выше 13,2°C. Белое олово - это серебристо-белый, мягкий, пластичный металл, обладающий тетрагональной элементарной ячейкой, параметры a=0.5831, c=0.3181 нм. Координационное окружение каждого атома олова в нем - октаэдр. Плотность бета-Sn 7,29 г/см3 . Температура плавления 231,9°C, температура кипения 2270°C.
При охлаждении, например, при морозе на улице, белое олово переходит в альфа-модификацию (серое олово). Серое олово имеет структуру алмаза (кубическая кристаллическая решетка с параметром а = 0,6491 нм). В сером олове координационный полиэдр каждого атома - тетраэдр, координационное число 4. Фазовый переход бета-Sn ® альфа-Sn сопровождается увеличением удельного объема на 25,6%, что приводит к рассыпанию олова в порошок. В старые времена наблюдавшееся во время сильных холодов рассыпание оловянных изделий называли «оловянной чумой». В результате этой «чумы» пуговицы на обмундировании солдат, их пряжки, кружки, ложки рассыпались, и армия могла потерять боеспособность.
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, бета-Sn - металл, а альфа-Sn относится к числу полупроводников (см. ПОЛУПРОВОДНИКИ). Ниже 3,72 К альфа-Sn переходит в сверхпроводящее состояние. Стандартный электродный потенциал E°Sn2+/Sn равен -0.136 В, а E пары °Sn4+/Sn2+ 0.151 В. При комнатной температуре олово, подобно соседу по группе германию, (см. ГЕРМАНИЙ) устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C:
Sn + O2 = SnO2.
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
Sn + 2Cl2 = SnCl4
С концентрированной соляной кислотой олово медленно реагирует:
Sn + 4HCl = SnCl4 + H2
Возможно также образование хлороловянных кислот составов HSnCl3, H2SnCl4 и других, например:
Sn + 3HCl = HSnCl3 + 2H2
В разбавленной серной кислоте олово не растворяется, а с концентрированной реагирует очень медленно. Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте образуется оловянная кислота b-SnO2·nH2O (иногда ее формулу записывают как H2SnO3). При этом олово ведет себя как неметалл:
Sn + 4HNO3 конц. = b-SnO2·H2OЇ + 4NO2 + H2O
При взаимодействии с разбавленной азотной кислотой олово проявляет свойства металла. В результате реакции образуется соль нитрат олова(II):
3Sn + 8HNO3 разб. = 3Sn(NO3)2 + 2NO + 4H2O.
При нагревании олово, подобно свинцу, может реагировать с водными растворами щелочей. При этом выделяется водород и образуется гидроксокомплекс Sn(II), например:
Sn + 2KOH +2H2O = K2[Sn(OH)4] + H2
Гидрид олова - станнан SnH4 - можно получить по реакции:
SnCl4 + Li[AlH4] = SnH4 + LiCl + AlCl3.
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0°C. Олову отвечают два оксида SnO2 (образующийся при обезвоживании оловянных кислот) и SnO. Последний можно получить при слабом нагревании гидроксида олова(II) Sn(OH)2 в вакууме:
Sn(OH)2 = SnO + H2O
При сильном нагреве оксид олова(II) диспропорционирует:
2SnO = Sn + SnO2
При хранении на воздухе монооксид SnO постепенно окисляется:
2SnO + O2 = 2SnO2.
При гидролизе растворов солей олова(IV) образуется белый осадок - так называемая альфа-оловянная кислота:
SnCl4 + 4NH3 + 6H2O = H2[Sn(OH)6] + 4NH4Cl.
H2[Sn(OH)6] = -SnO2·nH2OЇ + 3H2O.
Свежеполученная альфа-оловянная кислота растворяется в кислотах и щелочах:
a-SnO2·nH2O + KOH = K2[Sn(OH)6],
a-SnO2·nH2O + HNO3 = Sn(NO3)4 + H2O.
При хранении альфа-оловянная кислота стареет, теряет воду и переходит в бета-оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HO-Sn группировок при стоянии и замене их на более инертные мостиковые -Sn-O-Sn- связи. При действии на раствор соли Sn(II) растворами сульфидов выпадает осадок сульфида олова(II):
Sn2+ + S2- = SnS
Этот сульфид может быть легко окислен до SnS2 раствором полисульфида аммония:
SnS + (NH4)2S2 = SnS2 + (NH4)2S
Образующийся дисульфид SnS2 растворяется в растворе сульфида аммония (NH4)2S:
SnS2 + (NH4)2S = (NH4)2SnS3. Четырехвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и других.
Применение
Важное применение олова - лужение железа и получение белой жести, которая используется в консервной промышленности. Для этих целей расходуется около 33% всего добываемого олова. До 60% производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит (см. БАББИТЫ)), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев (см. ПРИПОЙ). Олово способно прокатываться в тонкую фольгу - станиоль (см. СТАНИОЛЬ), такая фольга находит применение при производстве конденсаторов, органных труб, посуды, художественных изделий. Олово применяют для нанесения защитных покрытий на железо и другие металлы, а также на металлические изделия (лужение). Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («сусальное золото»). Искусственный радионуклид олова 119Sn - источник гамма-излучения в мессбауэровской спектроскопии.
Физиологическое действие
О роли олова в живых организмах практически ничего не известно. В теле человека содержится примерно (1-2)· 10-4% олова, а его ежедневное поступление с пищей составляет 0,2-3,5 мг. Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз - поражение легких. Очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3, ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках - 100 мг/кг. Токсическая доза олова для человека - 2 г.
ОЛОВО (лат. Stannum) - Sn, химический элемент IV группы периодической системы, атомный номер 50, атомная масса 118,710. Серебристо-белый металл, мягкий и пластичный; tпл 231,91 .С. Полиморфно; т. н. белое олово (или ?-Sn) с плотностью 7,228 г/см³ ниже 13,2 .С переходит в серое олово (?-Sn) с плотностью 5,75 г/см³. На воздухе тускнеет, покрываясь пленкой оксида, стойкой к химическим реагентам. Главные промышленные минералы - касситерит и станнин. Олово - компонент многих сплавов, напр. подшипниковых (баббитов), типографских (гарт). Идет на покрытие других металлов для защиты их от коррозии (лужение), на изготовление белой жести для консервных банок.
Sn (от лат. stannum, что первоначально относилось к сплаву свинца и серебра, а позднее к другому, имитирующему его сплаву, содержащему около 67% Sn; к 4 в. этим словом стали называть олово),
химический элемент IVB подгруппы (включающей C, Si, Ge, Sn и Pb) периодической системы элементов. Олово - относительно мягкий металл, используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова - в белой жести (луженое железо) для изготовления тары, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Олово образует различные соединения, многие из которых находят промышленное применение. Наиболее экономически важный оловосодержащий минерал - касситерит (оксид олова). Мировые месторождения касситерита разрабатывают в Юго-Восточной Азии, в основном в Индонезии, Малайзии и Таиланде. Другие важные месторождения касситерита находятся в Южной Америке (Бразилия и Боливия), Китае и Австралии.
См. также ОЛОВА ПРОИЗВОДСТВО.
Историческая справка. Олово начали применять, вероятно, еще во времена Гомера и Моисея. Открытие его было связано, скорее всего, со случайным восстановлением наносного касситерита (оловянного камня); наносные отложения встречаются на поверхности или близко к ней, и оловянные руды намного легче восстанавливаются, чем руды других металлов. Древние бритты были хорошо знакомы с оловом: в Корнуолле на юго-западе Англии были обнаружены древние горны со шлаком. Металл был, очевидно, малодоступен и дорог, т.к. оловянные предметы редко встречаются среди римских и греческих древностей, хотя об олове говорится в Библии в Четвертой книге Моисеевой (Числа), а слово касситерит, которое и сегодня используется для обозначения оксидной оловянной руды, - греческого происхождения. Малакка и Восточная Индия упоминаются как источники олова в арабской литературе 8-9 вв. и различными авторами в 16 в. в связи с Великими географическими открытиями. История оловянных разработок в Саксонии и Богемии относится еще к 12 в., но в 17 в. 30-летняя война (1618-1648) разрушила эту промышленность. Производство впоследствии возобновили, но вскоре оно пришло в упадок из-за открытия богатых месторождений в Америке.
Бронза. Задолго до того как научились добывать олово в чистом виде, был известен сплав олова с медью - бронза, который получали, видимо, уже в 2500-2000 до н.э. Олово в рудах часто встречается вместе с медью, так что при плавке меди в Британии, Богемии, Китае и на юге Испании образовывалась не чистая медь, а ее сплав с некоторым количеством олова. Ранние медные плотничные инструменты (долото, тесло и др.) из Ирландии содержали до 1% Sn. В Египте медная утварь 12-й династии (2000 до н.э.) содержала до 2% Sn, по-видимому, как случайную примесь. Первобытная практика выплавки меди основывалась на использовании смеси медных и оловянных руд, в результате чего и получалась бронза, содержащая до 22% Sn. СВОЙСТВА b -ОЛОВА Атомный номер 50 Атомная масса 118,710 Изотопы
стабильные 112, 114-120, 122, 124
нестабильные 108-111, 113, 121, 123, 125-127
Температура плавления, ° С 231,9 Температура кипения, ° С 2625 Плотность, г/см3 7,29 Твердость (по Бринеллю) 3,9 Содержание в земной коре, % (масс.) 0,0004 Степени окисления +2, +4
Физические свойства. Олово - мягкий серебристо-белый пластичный металл (может быть прокатан в очень тонкую фольгу - станиоль) с невысокой температурой плавления (легко выплавляется из руд), но высокой температурой кипения. Олово имеет две аллотропные модификации: a-Sn (серое олово) с гранецентрированной кубической кристаллической решеткой и b-Sn (обычное белое олово) с объемноцентрированной тетрагональной кристаллической решеткой. Фазовый переход b -> a ускоряется при низких температурах (-30° С) и в присутствии зародышей кристаллов серого олова; известны случаи, когда оловянные изделия на морозе рассыпались в серый порошок ("оловянная чума"), но это превращение даже при очень низких температурах резко тормозится наличием мельчайших примесей и поэтому редко встречается, представляя скорее научный, чем практический интерес. См. также
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ. Чистое олово обладает низкой механической прочностью при комнатной температуре (можно согнуть оловянную палочку, при этом слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется. Однако оно легко образует сплавы с большинством других черных и цветных металлов. Оловосодержащие сплавы обладают прекрасными антифрикционными свойствами в присутствии смазки, поэтому широко используются как материал подшипников.
Химические свойства. При комнатной температуре олово химически инертно к кислороду и воде. На воздухе олово постепенно покрывается защитной оксидной пленкой, которая повышает его коррозионную стойкость. С химической инертностью олова и его оксидной пленки в обычных условиях связано использование его в покрытии жестяной тары для продуктов питания, прежде всего - консервных банок. Олово легко наносится на сталь и продукты его коррозии безвредны. В соединениях олово проявляет две степени окисления: +2 и +4, причем соединения олова(II) в большинстве своем относительно нестабильны в разбавленных водных растворах и окисляются до соединений олова(IV) (их используют иногда как восстановители, например SnCl2). Разбавленные соляная и серная кислоты действуют на олово очень медленно, а концентрированные, особенно при нагревании, растворяют его, причем в соляной кислоте получается хлорид олова(II), а в серной - сульфат олова(IV). С азотной кислотой олово реагирует тем интенсивнее, чем выше концентрация и температура: в разбавленной HNO3 образуется растворимый нитрат олова(II), а в концентрированной HNO3 - нерастворимая b-оловянная кислота H2SnO3. Концентрированные щелочи растворяют олово с образованием станнитов - солей оловянистой кислоты H2SnO2; в растворах станниты существуют в гидроксоформе, например Na2[[Sn(OH)4]]. Наибольшее промышленное значение соединения олова(II) имеют в производстве гальванических покрытий. Соединения олова(IV) находят обширное промышленное применение. Оксиды олова амфотерны, проявляют и кислотные, и основные свойства. Оксид олова(IV) встречается в природе в виде минерала касситерита, а чистый SnO2 получают из чистого металла; диоксид олова SnO2 применяется для приготовления белых глазурей и эмалей. Из SnO2 при взаимодействии со щелочами получают станнаты - соли оловянной кислоты, наиболее важные из которых - станнаты калия и натрия; растворы станнатов находят широкое применение как электролиты для осаждения олова и его сплавов. SnCl4 - тетрахлорид олова, исходное соединение для многих синтезов других соединений олова, включая и оловоорганические.
Применение. В современном мире более трети добываемого олова расходуется на изготовление пищевой жести и емкостей для напитков. Жесть в основном состоит из стали, но имеет покрытие из олова обычно толщиной менее 0,4 мкм.
Сплавы. Одна треть олова идет на изготовление припоев. Припои - это сплавы олова в основном со свинцом в разных пропорциях в зависимости от назначения. Сплав, содержащий 62% Sn и 38% Pb, называется эвтектическим и имеет самую низкую температуру плавления среди сплавов системы Sn - Pb. Он входит в составы, используемые в электронике и электротехнике. Другие свинцово-оловянные сплавы, например 30% Sn + 70% Pb, имеющие широкую область затвердевания, используются для пайки трубопроводов и как присадочный материал. Применяются и оловянные припои без свинца. Сплавы олова с сурьмой и медью используются как антифрикционные сплавы (баббиты, бронзы) в технологии подшипников для различных механизмов. Современные оловянно-свинцовые сплавы содержат 90-97% Sn и небольшие добавки меди и сурьмы для увеличения твердости и прочности. В отличие от ранних и средневековых свинецсодержащих сплавов, современная посуда из cплавов олова безопасна для использования.
Покрытия из олова и его сплавов. Олово легко образует сплавы со многими металлами. Оловянные покрытия имеют хорошее сцепление с основой, обеспечивают хорошую коррозионную защиту и красивый внешний вид. Оловянные и оловянно-свинцовые покрытия можно наносить, погружая специально приготовленный предмет в ванну с расплавом, однако большинство оловянных покрытий и сплавов олова со свинцом, медью, никелем, цинком и кобальтом осаждают электролитически из водных растворов. Наличие большого диапазона составов для покрытий из олова и его сплавов позволяет решать многообразные задачи промышленного и декоративного характера.
Соединения. Олово образует различные химические соединения, многие из которых находят важное промышленное применение. Кроме многочисленных неорганических соединений, атом олова способен к образованию химической связи с углеродом, что позволяет получать металлоорганические соединения, известные как оловоорганические
(см. также МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ).
Водные растворы хлоридов, сульфатов и фтороборатов олова служат электролитами для осаждения олова и его сплавов. Оксид олова применяют в составе глазури для керамики; он придает глазури непрозрачность и служит красящим пигментом. Оксид олова можно также осаждать из растворов в виде тонкой пленки на различных изделиях, что придает прочность стеклянным изделиям (или уменьшает вес сосудов, сохраняя их прочность). Введение станната цинка и других производных олова в пластические и синтетические материалы уменьшает их возгораемость и препятствует образованию токсичного дыма, и эта область применения становится важнейшей для соединений олова. Огромное количество оловоорганических соединений расходуется в качестве стабилизаторов поливинилхлорида - вещества, используемого для изготовления тары, трубопроводов, прозрачного кровельного материала, оконных рам, водостоков и др. Другие оловоорганические соединения используются как сельскохозяйственные химикаты, для изготовления красок и консервации древесины.
ЛИТЕРАТУРА
Спиваковский В.Б. Аналитическая химия олова. М., 1975 Большаков К.А., Федоров П.И. Химия и технология малых металлов. М., 1984
ОЛОВ|О (35), -А с.
1.Свинец:
сы вълкъ… нын˫а овьча… сы олово нын˫а злато сътворенъ. СбТр XII/XIII, 187 об.; по семь въвьржена бы(с) въ конобъ мѣдѧнъ. исполненъ олова и смолы. ПрЛ 1282, 18б; и подъкѹриша ю пькломь и сѣрою и ѡловомь. Пр 1313, 6б; Маѯентии и сѹщии с нимь погрѧзоша ˫ако ѡлово въ водѣ зѣло (μόλυβδος) ГА XIV1, 204в; бьѥнъ бы(с) злѣ и съвѣщами пожьженъ и въ врѧще оловово. [так!] въверьженъ бы(с). Пр 1383, 126г; Пакы же каме(н) оловѧ(н) гл҃тьсѧ х(с)ъ. рекоша бо олово. ѿ мѣди и олова е(с)ство има(т). (τὸ κασσίτερον… μολίβδου) ГБ к. XIV, 84г; злато ˫а||ко олово видить. (μόλυβδος) ФСт XIV/XV, 36-37; оковавше раку иосифлю оловомъ отаи и въвергоша и в море. Пал 1406, 124г.
2. Олово:
ѧзо ти олово попродале и свинеце и клепание вохо. ГрБ № 439, XII/XIII; воложи олова со цетыри безмене. Там же; а в ризѣ рускому купцѣви ѿ вѣса дати ѥму ѿ бѣрковьска полъ оврѧ. ѿ воску. ѿ мѣди. ѿ олова. ѿ хмѣлю. Гр 1338-1341 (полоцк.); ѡбновл(е)на бы(с) цр҃кы ст҃а˫а Б҃ца… и покрыта бы(с) ѡловомъ ѿ верху до комаръ. и до притворовъ. ЛЛ 1377, 139 об. (1194); помостъ бѣ слитъ ѿ мѣди. и ѿ ѡлова ч(с)та ˫ако блещатисѧ ˫ако зерчалѹ. ЛИ ок. 1425, 281 об. (1259).
Лить олово. Кар., Новг. Гадать, пытаться предсказать судьбу с помощью расплавленного олова. СРГК 3, 131; НОС 6, 166.
Общеславянское слово, восходящее к той же основе, что и латинское albus - "белый". Металл назван по своему цвету.
Общеслав. Того же корня, что лит. álvas «цинк», прус. alwis и проч. Суф. производное от той же основы, что лат. albus «белый», греч. alphas - тж. Металл назван по цвету.
о́лово
оловя́нный, прилаг., укр. о́лово "свинец", блр. во́лово, др.-русск., ст.-слав. олово μόλυβδος (Супр.), болг. оло́во, сербохорв. о̏лово, о̏д олова, словен. оlо̑v, ólovo (Долобко, ZfslPh 3, 131), чеш., слвц. оlоvо, польск. oɫów, в.-луж. wоɫоj, н.-луж. wóɫoj.
Родственно лит. álvas "свинец" (Даукша), лтш. аl̂vа, al̂vs "олово", др.-прусск. alwis "свинец" (но лит., вост., ãlavas заимств. из слав.; см. Буга, ИОРЯС 17, 1, 4). Далее сближают с названиями цветов: д.-в.-н. ёlо "желтый", лат. albus "белый", греч. ἀλφός; см. Траутман, ВSW 7; М.-Э. 1, 69; Фортунатов, AfslPh 4, 580; Перссон 300; Уленбек, РВВ 22, 536 и сл.; Лиден, Stud. 94. Весьма сомнительна мысль о заимствовании из того же источника, откуда греч. μόλυβδος "свинец", родосск. βόλιμος, вопреки Микколе (Ваlt. u. Slav. 41); см. Лиден, там же. Греч. слова вместе с лат. plumbum возводятся к средиземноморскому слову; см. Буазак 644; Сольмсен, Beitr. I, 59 и сл.; Гофман, Gr. Wb. 205.
- Плоть игрушечной армии.
- Материал для стойких солдатиков.
- Химический элемент, металл.
- Металл, болеющий чумой.
- Металл, ставший причиной гибели экспедиции Роберта Скотта на Южный полюс.
- Серебристая капелька на паяльнике.
- Металл для лудильщика.
- Из какого металла делают «белую жесть»?
- Металл-припой.
- Металл, который в избытке можно добыть с поверхности консервных банок.
- Химический элемент, Sn.
- Металл для лужения.
- Смесь солей этого металла - «жёлтая композиция» - издавна использовалась как краситель для шерсти.
- Латинское название этого металла переводится, как «твёрдый», хотя он один из самых мягких и легкоплавких.
- Переведите с латинского слово «станнум».
- Полуда.
- Основа станиоли.
- Мягкий металл колец Альманзора.
Оловооргани́ческие соедине́ния - содержат в молекуле атом олова, непосредственно связанный с углеродом. Известны оловоорганические соединения типа R4Sn, R3SnX, R2SnX2, RSnX3, где R - органический радикал, X - галоген, Н, OR и др. оловоорганические соединения - стабилизаторы поливинилхлорида, катализаторы в производстве полиуретанов, пестициды.
* * *
ОЛОВООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ - ОЛОВООРГАНИ́ЧЕСКИЕ СОЕДИНЕ́НИЯ, содержат в молекуле атом олова, непосредственно связанный с углеродом. Известны оловоорганические соединения типа R4Sn, R3SnX, R2SnX2, RSnX3, где R - органический радикал, X - галоген, H, OR и др. Оловоорганические соединения - стабилизаторы поливинилхлорида, катализаторы в производстве полиуретанов, пестициды.
ОЛОВООРГАНИЧЕСКИЕ соединения - содержат в молекуле атом олова, непосредственно связанный с углеродом. Известны оловоорганические соединения типа R4Sn, R3SnX, R2SnX2, RSnX3, где R - органический радикал, X - галоген, H, OR и др. Оловоорганические соединения - стабилизаторы поливинилхлорида, катализаторы в производстве полиуретанов, пестициды.