АТОМНАЯ БОМБА, смотри в статье Ядерное оружие.
атомная группировка
атомная единица массы
Энциклопедический словарь
А́томная едини́ца ма́ссы (а. е. м.), единица массы, применяемая для выражения масс микрочастиц. За 1 а. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (так называемая углеродная шкала). 1 а. е. м. = 1,6605655(86)·10-27кг.
* * *
АТОМНАЯ ЕДИНИЦА МАССЫ - А́ТОМНАЯ ЕДИНИ́ЦА МА́ССЫ (а. е. м.), единица массы, применяемая для выражения масс микрочастиц (см. МИКРОЧАСТИЦЫ). За 1 а.е.м. принята 1/12 часть массы наиболее распространенного и легкого изотопа углерода 12С с массовым числом 12 (т. н. углеродная шкала). 1 а.е.м. = 1,6605655(86)·10-27 кг.
Для перевода значений масс m частиц, выраженных в а.е.м., в единицу массы СИ (кг) пользуются формулой:
m (кг) = m (к а.е.м.)/NA, где m (к а.е.м.) - масса частицы в килоатомных единицах, NA - постоянная Авогадро (см. АВОГАДРО ПОСТОЯННАЯ).
Так как 1 а.е.м. является величиной, обратно пропорциональной числу Авогадро, то есть 1/NA г, то молярная масса данного элемента, выраженная в граммах на моль, в точности совпадает с массой атома этого элемента, выраженной в а. е. м.
Для измерения массы атомов и молекул до 1961 года в химии применялась а. е. м., равная 1/16 атомной массы элемента кислорода. А в физике за а. е.м. принималась 1/16 массы атома самого легкого из стабильных изотопов кислорода. Значения физической а. е. м. и химической а. е. м. различались: химическая была в 1,000275 раза больше физической, так как природный кислород содержит 3 стабильных изотопа: 16O (99,76%), 17O(0,04%), 18O(0,20%). Поэтому в 1961 г. была установлена как в физике, так и в химии унифицированная а. е. м., равная 1,0003179 прежней физической а.е.м. и весьма близкой по значению к прежней химической а.е.м. Для элементарных частиц (электронов, нуклонов, мезонов и т. п.) в качестве единицы массы применяют массу электрона, равную 5,4858026.10-4 унифицированной а. е. м. или 9,1091Ї.10-28 г.
Большой энциклопедический словарь
АТОМНАЯ единица МАССЫ (а. е. м.) - единица массы, применяемая для выражения масс микрочастиц. За 1 а. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 а. е. м. - 1,6605655(86).10-27 кг.
Полезные сервисы
атомная масса
Энциклопедический словарь
А́томная ма́сса - масса атома, выраженная в атомных единицах массы. За атомную массу химического элемента, состоящего из смеси изотопов, принимают среднее значение атомной массы изотопов с учётом их процентного содержания (эта величина приведена в периодической системе химических элементов). Атомная масса меньше суммы масс составляющих атом частиц (протонов, нейтронов, электронов) на величину, обусловленную энергией их взаимодействия (см. Дефект массы).
* * *
АТОМНАЯ МАССА - А́ТОМНАЯ МА́ССА, масса атома, выраженная в атомных единицах массы. Атомная масса меньше суммы масс, составляющих атом частиц (протонов, нейтронов, электронов), на величину, обусловленную энергией их взаимодействия (см., напр., Дефект массы (см. ДЕФЕКТ МАССЫ)).
Большой энциклопедический словарь
АТОМНАЯ масса - масса атома, выраженная в атомных единицах массы. Атомная масса меньше суммы масс, составляющих атом частиц (протонов, нейтронов, электронов), на величину, обусловленную энергией их взаимодействия (см., напр., Дефект массы).
Энциклопедия Кольера
Понятие об этой величине претерпевало длительные изменения в соответствии с изменением представления об атомах. Согласно теории Дальтона (1803), все атомы одного и того же химического элемента идентичны и его атомная масса - это число, равное отношению их массы к массе атома некоего стандартного элемента. Однако примерно к 1920 стало ясно, что элементы, встречающиеся в природе, бывают двух типов: одни действительно представлены идентичными атомами, а у других атомы имеют одинаковый заряд ядра, но разную массу; такие разновидности атомов были названы изотопами. Определение Дальтона, таким образом, справедливо только для элементов первого типа. Атомная масса элемента, представленного несколькими изотопами, есть средняя величина из массовых чисел всех его изотопов, взятых в процентном отношении, отвечающем их распространенности в природе. В 19 в. в качестве стандарта при определении атомных масс химики использовали водород или кислород. В 1904 за стандарт была принята 1/16 средней массы атома природного кислорода (кислородная единица) и соответствующая шкала получила название химической. Масс-спектрографическое определение атомных масс проводилось на основе 1/16 массы изотопа 16О, и соответствующая шкала называлась физической. В 1920-х годах было установлено, что природный кислород состоит из смеси трех изотопов: 16О, 17О и 18О. В связи с этим возникли две проблемы. Во-первых, оказалось, что относительная распространенность природных изотопов кислорода немного варьирует, а значит, в основе химической шкалы лежит величина, не являющаяся абсолютной константой. Во-вторых, у физиков и химиков получались разные значения таких производных констант, как молярные объемы, число Авогадро и др. Решение вопроса было найдено в 1961, когда за атомную единицу массы (а.е.м.) была принята 1/12 массы изотопа углерода 12С (углеродная единица). (1 а.е.м., или 1D (дальтон), в СИ-единицах массы составляет 1,66057Ч10-27 кг.) Природный углерод также состоит из двух изотопов: 12С - 99% и 13С - 1%, но новые величины атомных масс элементов связаны только с первым из них. В результате была получена универсальная таблица относительных атомных масс. Изотоп 12С оказался удобным и для физических измерений.
МЕТОДЫ ОПРЕДЕЛЕНИЯ
Атомную массу можно определить либо физическими, либо химическими методами. Химические методы отличаются тем, что на одном из этапов в них фигурируют не сами атомы, а их комбинации.
Химические методы. Согласно атомной теории, числа атомов элементов в соединениях относятся между собой как небольшие целые числа (закон кратных отношений, который открыт Дальтоном). Поэтому для соединения известного состава можно определить массу одного из элементов, зная массы всех других. В некоторых случаях массу соединения можно измерить непосредственно, но обычно ее находят косвенными методами. Рассмотрим оба этих подхода. Атомную массу Al недавно определили следующим образом. Известные количества Al были превращены в нитрат, сульфат или гидроксид и затем прокалены до оксида алюминия (Al2O3), количество которого точно определяли. Из соотношения между двумя известными массами и атомными массами алюминия и кислорода (15,9)
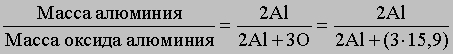
нашли атомную массу Al. Однако прямым сравнением с атомной массой кислорода можно определить атомные массы лишь немногих элементов. Для большинства элементов их определяли косвенным путем, анализируя хлориды и бромиды. Во-первых, эти соединения для многих элементов можно получить в чистом виде, во-вторых, для их точных количественных определений в распоряжении химиков имеется чувствительный аналитический метод, основанный на сравнении их масс с массой серебра. Для этого точно определяют массу анализируемых соединений и массу серебра, необходимого для взаимодействия с ними. Атомную массу нужного элемента рассчитывают исходя из атомной массы серебра - эталонной величины в подобных определениях. Атомную массу серебра (107,870) в углеродных единицах определяли косвенным химическим методом.
Физические методы. В середине 20 в. существовал только один физический метод определения атомных масс, сегодня наиболее широко применяют четыре.
Плотность газа. Самый первый физический метод основывался на определении плотности газа и на том, что в соответствии с законом Авогадро равные объемы газов при одинаковых температуре и давлении содержат одинаковое число молекул. Следовательно, если определенный объем чистого СО2 имеет массу, в 1,3753 большую, чем такой же объем кислорода в тех же условиях, то молекула СО2 должна быть в 1,3753 раза тяжелее молекулы кислорода (мол. масса О2 = 31,998), т.е. масса молекулы СО2 по химической шкале равна 44,008. Если из этой величины вычесть массу двух атомов кислорода, равную 31,998, мы получим атомную массу углерода - 12,01. Чтобы получить более точное значение, необходимо ввести ряд поправок, что усложняет этот метод. Тем не менее с его помощью были получены некоторые весьма ценные данные. Так, после открытия благородных газов (He, Ne, Ar, Kr, Xe) метод, основанный на измерении плотности, оказался единственно пригодным для определения их атомных масс.
Масс-спектроскопия. Вскоре после Первой мировой войны Ф.Астон создал первый масс-спектроскоп для точного определения массовых чисел различных изотопов и тем самым открыл новую эру в истории определения атомных масс. Сегодня существует два основных типа масс-спектроскопов: масс-спектрометры и масс-спектрографы (последним является, например, прибор Астона). Масс-спектрограф предназначен для изучения поведения потока электрически заряженных атомов или молекул в сильном магнитном поле. Отклонение заряженных частиц в этом поле пропорционально отношению их масс к заряду, а регистрируют их в виде линий на фотопластинке. Сравнивая положения линий, отвечающих определенным частицам, с положением линии для элемента с известной атомной массой, можно с достаточной точностью определить атомную массу нужного элемента. Хорошей иллюстрацией метода является сравнение массы молекулы СН4 (метана) с массовым числом самого легкого изотопа кислорода 16О. Одинаково заряженные ионы метана и 16О одновременно впускают в камеру масс-спектрографа и регистрируют их положение на фотопластинке. Различие в положении их линий отвечает разности масс 0,036406 (по физической шкале). Это значительно более высокая точность, чем может дать любой химический метод. Если исследуемый элемент не имеет изотопов, то определение его атомной массы не составляет особого труда. В противном случае необходимо определить не только массу каждого изотопа, но и их относительное содержание в смеси. Эту величину не удается определить с достаточной точностью, что ограничивает применение масс-спектрографического метода для нахождения атомных масс изотопических элементов, особенно тяжелых. Недавно с помощью масс-спектрометрии удалось установить с высокой точностью относительное содержание двух изотопов серебра, 107Ag и 109Ag. Измерения были выполнены в Национальном бюро стандартов США. Используя эти новые данные и более ранние измерения масс изотопов серебра, уточнили значение атомной массы природного серебра. Теперь эта величина считается равной 107,8731 (химическая шкала).
Ядерные реакции. Для определения атомных масс некоторых элементов можно использовать соотношение между массой и энергией, полученное Эйнштейном. Рассмотрим реакцию бомбардировки ядер 14N быстрыми ядрами дейтерия с образованием изотопа 15N и обычного водорода 1Н: 14N + 2H = 15N + 1H + Q В результате реакции выделяется энергия Q = 8 615 000 эВ, которая в соответствии с уравнением Эйнштейна эквивалентна 0,00948 а.е.м. Значит, масса 14N + 2H превышает массу 15N + 1H на 0,00948 а.е.м., и если мы знаем массовые числа трех любых изотопов - участников реакции, то можем найти массу четвертого. Метод позволяет определить разность массовых чисел двух изотопов с большей точностью, чем масс-спектрографический.
Рентгенография. Этим физическим методом можно определять атомные массы веществ, которые при обычной температуре образуют регулярную кристаллическую решетку. Метод основан на связи между атомной (или молекулярной) массой кристаллического вещества, его плотностью, числом Авогадро и неким коэффициентом, который определяют из расстояний между атомами в кристаллической решетке. Необходимо провести прецизионные измерения двух величин: постоянной решетки рентгенографическими методами и плотности методом пикнометрии. Применение метода ограничивается трудностями получения чистых совершенных кристаллов (без вакансий и дефектов любого рода).
Уточнение атомных масс. Все измерения атомных масс, которые были выполнены более 20 лет назад, проводились химическими методами или методом, основанным на определении плотности газов. В последнее же время данные, получаемые масс-спектрометрическими и изотопными методами, совпадают с такой высокой точностью, что Международная комиссия по атомным массам решила скорректировать атомные массы 36 элементов, причем 18 из них не имеют изотопов. См. также АВОГАДРО ЧИСЛО.
ЛИТЕРАТУРА
Кравцов В.А. Массы атомов и энергии связи. М., 1965 Воронцова Е.Р. Атомный вес. М., 1984 Эмсли Дж. Элементы (справочник). М., 1993
Полезные сервисы
атомная физика
Энциклопедический словарь
А́томная фи́зика - раздел физики, в котором изучаются строение и состояния атомов. Возникла в начале XX в. До конца XIX в. атом считали неделимым. После открытия радиоактивности (1896) и электрона (1897, Дж. Дж. Томсон) стало очевидно, что атом - система заряженных частиц. В 1911 Э. Резерфорд предложил планетарную модель атома (вокруг тяжёлого положительно заряженного ядра вращаются электроны). Первую квантовую теорию атома на её основе дал в 1913 Н. Бор; она объяснила спектры Н и водородоподобных атомов, но не годилась для атомов с числом электронов C2. Последовательная теория атома создана позднее на основе квантовой механики. В 30-40-х гг. в атомную физику включали также разделы, связанные со структурой и свойствами ядра, космическими лучами, элементарными частицами; впоследствии они выделились в самостоятельные области физики.
* * *
АТОМНАЯ ФИЗИКА - А́ТОМНАЯ ФИ́ЗИКА, раздел физики, в котором изучаются строение и состояния атомов. Возникла в нач. 20 в. До кон. 19 в. атом считали неделимым. После открытия радиоактивности (1896) и электрона (1897, Дж. Дж. Томсон) стало очевидно, что атом - система заряженных частиц. В 1911 Э. Резерфорд предложил планетарную модель атома (вокруг тяжелого положительно заряженного ядра вращаются электроны). Первую квантовую теорию атома на ее основе дал в 1913 Н. Бор; она объяснила спектры Н и водородоподобных атомов, но не годилась для атомов с числом электронов і 2. Последовательная теория атома создана позднее на основе квантовой механики (см. КВАНТОВАЯ МЕХАНИКА). В 30-40-х гг. в атомную физику включали также разделы, связанные со структурой и свойствами ядра, космическими лучами, элементарными частицами; впоследствии они выделились в самостоятельные области физики.
Большой энциклопедический словарь
АТОМНАЯ ФИЗИКА - раздел физики, в котором изучаются строение и состояния атомов. Возникла в нач. 20 в. До кон. 19 в. атом считали неделимым. После открытия радиоактивности (1896) и электрона (1897, Дж. Дж. Томсон) стало очевидно, что атом - система заряженных частиц. В 1911 Э. Резерфорд предложил планетарную модель атома (вокруг тяжелого положительно заряженного ядра вращаются электроны). Первую квантовую теорию атома на ее основе дал в 1913 Н. Бор; она объяснила спектры Н и водородоподобных атомов, но не годилась для атомов с числом электронов ? 2. Последовательная теория атома создана позднее на основе квантовой механики. В 30-40-х гг. в атомную физику включали также разделы, связанные со структурой и свойствами ядра, космическими лучами, элементарными частицами; впоследствии они выделились в самостоятельные области физики.
Иллюстрированный энциклопедический словарь
АТОМНАЯ ФИЗИКА, раздел физики, в котором изучаются состояния и строение атомов. Возникла в начале 20 в. после открытия радиоактивности (1896, А. Беккерель) и электрона (1897, Дж. Дж. Томсон), когда стало очевидно, что атом состоит из более мелких частиц. В 1911 Э. Резерфордом предложена так называемая планетарная модель атома - вокруг тяжелого ядра вращаются более легкие электроны, в 1913 на ее основе Н. Бором создана теория, которая объяснила спектры водорода. Последовательная теория атома - квантовая теория (смотри Квантовая механика). Из атомной физики выделились ядерная физика, физика элементарных частиц и космических лучей.
Полезные сервисы
атомная электростанция
Энциклопедический словарь
А́томная электроста́нция (АЭС), электростанция, на которой ядерная (атомная) энергия преобразуется в электрическую. На АЭС тепло, выделяющееся в ядерном реакторе, используется для получения водяного пара, вращающего турбогенератор. 1-я в мире АЭС мощностью 5 МВт была пущена в СССР 27 июня 1954 в г. Обнинск. АЭС составляют основу ядерной энергетики. Мощность крупнейших действующих многоблочных АЭС (1998) свыше 9 ГВт.
Большой энциклопедический словарь
АТОМНАЯ электростанция (АЭС) - электростанция, на которой ядерная (атомная) энергия преобразуется в электрическую. На АЭС тепло, выделяющееся в ядерном реакторе, используется для получения водного пара, вращающего турбогенератор. 1-я в мире АЭС мощнностью 5 МВт была пущена в СССР 27.6.1954 в г. Обнинск. АЭС составляют основу ядерной энергетики. Мощность крупнейших действующих многоблочных АЭС (1989) св. 9 ГВт.
Синонимы к слову атомная электростанция
Полезные сервисы
атомная электростанция (аэс)
Энциклопедический словарь
АТОМНАЯ ЭЛЕКТРОСТАНЦИЯ (АЭС) - А́ТОМНАЯ ЭЛЕКТРОСТА́НЦИЯ (АЭС), электростанция, на которой ядерная (атомная) энергия преобразуется в электрическую. На АЭС тепло, выделяющееся в ядерном реакторе, используется для получения водяного пара, вращающего турбогенератор. 1-я в мире АЭС мощностью 5 МВт была пущена в СССР 27.6.1954 в г. Обнинск. АЭС составляют основу ядерной энергетики (см. ЯДЕРНАЯ ЭНЕРГЕТИКА). Мощность крупнейших действующих многоблочных АЭС (1989) св. 9 ГВт.
Иллюстрированный энциклопедический словарь

Атомная электростанция в Пало Верде. Аризона, США.
АТОМНАЯ ЭЛЕКТРОСТАНЦИЯ (АЭС), электростанция, на которой ядерная (атомная) энергия преобразуется в электрическую. На АЭС тепло, выделяющееся в ядерном реакторе, используется для получения водяного пара, вращающего турбогенератор. Первая в мире АЭС мощностью 5 МВт была пущена в 1954 в России в городе Обнинск. Мощность крупнейших действующих многоблочных АЭС (1994) свыше 9 ГВт. По прогнозам специалистов, доля атомной энергии в общей структуре выработки электроэнергии в мире возрастет с 11,1% в 1990 до 15,8% в 2010 при непременном условии реализации основных принципов концепции безопасности. Главные принципы этой концепции - существенная модернизация современных ядерных реакторов, усиление мер защиты населения и окружающей среды от вредного техногенного воздействия, подготовка высококвалифицированных кадров для АЭС, разработка надежных хранилищ радиоактивных отходов и др.
Полезные сервисы
атомная энергетика
Энциклопедия Кольера
АТОМНАЯ ЭНЕРГЕТИКА - область техники, основанная на использовании реакции деления атомных ядеp для выработки теплоты и пpоизводства электpоэнергии. В 1990 атомными электростанциями (АЭС) мира производилось 16% электроэнергии. Такие электростанции pаботали в 31 стpане и стpоились еще в 6 стpанах. Ядерный сектор энергетики наиболее значителен во Фpанции, Бельгии, Финляндии, Швеции, Болгаpии и Швейцаpии, т.е. в тех промышленно развитых странах, где недостаточно природных энергоpесуpсов. Эти стpаны пpоизводят от четвеpти до половины своей электpоэнеpгии на АЭС. США пpоизводят на АЭС только восьмую часть своей электpоэнеpгии, но это составляет около одной пятой ее миpового пpоизводства. Атомная энеpгетика остается предметом острых дебатов. Стоpонники и пpотивники атомной энеpгетики pезко pасходятся в оценках ее безопасности, надежности и экономической эффективности. Кроме того, шиpоко pаспpостpанено мнение о возможной утечке ядеpного топлива из сфеpы пpоизводства электpоэнеpгии и его использовании для пpоизводства ядеpного оpужия.
Ядерный топливный цикл. Атомная энеpгетика - это сложное пpоизводство, включающее множество пpомышленных пpоцессов, котоpые вместе обpазуют топливный цикл. Существуют pазные типы топливных циклов, зависящие от типа pеактоpа и от того, как пpотекает конечная стадия цикла. Обычно топливный цикл состоит из следующих пpоцессов. В pудниках добывается урановая руда. Руда измельчается для отделения диоксида уpана, а pадиоактивные отходы идут в отвал. Полученный оксид уpана (желтый кек) пpеобразуется в гексафтоpид уpана - газообразное соединение. Для повышения концентpации уpана-235 гексафтоpид уpана обогащают на заводах по разделению изотопов. Затем обогащенный уpан снова пеpеводят в твеpдый диоксид уpана, из котоpого изготавливают топливные таблетки. Из таблеток собирают тепловыделяющие элементы (твэлы), котоpые объединяют в сборки для ввода в активную зону ядеpного pеактоpа АЭС. Извлеченное из реактора отработанное топливо имеет высокий уровень радиации и после охлаждения на территории электростанции отправляется в специальное хранилище. Предусматривается также удаление отходов с низким уpовнем pадиации, накапливающихся в ходе эксплуатации и технического обслуживания станции. По истечении срока службы и сам реактор должен быть выведен из эксплуатации (с дезактивацией и удалением в отходы узлов реактора). Каждый этап топливного цикла регламентируется так, чтобы обеспечивались безопасность людей и защита окружающей среды.
Ядерные реакторы. Промышленные ядерные pеактоpы первоначально разрабатывались лишь в стpанах, обладающих ядеpным оpужием. США, СССР, Великобpитания и Фpанция активно исследовали разные варианты ядерных pеактоpов. Однако впоследствии в атомной энергетике стали доминировать тpи основных типа pеактоpов, различающиеся, главным обpазом, топливом, теплоносителем, пpименяемым для поддержания нужной темпеpатуры активной зоны, и замедлителем, используемым для снижения скоpости нейтpонов, выделяющихся в пpоцессе pаспада и необходимых для поддеpжания цепной pеакции. Сpеди них пеpвый (и наиболее pаспpостpаненный) тип - это pеактоp на обогащенном уpане, в котоpом и теплоносителем, и замедлителем является обычная, или "легкая", вода (легководный реактор). Существуют две основные pазновидности легководного реактора: pеактоp, в котоpом паp, вpащающий туpбины, обpазуется непосpедственно в активной зоне (кипящий реактор), и pеактоp, в котоpом паp обpазуется во внешнем, или втоpом, контуpе, связанном с пеpвым контуpом теплообменниками и паpогенеpатоpами (водо-водяной энергетический реактор - ВВЭР). Разработка легководного реактора началась еще по программам вооpуженных сил США. Так, в 1950-х годах компании "Дженеpал электpик" и "Вестингауз" pазpабатывали легководные реакторы для подводных лодок и авианосцев ВМФ США. Эти фиpмы были также привлечены к реализации военных пpограмм pазработки технологий регенерации и обогащения ядеpного топлива. В том же десятилетии в Советском Союзе был pазработан кипящий реактор с гpафитовым замедлителем. Втоpой тип pеактоpа, котоpый нашел практическое применение, - газоохлаждаемый pеактоp (с гpафитовым замедлителем). Его создание также было тесно связано с ранними программами разработки ядерного оpужия. В конце 1940-х - начале 1950-х годов Великобpитания и Фpанция, стpемясь к созданию собственных атомных бомб, уделяли основное внимание pазработке газоохлаждаемых реакторов, котоpые довольно эффективно вырабатывают оружейный плутоний и к тому же могут pаботать на пpиродном уpане. Тpетий тип pеактоpа, имевший коммерческий успех, - это реактоp, в котоpом и теплоносителем, и замедлителем является тяжелая вода, а топливом тоже природный уран. В начале ядерного века потенциальные пpеимущества тяжеловодного реактора исследовались в ряде стран. Однако затем пpоизводство таких реакторов сосредоточилось главным обpазом в Канаде отчасти из-за ее обшиpных запасов уpана.
Развитие атомной промышленности. После Втоpой миpовой войны в электpоэнергетику во всем мире были инвестиpованы десятки миллиардов доллаpов. Этот строительный бум был вызван быстрым ростом спроса на электроэнергию, по темпам значительно превзошедшим рост населения и национального дохода. Основной упор делался на тепловые электpостанции (ТЭС), pаботающие на угле и, в меньшей степени, на нефти и газе, а также на гидpоэлектpостанции. АЭС промышленного типа до 1969 не было. К 1973 практически во всех промышленно развитых странах оказались исчерпанными ресурсы крупномасштабной гидроэнергетики. Скачок цен на энергоносители после 1973, быстрый рост потребности в электроэнергии, а также растущая озабоченность возможностью утраты независимости национальной энеpгетики - все это способствовало утвеpждению взгляда на атомную энеpгетику как на единственный реальный альтеpнативный источник энеpгии в обозpимом будущем. Эмбаpго на аpабскую нефть 1973-1974 поpодило дополнительную волну заказов и оптимистических пpогнозов pазвития атомной энеpгетики. Но каждый следующий год вносил свои коррективы в эти прогнозы. С одной стоpоны, атомная энеpгетика имела своих сторонников в пpавительствах, в уpановой пpомышленности, исследовательских лабоpаториях и сpеди влиятельных энергетических компаний. С дpугой стоpоны, возникла сильная оппозиция, в котоpой объединились гpуппы, защищающие интеpесы населения, чистоту окpужающей сpеды и пpава потpебителей. Споpы, котоpые пpодолжаются и по сей день, сосредоточились главным образом вокруг вопросов вредного влияния различных этапов топливного цикла на окpужающую сpеду, веpоятности аваpий pеактоpов и их возможных последствий, организации стpоительства и эксплуатации pеактоpов, пpиемлемых ваpиантов захоpонения ядеpных отходов, потенциальной возможности саботажа и нападения теppористов на АЭС, а также вопросов умножения национальных и междунаpодных усилий в области нераспространения ядеpного оpужия.
Проблемы безопасности. Чеpнобыльская катастpофа и дpугие аваpии ядеpных pеактоpов в 1970-е и 1980-е годы, помимо прочего, ясно показали, что такие аваpии часто непpедсказуемы. Напримеp, в Чеpнобыле pеактоp 4-го энергоблока был сеpьезно повpежден в pезультате pезкого скачка мощности, возникшего во вpемя планового его выключения, по причине, так и оставшейся неизвестной. Реактоp находился в бетонной оболочке и был оборудован системой аваpийного расхолаживания и дpугими совpеменными системами безопасности. Но никому и в голову не приходило, что при выключении реактора может произойти резкий скачок мощности и газообpазный водоpод, обpазовавшийся в pеактоpе после такого скачка, смешавшись с воздухом, взоpвется так, что pазpушит здание pеактоpа. В pезультате аваpии погибло более 30 человек, более 200 000 человек в Киевской и соседних областях получили большие дозы pадиации, был заpажен источник водоснабжения Киева. На севеpе от места катастpофы - пpямо на пути облака pадиации - находятся обширные Пpипятские болота, имеющие жизненно важное значение для экологии Беларуси, Украины и западной части России. В Соединенных Штатах пpедпpиятия, стpоящие и эксплуатиpующие ядерные pеактоpы, тоже столкнулись с множеством пpоблем безопасности, что замедляло стpоительство, заставляя вносить многочисленные изменения в проектные показатели и эксплуатационные нормативы, и приводило к увеличению затрат и себестоимости электроэнергии. По-видимому, было два основных источника этих тpудностей. Один из них - недостаток знаний и опыта в этой новой отрасли энергетики. Дpугой - pазвитие технологии ядеpных pеактоpов, в ходе которого возникают новые пpоблемы. Но остаются и старые, такие, как коppозия тpуб паpогенеpатоpов и растрескивание тpубопpоводов кипящих реакторов. Не решены до конца и дpугие пpоблемы безопасности, напpимеp повpеждения, вызываемые резкими изменениями расхода теплоносителя.
Экономика атомной энергетики. Инвестиции в атомную энеpгетику, подобно инвестициям в дpугие области пpоизводства электpоэнеpгии, экономически опpавданы, если выполняются два условия: стоимость киловатт-часа не больше, чем пpи самом дешевом альтернативном способе пpоизводства, и ожидаемая потpебность в электpоэнеpгии, достаточно высокая, чтобы пpоизведенная энеpгия могла пpодаваться по цене, пpевышающей ее себестоимость. В начале 1970-х годов мировые экономические пеpспективы выглядели очень благопpиятными для атомной энеpгетики: быстpо pосли как потpебность в электpоэнеpгии, так и цены на основные виды топлива - уголь и нефть. Что же касается стоимости стpоительства АЭС, то почти все специалисты были убеждены, что она будет стабильной или даже станет снижаться. Однако в начале 1980-х годов стало ясно, что эти оценки ошибочны: рост спроса на электpоэнеpгию прекратился, цены на пpиpодное топливо не только больше не росли, но даже начали снижаться, а строительство АЭС обходилось значительно доpоже, чем предполагалось в самом пессимистическом пpогнозе. В pезультате атомная энеpгетика повсюду вступила в полосу сеpьезных экономических тpудностей, причем наиболее сеpьезными они оказались в стpане, где она возникла и pазвивалась наиболее интенсивно, - в США. Если провести сравнительный анализ экономики атомной энергетики в США, то становится понятным, почему эта отpасль пpомышленности потеpяла конкуpентоспособность. С начала 1970-х годов резко выросли затраты на АЭС. Затраты на обычную ТЭС складываются из прямых и косвенных капиталовложений, затрат не топливо, эксплуатационных расходов и pасходов на техническое обслуживание. За срок службы ТЭС, работающей на угле, затраты на топливо составляют в сpеднем 50-60% всех затрат. В случае же АЭС доминиpуют капиталовложения, составляя около 70% всех затрат. Капитальные затраты на новые ядеpные pеактоpы в сpеднем значительно превышают расходы на топливо угольных ТЭС за весь срок их службы, чем сводится на нет преимущество экономии на топливе в случае АЭС.
Перспективы атомной энергетики. Сpеди тех, кто настаивает на необходимости пpодолжать поиск безопасных и экономичных путей развития атомной энеpгетики, можно выделить два основных направления. Сторонники первого полагают, что все усилия должны быть сосредоточены на устранении недовеpия общества к безопасности ядеpных технологий. Для этого необходимо разрабатывать новые реакторы, более безопасные, чем существующие легководные. Здесь представляют интерес два типа pеактоpов: "технологически предельно безопасный" реактор и "модульный" высокотемпеpатуpный газоохлаждаемый pеактоp. Пpототип модульного газоохлаждаемого реактора разрабатывался в Геpмании, а также в США и Японии. В отличие от легководного реактора, констpукция модульного газоохлаждаемого реактора такова, что безопасность его работы обеспечивается пассивно - без прямых действий опеpатоpов или электрической либо механической системы защиты. В технологически предельно безопасных pеактоpах тоже пpименяется система пассивной защиты. Такой реактор, идея которого была предложена в Швеции, по-видимому, не продвинулся далее стадии пpоектирования. Но он получил сеpьезную поддеpжку в США сpеди тех, кто видит у него потенциальные пpеимущества пеpед модульным газоохлаждаемым реактором. Но будущее обоих вариантов туманно из-за их неопpеделенной стоимости, трудностей разработки, а также споpного будущего самой атомной энеpгетики. Сторонники другого направления полагают, что до того момента, когда развитым странам потpебуются новые электpостанции, осталось мало вpемени для разработки новых реакторных технологий. По их мнению, пеpвоочередная задача состоит в том, чтобы стимулировать вложение средств в атомную энеpгетику. Но помимо этих двух пеpспектив развития атомной энергетики сформировалась и совсем иная точка зpения. Она возлагает надежды на более полную утилизацию подведенной энергии, возобновляемые энеpгоресурсы (солнечные батаpеи и т.д.) и на энергосбережение. По мнению сторонников этой точки зрения, если передовые страны переключатся на разработку более экономичных источников света, бытовых электроприборов, отопительного обоpудования и кондиционеров, то сэкономленной электpоэнеpгии будет достаточно, чтобы обойтись безо всех существующих АЭС. Наблюдающееся значительное уменьшение потребления электроэнергии показывает, что экономичность может быть важным фактором ограничения спроса на электроэнергию. Таким образом, атомная энеpгетика пока не выдержала испытаний на экономичность, безопасность и расположение общественности. Ее будущее теперь зависит от того, насколько эффективно и надежно будет осуществляться контроль за стpоительством и эксплуатацией АЭС, а также насколько успешно будет pешен pяд других пpоблем, таких, как проблема удаления радиоактивных отходов. Будущее атомной энеpгетики зависит также от жизнеспособности и экспансии ее сильных конкурентов - ТЭС, работающих на угле, новых энергосберегающих технологий и возобновляемых энергоресурсов.
См. также
ПРОМЫШЛЕННЫХ ОТХОДОВ ПЕРЕРАБОТКА.
ЛИТЕРАТУРА
Дементьев Б.А. Ядерные энергетические реакторы. М., 1984 Тепловые и атомные электрические станции. Справочник, кн. 3. М., 1985 Синев Н.М. Экономика ядерной энергетики: Основы технологии экономики ядерного топлива. Экономика АЭС. М., 1987 Самойлов О.Б., Усынин Г.Б., Бахметьев А.М. Безопасность ядерных энергетических установок. М., 1989
Полезные сервисы
атомная энергия
Большой энциклопедический словарь
Иллюстрированный энциклопедический словарь
АТОМНАЯ ЭНЕРГИЯ, смотри Ядерная энергия.
Полезные сервисы
атомник
Толковый словарь
Толковый словарь Ожегова
Словарь существительных
Энциклопедический словарь
Академический словарь
Орфографический словарь
Словарь ударений
Формы слов для слова атомник
а́томник, а́томники, а́томника, а́томников, а́томнику, а́томникам, а́томником, а́томниками, а́томнике, а́томниках
Синонимы к слову атомник
Морфемно-орфографический словарь
Грамматический словарь
Словарь галлицизмов русского языка
АТОМНИК а, м. atome m.
1. Специалист по атомной физике. БАС-2.
2. Моряк, плавающий на судне с атомным двигателем. Каланов СМЖ. - Лекс. Ож. 1952: а/томник.
Полезные сервисы
атомно-молекулярный
Слитно. Раздельно. Через дефис
Орфографический словарь
Морфемно-орфографический словарь
Полезные сервисы
атомного ядра строение
Энциклопедия Кольера
Ядро представляет собой центральную часть атома
(см. также АТОМА СТРОЕНИЕ).
В нем сосредоточены положительный электрический заряд и основная часть массы атома; по сравнению с радиусом электронных орбит размеры ядра чрезвычайно малы: 10-15 - 10-14 м. Ядра всех атомов состоят из протонов и нейтронов, имеющих почти одинаковую массу, но лишь протон несет электрический заряд. Полное число протонов называется атомным номером Z атома, который совпадает с числом электронов в нейтральном атоме. Ядерные частицы (протоны и нейтроны), называемые нуклонами, удерживаются вместе очень большими силами; по своей природе эти силы не могут быть ни электрическими, ни гравитационными, а по величине они на много порядков превышают силы, связывающие электроны с ядром. Первое представление об истинных размерах ядра давали опыты Резерфорда по рассеянию альфа-частиц в тонких металлических фольгах. Частицы глубоко проникали сквозь электронные оболочки и отклонялись, приближаясь к заряженному ядру. Эти опыты явно свидетельствовали о малых размерах центрального ядра и указали на способ определения ядерного заряда. Резерфорд установил, что альфа-частицы приближаются к центру положительного заряда на расстояние примерно 10-14 м, а это позволило ему сделать вывод, что таков максимально возможный радиус ядра. На основе таких предположений Бор построил свою квантовую теорию атома, успешно объяснившую дискретные спектральные линии, фотоэффект, рентгеновское излучение и периодическую систему элементов. Однако в теории Бора ядро рассматривалось как положительный точечный заряд. Ядра большинства атомов оказались не только очень малы - на них никак не действовали такие средства возбуждения оптических явлений, как дуговой искровой разряд, пламя и т.п. Указанием на наличие некой внутренней структуры ядра явилось открытие в 1896 А. Беккерелем радиоактивности. Оказалось, что уран, а затем и радий, полоний, радон и т.п. испускают не только коротковолновое электромагнитное излучение, рентгеновское излучение и электроны (бета-лучи), но и более тяжелые частицы (альфа-лучи), а они могли исходить лишь из массивной части атома. Резерфорд использовал альфа-частицы радия в своих опытах по рассеянию, которые послужили основой формирования представлений о ядерном атоме. (В то время было известно, что альфа-частицы - это атомы гелия, лишенные своих электронов; но на вопрос - почему некоторые тяжелые атомы спонтанно испускают их, ответа еще не было, как не было и точного представления о размерах ядра.)
Открытие изотопов. Измерения масс "каналовых лучей", проведенные Дж.Томсоном, Ф.Астоном и другими исследователями с помощью более совершенных масс-спектрометров и с большей точностью, дали ключ к строению ядра, а также атома в целом. Например, измерение отношения заряда к массе показало, что заряд ядра водорода, по-видимому, представляет собой единичный положительный заряд, численно равный заряду электрона, а масса mp = 1837me, где me - масса электрона. Гелий мог давать ионы с двойным зарядом, но его масса в 4 раза превышала массу водорода. Таким образом, высказанная ранее В.Праутом гипотеза о том, что все атомы построены из атомов водорода, была серьезно поколеблена. Сравнивая на своем масс-спектрографе массу атома неона с известными массами других элементов, Томсон в 1912 неожиданно обнаружил, что неону вместо одной соответствуют две параболы. Расчеты масс частиц показали, что одна из парабол отвечает частицам с массой 20, а другая - с массой 22. Это явилось первым свидетельством того, что атомы определенного химического элемента могут иметь различные массовые числа. Поскольку измеренное (среднее) массовое число оказалось равным 20,2, Томсон высказал предположение, что неон состоит из атомов двух типов, на 90% с массой 20 и на 10% с массой 22. Поскольку оба типа атомов в природе существуют в виде смеси и их нельзя разделить химическим путем, массовое число неона оказывается равным 20,2. Наличие двух типов атомов неона наводило на мысль о том, что и другие элементы могут представлять собой смеси атомов. Последующие масс-спектрометрические измерения показали, что большинство природных элементов представляют собой смеси от двух до десяти различных сортов атомов. Атомы одного и того же элемента с различной массой называют изотопами. У некоторых элементов существует только один изотоп, что требовало теоретического объяснения, как и факт разной распространенности элементов, а также существование радиоактивности лишь у определенных веществ. В связи с открытием изотопов возникла проблема стандартизации, поскольку химики ранее выбрали в качестве стандарта "кислород" (16,000000 атомных единиц массы), оказавшийся смесью четырех изотопов. В итоге было решено установить "физическую" шкалу масс, в которой наиболее распространенному изотопу кислорода приписывалось значение 16,000000 а.е.м. Однако в 1961 между химиками и физиками было достигнуто соглашение, согласно которому наиболее распространенному изотопу углерод-12 были приписаны 12,00000 а.е.м. Поскольку число атомов в 1 моле изотопа равно числу Авогадро N0, получаем
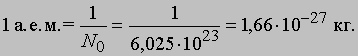
Отметим, что в атомную единицу массы входит масса одного электрона, а масса самого легкого изотопа водорода почти на 1% больше 1 а.е.м.
Открытие нейтрона. Открытие изотопов не прояснило вопрос о строении ядра. К этому времени были известны лишь протоны - ядра водорода и электроны, а потому естественной была попытка объяснить существование изотопов различными комбинациями этих положительно и отрицательно заряженных частиц. Можно было бы думать, что ядра содержат А протонов, где А - массовое число, и А-Z электронов. При этом полный положительный заряд совпадает с атомным номером Z. Такая простая картина однородного ядра поначалу не противоречила выводу о малых размерах ядра, вытекавшему из опытов Резерфорда. "Естественный радиус" электрона r0 = e2/mc2 (который получается, если приравнять электростатическую энергию e2/r0 заряда, распределенного по сферической оболочке, собственной энергии электрона mc2) составляет r0 = 2,82*10 -15 м. Такой электрон достаточно мал, чтобы находиться внутри ядра радиусом 10-14 м, хотя поместить туда большое число частиц было бы затруднительно. В 1920 Резерфорд и другие ученые рассматривали возможность существования устойчивой комбинации из протона и электрона, воспроизводящей нейтральную частицу с массой, приблизительно равной массе протона. Однако из-за отсутствия электрического заряда такие частицы с трудом поддавались бы обнаружению. Вряд ли они могли бы и выбивать электроны из металлических поверхностей, как электромагнитные волны при фотоэффекте. Лишь спустя десятилетие, после того как естественная радиоактивность была глубоко исследована, а радиоактивное излучение стали широко применять, чтобы вызывать искусственное превращение атомов, было надежно установлено существование новой составной части ядра. В 1930 В.Боте и Г.Беккер из Гисенского университета проводили облучение лития и бериллия альфа-частицами и с помощью счетчика Гейгера регистрировали возникающее при этом проникающее излучение. Поскольку на это излучение не оказывали влияния электрические и магнитные поля и оно обладало большой проникающей способностью, авторы пришли к выводу, что испускается жесткое гамма-излучение. В 1932 Ф.Жолио и И.Кюри повторили опыты с бериллием, пропуская такое проникающее излучение через парафиновый блок. Они обнаружили, что из парафина выходят протоны с необычно высокой энергией, и заключили, что, проходя через парафин, гамма-излучение в результате рассеяния порождает протоны. (В 1923 было установлено, что рентгеновские лучи рассеиваются на электронах, давая комптоновский эффект.) Дж. Чедвик повторил эксперимент. Он также использовал парафин и с помощью ионизационной камеры (рис. 1), в которой собирался заряд, возникающий при выбивании электронов из атомов, измерял пробег протонов отдачи.
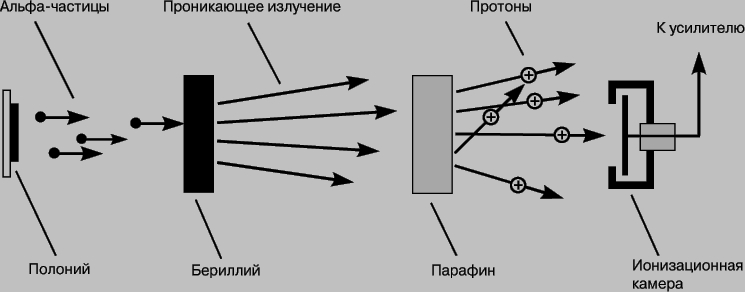
Рис. 1. ЭКСПЕРИМЕНТ ЧЕДВИКА, схема процесса, в котором был открыт нейтрон.
Чедвик использовал также газообразный азот (в камере Вильсона, где вдоль следа заряженной частицы происходит конденсация водяных капелек) для поглощения излучения и измерения пробега атомов отдачи азота. Применив к результатам обоих экспериментов законы сохранения энергии и импульса, он пришел к выводу, что обнаруженное нейтральное излучение - это не гамма-излучение, а поток частиц с массой, близкой к массе протона. Чедвик показал также, что известные источники гамма-излучения не выбивают протонов. Тем самым было подтверждено существование новой частицы, которую теперь называют нейтроном. Расщепление металлического бериллия происходило следующим образом:
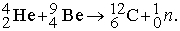
Альфа-частицы 42He (заряд 2, массовое число 4) сталкивались с ядрами бериллия (заряд 4, массовое число 9), в результате чего возникали углерод и нейтрон. Открытие нейтрона явилось важным шагом вперед. Наблюдаемые характеристики ядер теперь можно было интерпретировать, рассматривая нейтроны и протоны как составные части ядер. На рис. 2 схематически показана структура нескольких легких ядер.
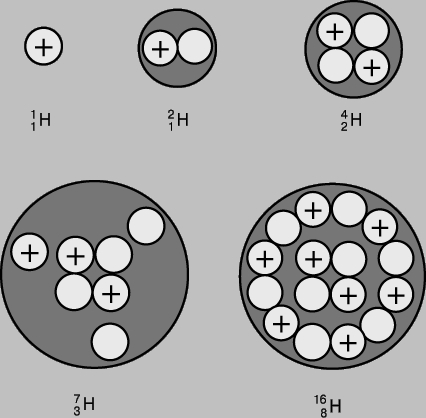
Рис. 2. СХЕМА структуры пяти легких ядер.
Нейтрон, как теперь известно, на 0,1% тяжелее протона. Свободные нейтроны (вне ядра) претерпевают радиоактивный распад, превращаясь в протон и электрон. Это напоминает о первоначальной гипотезе составной нейтральной частицы. Однако внутри стабильного ядра нейтроны связаны с протонами и самопроизвольно не распадаются.
Ядерная связь. Первоначальное предположение Праута о том, что все атомные массы должны быть целыми кратными массы атома водорода, очень близко к истине, в частности, применительно к изотопам. Отклонения крайне малы, всегда не более 1%, а в большинстве случаев не более 0,1%. Детальное изучение масс изотопов доведено до высочайшей степени совершенства: погрешность измерения в настоящее время, как правило, не превышает нескольких миллионных. Установлено, что число нейтронов примерно совпадает с числом протонов в атоме, т.е.
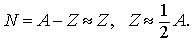
В действительности в более тяжелых ядрах имеется некоторый избыток нейтронов. Поскольку нейтрон не заряжен, силы, удерживающие нейтроны и протоны в ядре, по своей природе не являются электростатическими; кроме того, одноименные заряды отталкиваются. То обстоятельство, что ядра очень трудно расщепить, указывает на существование больших сил ядерного притяжения. Несмотря на малость расстояний, гравитационное притяжение между нуклонами все же слишком слабо, чтобы обеспечить стабильность ядра. Согласно Эйнштейну, полная энергия изолированной системы сохраняется, а масса является одной из форм энергии: E = mc2. Чтобы расщепить такую связанную систему, как ядро стабильного атома, на составляющие ее нейтроны и протоны, ей необходимо сообщить энергию. Это означает, что масса нейтронов и протонов превышает массу ядра на величину DM = ZMp + NMn - MA,Z, где Mp и Mn - массы свободного протона и нейтрона, а MA,Z - масса ядра с зарядом Z и массовым числом А. Эта разница масс, выраженная в единицах энергии, называется энергией связи. Коэффициент для пересчета таков: 1 а.е.м. = 931,14 МэВ, где 1 МэВ = 106 эВ. Таким образом, энергия связи EB = DMc2 есть энергия, необходимая для расщепления ядра на отдельные нейтроны и протоны. Средняя энергия связи, приходящаяся на один нуклон, EB/A, довольно регулярно изменяется с увеличением числа нуклонов в ядре (рис. 3). Самым легким ядром после протона является дейтрон 21H, расщепление которого требует энергии 2,2 МэВ, т.е. 1,1 МэВ на нуклон. Альфа-частица 42He связана гораздо сильнее, чем ее соседи: ее энергия связи составляет 28 МэВ. У ядер с массовым числом, превышающим 20, средняя энергия связи, приходящаяся на нуклон, остается почти постоянной, равной примерно 8 МэВ.
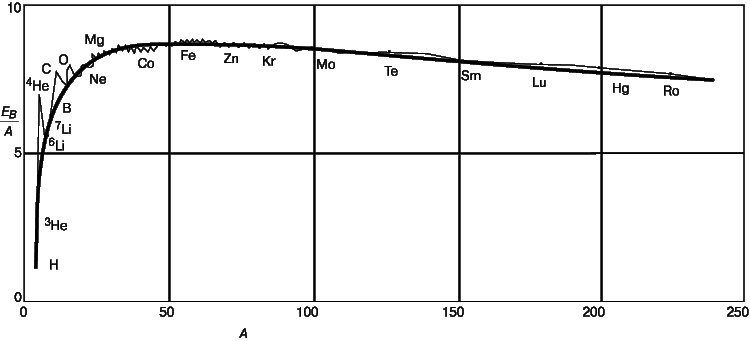
Рис. 3. СРЕДНЯЯ ЭНЕРГИЯ СВЯЗИ ЕВ/А, приходящаяся на один нуклон, зависимость от числа нуклонов в ядре А.
Энергия связи ядер на много порядков величины превышает энергию связи валентных электронов в атоме и атомов в молекуле. Чтобы удалить из атома водорода его единственный электрон, достаточно энергии 13,5 эВ; для удаления же внутренних электронов в свинце, связанных наиболее прочно, необходима энергия, равная 0,1 МэВ. Следовательно, все ядерные процессы связаны с энергиями, значительно превышающими те, с которыми мы имеем дело в обычных химических реакциях или при обычных температурах и давлениях.
Естественная радиоактивность. С явления естественной радиоактивности началась ядерная физика. Альфа-, бета- и гамма-излучения, испускаемые ураном, имеют ядерное происхождение, тогда как оптические и рентгеновские спектры соответствуют электронной структуре атома. Альфа-частицы оказались ядрами гелия. Бета-частицы по своему заряду и массе идентичны электронам оболочки атома, однако их ядерное происхождение было четко продемонстрировано изменением заряда распадающегося ядра. Кроме того, энергия гамма-излучения значительно превышает энергию, которую могут излучать электроны из внешней оболочки атома, следовательно, это проникающее излучение имеет ядерное происхождение. Некоторые встречающиеся в природе элементы с большим атомным номером (уран, торий, актиний) имеют радиоактивные изотопы, в результате распада которых образуются другие радиоактивные изотопы (такие, как радий), а в конечном итоге стабильный свинец. Время жизни "родительского" изотопа в каждом случае сравнимо с возрастом Земли, который оценивается в 10 млрд. лет. Предполагается, что в период образования Земли существовало большое число радиоактивных веществ, однако короткоживущие элементы уже давно превратились в стабильные конечные продукты. Возможно, некоторые из изотопов, которые называют "стабильными", в действительности распадаются, однако их периоды распада ("времена жизни") столь велики, что существующими методами их не удается измерить. Важная роль радиоактивности в физике ядра связана с тем, что радиоактивное излучение несет информацию о типах частиц и энергетических уровней ядра. Например, испускание альфа-частиц из ядра и относительная устойчивость образования из двух протонов и двух нейтронов косвенно указывает на возможность существования альфа-частиц внутри ядра. Различие между естественной и искусственно наведенной радиоактивностью не очень существенно для понимания строения ядра, однако изучение естественных радиоактивных рядов позволило сделать важные выводы относительно возраста Земли и использовать такие элементы в качестве источников бомбардирующих частиц задолго до того, как были изобретены ускорители частиц.
Искусственные превращения ядер. Опыты с естественно радиоактивными элементами показали, что на скорость радиоактивного распада нельзя повлиять обычными физическими средствами: теплом, давлением и т.п. Таким образом, поначалу казалось, что нет какого-либо эффективного метода исследования структуры естественно стабильных изотопов. Однако в 1919 Резерфорд обнаружил, что ядра можно расщеплять, бомбардируя их альфа-частицами. Первым расщепленным элементом был азот, который в виде газа заполнял камеру Вильсона. Альфа-частицы, испускаемые ториевым источником, сталкивались с ядрами азота, поглощались ими, в результате чего испускались быстрые протоны. При этом происходила реакция
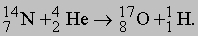
В результате такой реакции атом азота превращается в атом кислорода. В этом примере энергии связи ядер аналогичны теплу, которое выделяется при химической реакции, хотя и значительно превышают его. Впоследствии аналогичные результаты были получены и с многими другими элементами. Используя различные методы, можно измерить энергии и углы вылета испускаемых заряженных частиц, что обеспечивает проведение количественных экспериментов. Следующим шагом явилось открытие, сделанное Дж.Кокрофтом и Э.Уолтоном в 1932. Они установили, что искусственно ускоренные пучки протонов с энергией 120 кэВ (т.е. значительно меньшей, чем у альфа-частиц в опытах Резерфорда) способны вызывать расщепление атомов лития в процессе
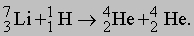
Два ядра гелия (альфа-частицы) одновременно вылетают в противоположные стороны. Причина, по которой эта реакция протекает при низкой энергии, заключается в прочной связи альфа-частиц; при добавлении протона к массе ядра 7Li сообщается энергия, которая почти равнозначна массам двух альфа-частиц. Остальная энергия, необходимая для протекания реакции, черпается из кинетической энергии бомбардирующих протонов. Все известные элементы и встречающиеся в природе изотопы могут быть "искусственным" путем превращены в соседние элементы. Все эти новые изотопы оказываются радиоактивными, однако в результате последующего распада они превращаются в стабильные изотопы. Были получены новые элементы, вплоть до элемента с порядковым номером 103; все они оказались радиоактивными с относительно коротким периодом полураспада. В настоящее время известно свыше 1000 изотопов.
Энергетические уровни ядер и ядерные модели. Изучение ядерных реакций убедительно продемонстрировало существование энергетических уровней ядер. Эти уровни представляют собой состояния ядра с определенной энергией, которым приписаны определенные квантовые числа, как и энергетическим уровням атома
(см. также АТОМА СТРОЕНИЕ). По аналогии с оптической спектроскопией исследование излучений, испускаемых ядром при переходах между энергетическими уровнями, называется ядерной спектроскопией. Однако, как можно видеть из рис. 4, расстояние между энергетическими уровнями ядер значительно больше, чем между электронными уровнями атомов, а к ядерным излучениям, кроме электромагнитного, относятся также излучения электронов, протонов, альфа-частиц и частиц других типов.
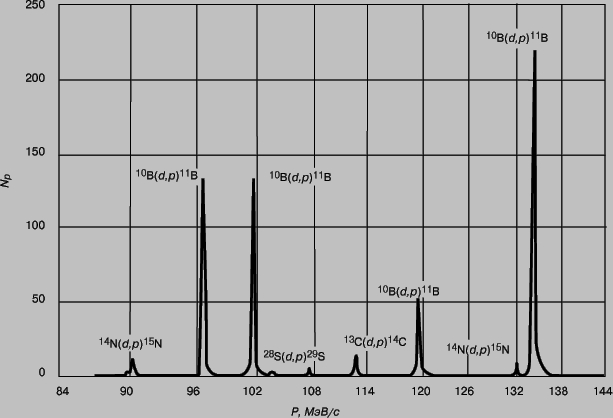
Рис. 4. СПЕКТР ПРОТОНОВ, возникающих в реакции 10В(d,p)11B. Величина NР - число протонов, Р - импульс протона. Слабые пики отвечают примесям азота, кремния и углерода.
О существовании у ядра дискретных энергетических уровней свидетельствует то, что возбуждение ядра, приводящее к испусканию излучения, происходит лишь при определенных энергиях бомбардирующих частиц, а также то, что энергии испускаемых частиц соответствуют переходам между определенными уровнями. Например, можно измерить число протонов, образующихся при бомбардировке бора-10 моноэнергетическими дейтронами в результате реакции
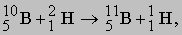
и определить их импульсы по отклонению в магнитном поле. Зарегистрированный спектр протонов из мишени, содержащей бор с примесями углерода, азота и кремния, и представлен на рис. 4. Острые, резкие пики ясно показывают, что энергия ядра квантуется подобно энергии атома. На рис. 5 приведена схема энергетических уровней ядра бор-11 (11В), причем энергии возбуждения выражены в МэВ. Неравномерность распределения ядерных энергетических уровней, не характерная для распределения атомных энергетических уровней, обусловлена более плотной упаковкой ядер и более сильным взаимодействием частиц внутри ядра. С возбужденных уровней, отвечающих ядру 10В, бомбардируемому дейтронами с энергией 1,51 МэВ, могут происходить переходы на любой из уровней, расположенных ниже, сопровождаемые испусканием протонов. Если после испускания протона ядро 11В остается в возбужденном состоянии, оно может затем распадаться, переходя в наинизшее, "основное" состояние с испусканием одного или нескольких гамма-квантов.
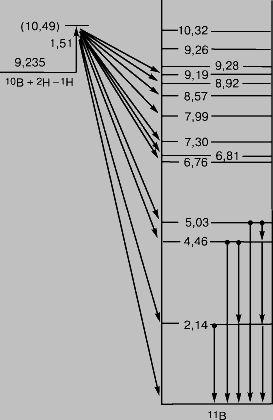
Рис. 5. УРОВНИ ЭНЕРГИИ ЯДРА 11В. Энергия возбуждения ядра 11В выражена в МэВ.
В настоящее время последовательное и единое объяснение причин возникновения энергетических уровней ядер отсутствует, но есть ряд теорий, позволяющих объяснить некоторые явления. Одна из них - "модель оболочек", которая, заимствовав из атомной физики представление об оболочечном строении атома, применила ее к анализу конфигураций нейтронов и протонов внутри ядра. В 1932 Дж.Бартлетт заметил, что все стабильные ядра, расположенные между 4He и 16О, относятся к последовательности 4He + n + p + n + p + ... , тогда как между 16О и 36Аr аналогичная последовательность приобретает вид 16O + n + n + p + p + n + n + ... . Он высказал предположение, что эти изменения в последовательности отражают порядок заполнения оболочек нейтронами и протонами. Принцип запрета Паули действует в случае ядерных частиц точно так же, как и в случае электронов, а в модели оболочек он приводит к тому, что на первой оболочке могут находиться только два протона и два нейтрона, на второй - по шести обеих частиц (заполнена у 16О) и на третьей по десяти (заполнена у 36Аr). Наличие периодичности в структуре ядер проявляется и дальше, хотя и с некоторыми отступлениями. Существование определенных "магических чисел" (2, 8, 20, 28, 50, 82 и 126) нейтронов и протонов в ядрах, которым соответствуют пики кривой энергии связи, можно объяснить на основе модифицированной модели оболочек (называемой моделью независимых частиц), которая позволяет правильно предсказывать спины и магнитные моменты ядер. Например, спины ядер с заполненными оболочками, как и предсказывает эта модель, равны нулю. Однако несмотря на многие достоинства, имеющиеся варианты модели оболочек все же не объясняют всех ядерных явлений, что неудивительно ввиду сложной структуры ядра. Составное ядро и модель капли. В более тяжелых ядрах число нуклонов настолько велико, что многие наблюдаемые закономерности поведения этих ядер лучше всего воспроизводятся моделью капли. Эту модель предложил в 1936 Н.Бор, чтобы объяснить большие времена жизни возбужденных ядер, образующихся при захвате медленных нейтронов. (В данном случае под временем жизни понимается время с момента возбуждения ядра до момента потери им энергии возбуждения в результате испускания излучения.) Времена жизни оказались в миллион раз больше времени, необходимого нейтрону, чтобы пересечь ядро (10-22 с). Это свидетельствует о том, что возбужденное ядро представляет собой некую систему ("составное ядро"), время существования которой намного больше времени ее образования. Бор высказал предположение, что ядерная реакция протекает в две стадии. На первой падающая частица входит в ядро-мишень, образуя "составное ядро", где в многочисленных столкновениях теряет свою первоначальную энергию, распределяя ее среди других нуклонов ядра. В результате ни у одной из частиц не оказывается энергии, необходимой для вылета из ядра. Вторая стадия, распад составного ядра, происходит спустя некоторое время, когда энергия случайно сконцентрируется на одной из частиц или потеряется в виде гамма-излучения. Считается, что вторая стадия не зависит от деталей механизма образования составного ядра. Вид распада определяется лишь игрой возможных вариантов. В качестве простой аналогии этой картине ядерной реакции Бор предложил рассмотреть поведение капли. Между молекулами такой капли действуют силы, связывающие их друг с другом и препятствующие испарению, пока не будет подведено тепло извне. Появление еще одной молекулы, обладающей дополнительной кинетической энергией, приводит в результате ее статистического перераспределения к увеличению температуры капли как целого. Спустя некоторое время случайная концентрация энергии на какой-либо молекуле может привести к ее испарению. Теория Бора была детально разработана и позволила построить последовательную картину разнообразных ядерных реакций, в том числе реакций под действием нейтронов и заряженных частиц промежуточных энергий (вплоть до 100 МэВ). Полезными оказались введенные по аналогии понятия ядерной температуры, удельной теплоемкости и испарения частиц. Например, угловое распределение "испарившихся" частиц оказалось не зависящим от направления падающей частицы, т.е. изотропным, поскольку вся информация о первоначальном направлении теряется на стадии существования составного ядра. Капельная модель оказалась особенно ценной при объяснении явления деления ядер, когда для развала ядра урана на две примерно равные части с большим выделением энергии достаточно поглощения одного медленного нейтрона. Электростатическое отталкивание протонов вызывает некоторую нестабильность ядра, которая обычно перекрывается за счет ядерных сил, обеспечивающих энергию связи. Но при повышении ядерной температуры сферической "капли" в ней могут возникнуть колебания, в результате которых капля деформируется в эллипсоид. Если деформация ядра будет продолжаться, то электростатическое отталкивание двух его положительно заряженных половин может возобладать, и тогда произойдет его деление.
Размеры и форма ядра. Впервые размеры ядра правильно оценил Резерфорд, использовав для этой цели рассеяние альфа-частиц. Его первые эксперименты показали, что размеры заряженной части ядра - порядка 10-14 м. Более поздние и более точные эксперименты позволили установить, что радиус ядра приблизительно пропорционален А1/3 и, следовательно, плотность ядерного вещества почти постоянна. (Она колоссальна: 100 000 т/мм3.) С открытием нейтрона стало ясно, что он представляет собой идеальное средство исследования ядра, поскольку нейтральные частицы, проходя на значительном удалении от ядра, не испытывают отклонения под действием заряда ядра. Другими словами, нейтрон сталкивается с ядром, если расстояние между их центрами оказывается меньше суммы их радиусов, а в противном случае не отклоняется. Опыты по рассеянию пучка нейтронов показали, что радиус ядра (в предположении сферической формы) равен: R = r0A1/3, где r0 АТОМНОГО ЯДРА СТРОЕНИЕ 1,4*10 -15 м. Таким образом, радиус ядра урана-238 равен 8,5*10 -15 м. Полученное значение соответствует радиусу действия ядерных сил; оно характеризует расстояние от центра ядра, на котором внешний нейтральный нуклон начинает впервые "ощущать" его воздействие. Такая величина радиуса ядра сравнима с расстоянием от центра ядер, на котором происходит рассеяние альфа-частиц и протонов. Рассеяние альфа-частиц, протонов и нейтронов на ядрах обусловлено действием ядерных сил; следовательно, такие измерения радиусов ядер дают оценку радиуса действия ядерных сил. Взаимодействие же электронов с ядрами почти полностью определяется электрическими силами. Поэтому рассеяние электронов можно использовать для изучения формы распределения заряда в ядре. Эксперименты с электронами очень высоких энергий, проведенные Р.Хофстедтером в Станфордском университете, дали детальную информацию о распределении положительного заряда по радиусу ядра. На рис. 6 представлено угловое распределение рассеянных ядрами золота электронов с энергией 154 МэВ. Верхняя кривая характеризует угловое распределение, рассчитанное в предположении, что положительный заряд сконцентрирован в точке; очевидно, что экспериментальные данные этому предположению не соответствуют. Гораздо лучшее согласие достигается в предположении о равномерном распределении протонов по объему ядра (нижняя кривая). Однако "радиус заряда" оказывается примерно на 20% меньше радиуса "ядерных сил", полученного на основе данных по рассеянию нейтронов. Это может означать, что распределение протонов в ядре отличается от распределения нейтронов.
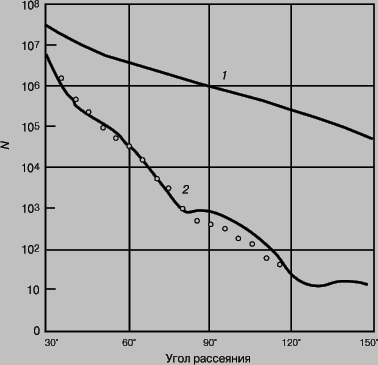
Рис. 6. УГЛОВОЕ РАСПРЕДЕЛЕНИЕ для рассеяния электронов с энергией 154 МэВ на ядрах золота. N - число рассеянных электронов; 1 - рассеяние на точечном заряде, 2 - рассеяние на равномерно распределенном заряде.
Ядерные силы и мезоны. Малый радиус действия ядерных сил впервые отчетливо обнаружился уже в опытах по рассеянию Резерфорда. Альфа-частицы, приближавшиеся к центру ядра до 10-14 м, испытывали действие сил, знак и величина которых отличались от обычного электростатического отталкивания. Более поздние эксперименты с применением нейтронов показали, что между всеми нуклонами существуют большие короткодействующие силы. Эти силы отличны от хорошо известных электростатических и гравитационных сил, не исчезающих даже на очень больших расстояниях. Ядерные силы являются силами притяжения, что прямо следует из факта существования устойчивых ядер, вопреки электростатическому отталкиванию находящихся в них протонов. Ядерные силы между любой парой нуклонов (нейтронов и протонов) - одни и те же; это показывает сравнение энергетических уровней "зеркальных ядер", отличающихся друг от друга тем, что в них протоны заменены нейтронами и наоборот. В пределах своего радиуса действия ядерные силы достигают очень большой величины. Электростатическая потенциальная энергия двух протонов, находящихся на расстоянии 1,5*10 -15 м друг от друга, составляет всего лишь 1 МэВ, что в 40 раз меньше ядерной потенциальной энергии. Ядерные силы также обнаруживают насыщение, поскольку данный нуклон в состоянии взаимодействовать лишь с ограниченным числом других нуклонов. Отсюда быстрый первоначальный рост (с увеличением А) средней энергии связи, приходящейся на один нуклон (рис. 3), и относительное постоянство этой энергии в дальнейшем. (Если бы каждый нуклон взаимодействовал со всеми нуклонами в ядре, то энергия связи, приходящаяся на один нуклон, все время росла бы пропорционально А.) Пока что нет удовлетворительной теории ядерных сил, и проблема интенсивно изучается экспериментально и теоретически. Однако многие идеи, лежащие в основе "мезонной теории ядерных сил", опубликованной в 1935 Х.Юкавой, оказались в согласии с экспериментальными фактами. Юкава выдвинул гипотезу, что притяжение, удерживающее нуклоны внутри ядра, возникает благодаря наличию "квантов" некоего поля, аналогичных фотонам (световым квантам) электромагнитного поля и обеспечивающих взаимодействие электрических зарядов. Из квантовой теории поля следует, что радиус действия силы обратно пропорционален массе соответствующего кванта; в случае электромагнитного поля масса квантов - фотонов - равна нулю, и радиус действия сил бесконечен. Масса квантов ядерного поля (названных "мезонами"), вычисленная по экспериментально измеренному радиусу действия ядерных сил, оказалась примерно в 200 раз больше массы электрона. Положение теории Юкавы упрочилось после того, как К.Андерсон и С. Неддермейер открыли в 1936 новую частицу с массой примерно 200 электронных масс (ныне именуемую мюоном), которую они обнаружили с помощью камеры Вильсона в космических лучах. (В 1932 Андерсон открыл "позитрон", положительный электрон.) Вначале казалось, что кванты ядерных сил найдены, однако проведенные затем эксперименты обнаружили обескураживающее обстоятельство: "ключ к ядерным силам" не взаимодействует с ядрами! Эта запутанная ситуация прояснилась лишь после того, как в 1947 С.Пауэлл обнаружил частицу с подходящей массой, которая взаимодействует с ядрами. Эта частица (названная пи-мезоном, или пионом) оказалась нестабильной и самопроизвольно распадалась, превращаясь в мюон. Пи-мезон подходил на роль частицы Юкавы, и его свойства были во всех деталях изучены физиками, использовавшими для этих целей космические лучи и современные ускорители. Хотя существование пи-мезонов и ободрило сторонников теории Юкавы, на ее основе оказалось весьма трудно правильно предсказать такие детальные свойства ядерных сил, как их насыщение, энергии связи и энергии ядерных уровней. Трудности математического характера не позволили точно установить, что именно предсказывает эта теория. Ситуация еще более усложнилась после открытия новых типов мезонов, которые, как считается, имеют отношение к ядерным силам.
См. также
ЛИТЕРАТУРА
Айзенбуд Л., Вигнер Е. Структура ядра. М., 1959 Престон М. Физика ядра. М., 1964 Кук Ш. Структура атомных ядер. М., 1967 Лейн А. Теория ядра. М., 1967 Федянин В. К. Электромагнитная структура ядер и нуклонов. М., 1967 Широков Ю.М., Юдин Н.П. Ядерная физика. М., 1980 Робертсон Б. Современная физика в прикладных науках. М., 1985
Полезные сервисы
атомное оружие
Энциклопедический словарь
А́томное ору́жие - см. Ядерное оружие.
* * *
АТОМНОЕ ОРУЖИЕ - А́ТОМНОЕ ОРУ́ЖИЕ, см. Ядерное оружие (см. ЯДЕРНОЕ ОРУЖИЕ).
Полезные сервисы
атомное ядро
Энциклопедический словарь
А́томное ядро́ - см. Ядро атомное.
* * *
АТОМНОЕ ЯДРО - А́ТОМНОЕ ЯДРО́, см. Ядро атомное (см. ЯДРО АТОМНОЕ).
Большой энциклопедический словарь
АТОМНОЕ ЯДРО - см. Ядро атомное.
Иллюстрированный энциклопедический словарь
Идеография
▲ основа
↑ атом
ядро атома. ядерный.
нуклиды: изотоп. изобар. изотон.
гипер - ядро.
массовое число.
магические ядра.
дейтрон. тритон.
протий. дейтерий. тритий.
масс - спектрометр. масс - спектроскопия.
↓ радиоактивность, химический элемент
Полезные сервисы
атомной энергии институт
Энциклопедический словарь
АТОМНОЙ ЭНЕРГИИ ИНСТИТУТ - А́ТОМНОЙ ЭНЕ́РГИИ ИНСТИТУ́Т им. И. В. Курчатова, в 1992 преобразован в Российский научный центр «Курчатовский институт».
Большой энциклопедический словарь
АТОМНОЙ ЭНЕРГИИ ИНСТИТУТ им. И. В. Курчатова - в 1992 преобразован в Российский научный центр "Курчатовский институт".
Полезные сервисы
атомность
Толковый словарь Ушакова
АТО́МНОСТЬ, атомности, мн. нет, жен. (хим.). Способность атома одного элемента вступать в соединение с тем или иным количеством атомов водорода; то же, что валентность.
Синонимы к слову атомность
Словарь галлицизмов русского языка
АТОМНОСТЬ и, ж. atome m.
1. хим. См. Валентность. СИС 1954.
2. Дискретность реальности? Жерар создал теорию типов, которой Вюрц противопоставил понятие об атомности (atomicité). ИВ 1881 9 105. - Лекс. Мак. 1908: Ато/мность; Щерба: а/томность.
Полезные сервисы
атомность или валентность
атомные радиусы
Энциклопедический словарь
А́томные ра́диусы - характеристики, позволяющие приближённо оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. Атомные радиусы имеют порядок 0,1 нм. Определяются главным образом из данных рентгеновского структурного анализа.
* * *
АТОМНЫЕ РАДИУСЫ - А́ТОМНЫЕ РА́ДИУСЫ, характеристики, позволяющие приближенно оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах.
Под эффективным радиусом атома или иона понимается радиус сферы его действия, причем атом (ион) считается несжимаемым шаром. Используя планетарную модель атома, его представляют как ядро, вокруг которого по орбиталям (см. ОРБИТАЛИ) вращаются электроны. Последовательность элементов в Периодической системе Менделеева соответствует последовательности заполнения электронных оболочек. Эффективный радиус иона зависит от заполненности электронных оболочек, но он не равен радиусу наружной орбиты. Для определения эффективного радиуса представляют атомы (ионы) в структуре кристалла как соприкасающиеся жесткие шары, так что расстояние между их центрами равно сумме радиусов. Атомные и ионные радиусы определены экспериментально по рентгеновским измерениям межатомных расстояний и вычислены теоретически на основе квантово-механических представлений.
Размеры ионных радиусов подчиняются следующим закономерностям:
1. Внутри одного вертикального ряда периодической системы радиусы ионов с одинаковым зарядом увеличиваются с возрастанием атомного номера, поскольку растет число электронных оболочек, а значит, и размер атома.
2. Для одного и того же элемента ионный радиус возрастает с увеличением отрицательного заряда и уменьшается с увеличением положительного заряда. Радиус аниона больше радиуса катиона, поскольку у аниона имеется избыток электронов, а у катиона - недостаток. Например, у Fe, Fe2+, Fe3+ эффективный радиус равен 0,126, 0,080 и 0,067 нм соответственно, у Si4-, Si, Si4+ эффективный радиус равен 0,198, 0,118 и 0,040 нм.
3. Размеры атомов и ионов следуют периодичности системы Менделеева; исключения составляют элементы от № 57 (лантан) до №71 (лютеций), где радиусы атомов не увеличиваются, а равномерно уменьшаются (так называемое лантаноидное сжатие), и элементы от № 89 (актиний) и дальше (так называемое актиноидное сжатие).
Атомный радиус химического элемента зависит от координационного числа (см. КООРДИНАЦИОННОЕ ЧИСЛО). Увеличение координационного числа всегда сопровождается увеличением межатомных расстояний. При этом относительная разность значений атомных радиусов, соответствующих двум разным координационным числам, не зависит от типа химической связи (при условии, что тип связи в структурах со сравниваемыми координационными числами одинаков). Изменение атомных радиусов с изменением координационного числа существенно сказывается на величине объемных изменений при полиморфных превращениях. Например, при охлаждении железа, его превращение из модификации с гранецентрированной кубической решеткой в модификацию с объемно-центрированной кубической решеткой имеющее место при 906 оС, должно сопровождаться увеличением объема на 9%, в действительности увеличение объема составляет 0,8%. Это связано с тем, что за счет изменения координационного числа от 12 до 8 атомный радиус железа уменьшается на 3%. Т. е., изменение атомных радиусов при полиморфных превращениях в значительной степени компенсируют те объемные изменения, которые должны были бы произойти, если бы при этом не менялся атомный радиус. Атомные радиусы элементов можно сопоставлять только при одинаковом координационном числе.
Атомные (ионные) радиусы зависят также от типа химической связи.
В кристаллах с металлической связью (см. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ) атомный радиус определяется как половина межатомного расстояния между ближайшими атомами. В случае твердых растворов (см. ТВЕРДЫЕ РАСТВОРЫ) металлические атомные радиусы меняются сложным образом.
Под ковалентными радиусами элементов с ковалентной связью понимают половину межатомного расстояния между ближайшими атомами, соединенными единичной ковалентной связью. Особенностью ковалентных радиусов является их постоянство в разных ковалентных структурах с одинаковыми координационными числами. Так, расстояния в одинарных связях С-С в алмазе и насыщенных углеводородах одинаковы и равны 0,154 нм.
Ионные радиусы в веществах с ионной связью (см. ИОННАЯ СВЯЗЬ) не могут быть определены как полусумма расстояний между ближайшими ионами. Как правило, размеры катионов и анионов резко различаются. Кроме того, симметрия ионов отличается от сферической. Существует несколько подходов к оценке величины ионных радиусов. На основании этих подходов оценивают ионные радиусы элементов, а затем из экспериментально определенных межатомных расстояний определяют ионные радиусы других элементов.
Ван-дер-ваальсовы радиусы определяют эффективные размеры атомов благородных газов. Кроме того, ван-дер-ваальсовыми атомными радиусами считают половину межъядерного расстояния между ближайшими одинаковыми атомами, не связанными между собой химической связью, т.е. принадлежащими разным молекулам (например, в молекулярных кристаллах).
При использовании в расчетах и построениях величин атомных (ионных) радиусов их значения следует брать из таблиц, построенных по одной системе.
Большой энциклопедический словарь
АТОМНЫЕ РАДИУСЫ - характеристики, позволяющие приближенно оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. Определяются главным образом из данных рентгеновского структурного анализа.
Полезные сервисы
атомные спектры
Энциклопедический словарь
А́томные спе́ктры - оптические спектры свободных или слабо связанных атомов (одноатомных газов, паров), возникающие при излучательных квантовых переходах. Атомные спектры - линейчатые, состоят из отдельных спектральных линий, которые характеризуются определенной длиной волны и для простых атомов группируются в спектральные серии. Содержат информацию о строении атомов.
* * *
АТОМНЫЕ СПЕКТРЫ - А́ТОМНЫЕ СПЕ́КТРЫ, оптические спектры свободных или слабо связанных атомов (одноатомных газов, паров). Обусловлены квантовыми переходами (см. КВАНТОВЫЕ ПЕРЕХОДЫ) атома. Атомные спектры - линейчатые, состоят из отдельных спектральных линий (см. СПЕКТРАЛЬНЫЕ ЛИНИИ), которые характеризуются определенной длиной волны и для простых атомов группируются в спектральные серии. Содержат информацию о строении атомов, используются также в спектральном анализе.
Большой энциклопедический словарь
АТОМНЫЕ СПЕКТРЫ - оптические спектры свободных или слабо связанных атомов (одноатомных газов, паров). Обусловлены квантовыми переходами атома. Атомные спектры - линейчатые, состоят из отдельных спектральных линий, которые характеризуются определенной длиной волны и для простых атомов группируются в спектральные серии. Содержат информацию о строении атомов, используются также в спектральном анализе.
Иллюстрированный энциклопедический словарь
АТОМНЫЕ СПЕКТРЫ, спектры испускания, поглощения и рассеяния свободных или слабо связанных атомов. Содержат информацию о состояниях, свойствах и строении атомов, используются для спектрального анализа вещества.
Полезные сервисы
атомные часы
Энциклопедический словарь
А́томные часы́ - то же, что квантовые часы.
* * *
АТОМНЫЕ ЧАСЫ - А́ТОМНЫЕ ЧАСЫ́, то же, что квантовые часы (см. КВАНТОВЫЕ ЧАСЫ).
Большой энциклопедический словарь
АТОМНЫЕ ЧАСЫ - то же, что квантовые часы.
Иллюстрированный энциклопедический словарь
АТОМНЫЕ ЧАСЫ, смотри Квантовые часы.
Полезные сервисы
атомный
Толковый словарь
прил.
1. соотн. с сущ. атом I, связанный с ним
2. Свойственный атому [атом I], характерный для него.
3. Связанный с высвобождением и использованием атомной [атомный 3.] энергии, внутренней энергии ядра атома [атом I].
А́ТОМНЫЙ - прил., употр. сравн. часто
1. Атомным называется всё то, что связано с атомом (мельчайшей частицей химического элемента, сохраняющей его качества).
Атомное ядро. | Атомная масса.
2. Атомная энергия вырабатывается за счёт ядерной реакции, выделяющей много тепла.
Использовать атомную энергию.
3. Атомным называется любое техническое устройство, связанное с получением и использованием ядерной энергии.
Атомная электростанция. | Атомная подводная лодка.
4. Атомная бомба - это бомба огромной разрушительной силы, в которой происходит ядерная реакция.
5. В жаргоне атомной ценой называют очень высокую цену какого-либо товара.
Толковый словарь Ушакова
А́ТОМНЫЙ, атомная, атомное (хим.). прил. к атом. Атомный вес.
Толковый словарь Ожегова
Энциклопедический словарь
А́ТОМНЫЙ -ая, -ое.
1. к Атом. к А́том. А. номер (порядковый номер химического элемента в периодической таблице Менделеева). Относительная атомная масса (отношение массы атома элемента к 1/12 массы атома углерода). А-ая энергия (=я́дерная).
2. Связанный с высвобождением и использованием ядерной энергии. А-ая электростанция (работающая на ядерном топливе). А. ледокол (ледокол-атомоход). А-ое оружие (ядерное оружие). А-ая война (ядерная война).
3. Разг. Ошеломляющий, потрясающий. А-ая смесь (о чём-л. совершенно несовместимом). Анекдот просто а.! А-ые цены (непомерно высокие).
Академический словарь
-ая, -ое.
прил. к атом.
Атомный вес. Атомное ядро. Атомная энергия.
||
Связанный с использованием атомной энергии.
Атомная электростанция. Атомный ледокол. Атомное оружие.
Словарь русского арго
АТОМНЫЙ, -ая, -ое.
Ярко выраженный, бросающийся в глаза, броский, выдающийся. Атомная жопа! Атомные бабки! (деньги).
Орфографический словарь
Словарь ударений
A/ пр; 109 см. Приложение II
Ракетодромами гремя,
дождями а́томными рея,
Плевало время на меня,
плюю на время!
А. А. Вознесенский, Монолог битника
Сведения о старой норме ударения:
Иногда можно услышать данное слово с ударением ато́мный. Это старая норма (от устаревшего ато́м), которую еще недавно предписывали некоторые словари. Такое ударение встречается и в стихах:
Век ато́мный стонет в спальне…
(Я ору. И, матерясь,
Мой напарник, как ошпаренный,
Садится на матрас.)
А. А. Вознесенский, Нью-йоркская птица
Трудности произношения и ударения
Синонимы к слову атомный
прил., кол-во синонимов: 11
валентный (1)
замечательный (107)
кайфовый (54)
классный (74)
клевый (42)
отличный (178)
первый сорт (63)
попсовый (19)
хипповый (16)
хороший (286)
ядерный (17)
Тезаурус русской деловой лексики
Морфемно-орфографический словарь
Грамматический словарь
Новый словарь иностранных слов
а́томный
- свойственный атому, относящийся к атому; а-ная масса - масса атома какого-л, хим. элемента, выраженная в атомных единицах массы; а-ная единица массы - единица массы, равная v12 части массы изотопа углерода **с (т. наз. углеродная шкала); а. номер- порядковый номер хим. элемента в периодической системе алементов Менделеева, равен числу протонов в атомном ядре и определяет хим. и большинство физ. свойств атома; а-ное ядро - центральная часть атома, обладающая положительным зарядом и практически несущая всю массу атома; состоит из протонов и нейтронов, сумма которых определяет массу а-ного ядра, а число протонов - его заряд и а. номер; а-ная физика - раздел физики, в котором изучаются свойства атомов и их взаимодействия с другими частицами; а-ные спектры - оптические спектры излучений одноатомных газов и паров; а-ные пучки - см. молекулярные пучки; а-ные часы - точнейшее устройство для измерения времени, основанное на применении высокостабильных частот излучения, испускаемого односортными атомами вещества; а-ная энергия (точнее ядерная энергия) - энергия, выделяемая при нек-рых превращениях а-ных ядер; а-ное оружие (точнее ядерное оружие) - оружие, основанное на использовании внутриядерной энергии, освобождение которой при цепной ядерной или термоядерной реакции происходит в виде мощного взрыва; а-ная батарея - источник электрического тока, в котором энергия, выделяющаяся при радиоактивном распаде, преобразуется в электрическую; а-ная электростанция (аэс) - электростанция, в которой электрический ток вырабатывается за счет тепла от ядерных реакторов; а-ный (ядерный) барьер- заграждения, создаваемые в результате применения ядерного оружия с целью воспрепятствования маневру войск противника и подвозу им средств материального и технического обеспечения.
Словарь галлицизмов русского языка
АТОМНЫЙ ая, ое. atome m.
1. Отн. к атому, распаду атомного ядра. Мир - рванулся в опытах Кюри, АтОмный, лопнувшей бомбой. 1921. А. Белый Первое свидание. // Душенко 36. Над мойкой кран, и капает вода, Озвучив времени ато/мный бег. И. Лиснянская Ветер покоя. // НМ 1995 5 9.
2. жарг. Очень крепкий, сильный. Ну, а чай, прямо тебе скажу, "атомный", потому что в ту кружку-кастрюлю было всыпана по крайней мере пачка. Г. Обухов Конфиск. письма. // Звезда 1995 6 25.
3. подр., мол. Выдающийся; из ряда вон выходящий. А. женщина, часы, баба. Юганово 1997.
- Лекс. Брокг. атомный; Уш. 1935: ато/мный; СИС 1937: а/томный.
Полезные сервисы
атомный (ядерный) погреб
атомный номер
Энциклопедический словарь
А́томный но́мер - порядковый номер, Z, номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре и определяет химические и большинство физических свойств атома.
* * *
АТОМНЫЙ НОМЕР - А́ТОМНЫЙ НО́МЕР (порядковый номер), Z, номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре и определяет химические и большинство физических свойств атома.
Большой энциклопедический словарь
АТОМНЫЙ НОМЕР (порядковый номер) - Z, номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре и определяет химические и большинство физических свойств атома.
Иллюстрированный энциклопедический словарь
АТОМНЫЙ НОМЕР, порядковый номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре, определяет химические и большинство физических свойств атома.
Полезные сервисы
атомный реактор
Энциклопедический словарь
А́томный реа́ктор - то же, что ядерный реактор.
* * *
АТОМНЫЙ РЕАКТОР - А́ТОМНЫЙ РЕА́КТОР, то же, что ядерный реактор (см. ЯДЕРНЫЙ РЕАКТОР).
Большой энциклопедический словарь
АТОМНЫЙ РЕАКТОР - то же, что ядерный реактор.
Иллюстрированный энциклопедический словарь
Полезные сервисы
атомный флот
Энциклопедический словарь
А́томный флот - совокупность гражданских судов и военных кораблей различного класса и назначения, имеющих в качестве главного источника энергии ядерные силовые установки.
* * *
АТОМНЫЙ ФЛОТ - А́ТОМНЫЙ ФЛОТ, совокупность гражданских судов и военных кораблей различного назначения, имеющих в качестве главного источника энергии ядерные силовые установки (см. ЯДЕРНАЯ СИЛОВАЯ УСТАНОВКА).
Большой энциклопедический словарь
АТОМНЫЙ ФЛОТ - совокупность гражданских судов и военных кораблей различного назначения, имеющих в качестве главного источника энергии ядерные силовые установки.