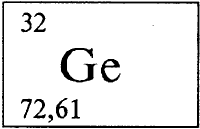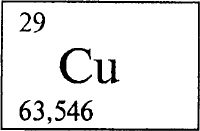МЕДЬ -и; ж.
1. Химический элемент (Сu), ковкий металл желтого цвета с красноватым отливом (широко применяется в промышленности). Добыча меди. Надраить м. самовара. Изготовить из меди котелок.
2. собир. Изделия из этого металла. Вся м. в подвале позеленела. / О музыкальных инструментах из такого металла (преимущественно духовых). М. оркестра.
3. собир. Разг. Монеты из такого металла. Дать сдачу медью. В кошельке одна м.
4. обычно чего. Красновато-желтый, цвета такого металла. Осенняя м. листьев. Любоваться медью заката.
5. Звонкий, низкий, отчётливый (о звуках). Слушать м. колоколов. В голосе звучала м.
◁ Ме́дный (см.).
* * *
медь (лат. Cuprum), химический элемент I группы периодической системы. Металл красного (в изломе розового) цвета, ковкий и мягкий; хороший проводник тепла и электричества (уступает только серебру); плотность 8,92 г/см3, tпл 1083,4°C. Химически малоактивна; в атмосфере, содержащей CO2, пары Н2O и др., покрывается патиной - зеленоватой плёнкой основного карбоната (ядовит). Из минералов важны борнит, халькопирит, халькозин, ковеллин, малахит; встречается также самородная медь. Главное применение - производство электрических проводов. Из меди изготовляют теплообменники, трубопроводы. Более 30% меди идёт на сплавы.
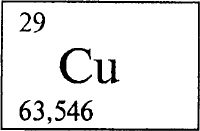
* * *
МЕДЬ - МЕДЬ (лат. Cuprum), Cu (читается «купрум»), химический элемент с атомным номером 29, атомная масса 63,546. Латинское название меди происходит от названия острова Кипра (Cuprus), где в древности добывали медную руду; однозначного объяснения происхождения этого слова в русском языке нет.
Природная медь состоит из двух стабильных нуклидов (см. НУКЛИД) 63Cu (69,09% по массе) и 65Cu (30,91%). Конфигурация двух внешних электронных слоев нейтрального атома меди 3s2p6d104s1. Образует соединения в степенях окисления +2 (валентность II) и +1 (валентность I), очень редко проявляет степени окисления +3 и +4.
В периодической системе Менделеева медь расположена в четвертом периоде и входит в группу IВ, к которой относятся такие благородные металлы, как серебро (см. СЕРЕБРО) и золото (см. ЗОЛОТО (химический элемент)).
Радиус нейтрального атома меди 0,128 нм, радиус иона Cu+ от 0,060 нм (координационное число 2) до 0,091 нм (координационное число 6), иона Cu2+ - от 0,071 нм (координационное число 2) до 0,087 нм (координационное число 6). Энергии последовательной ионизации атома меди 7,726, 20,291, 36,8, 58,9 и 82,7 эВ. Сродство к электрону 1,8 эВ. Работа выхода электрона 4,36 эВ. По шкале Полинга электроотрицательность меди 1,9; медь принадлежит к числу переходных металлов. Стандартный электродный потенциал Cu/Cu2+ 0,339 В. В ряду стандартных потенциалов медь расположена правее водорода и ни из воды, ни из кислот водорода не вытесняет.
Простое вещество медь - красивый розовато-красный пластичный металл.
Нахождение в природе
В земной коре содержание меди составляет около 5·10-3 % по массе. Очень редко медь встречается в самородном виде (см. МЕДЬ САМОРОДНАЯ) (самый крупный самородок в 420 тонн найден в Северной Америке). Из руд наиболее широко распространены сульфидные руды: халькопирит (см. ХАЛЬКОПИРИТ), или медный колчедан, CuFeS2 (30% меди), ковеллин (см. КОВЕЛЛИН) CuS (64,4% меди), халькозин (см. ХАЛЬКОЗИН), или медный блеск, Cu2S (79,8% меди), борнит (см. БОРНИТ) Cu5FeS4.(52-65% меди). Существует также много и оксидных руд меди, например: куприт (см. КУПРИТ) Cu2O, (81,8% меди), малахит (см. МАЛАХИТ) CuCO3·Cu(OH)2 (57,4% меди) и другие. Известно 170 медьсодержащих минералов, из которых 17 используются в промышленных масштабах.
Различных руд меди много, а вот богатых месторождений на земном шаре мало, к тому же медные руды добывают уже многие сотни лет, так что некоторые месторождения полностью исчерпаны. Часто источником меди служат полиметаллические руды, в которых, кроме меди, присутствуют железо, цинк, свинец, и другие металлы. Как примеси медные руды обычно содержат рассеянные элементы (см. РАССЕЯННЫЕ ЭЛЕМЕНТЫ) (кадмий, селен, теллур, галий, германий и другие), а также серебро, а иногда и золото. Для промышленных разработок используют руды, в которых содержание меди составляет немногим более 1% по массе, а то и менее.
В морской воде содержится примерно 1·10-8 % меди.
Получение
Промышленное получение меди - сложный многоступенчатый процесс. Добытую руду дробят, а для отделения пустой породы используют, как правило, флотационный метод обогащения. Полученный концентрат (содержит 18-45% меди по массе) подвергают обжигу в печи с воздушным дутьем. В результате обжига образуется огарок - твердое вещество, содержащее, кроме меди, также и примеси других металлов. Огарок плавят в отражательных печах или электропечах. После этой плавки, кроме шлака, образуется так называемый штейн (см. ШТЕЙН (в металлургии)) , в котором содержание меди составляет до 40-50%.
Далее штейн подвергают конвертированию - через расплавленный штейн продувают сжатый воздух, обогащенный кислородом. В штейн добавляют кварцевый флюс (песок SiO2). В процессе конвертирования содержащийся в штейне как нежелательная примесь сульфид железа FeS переходит в шлак и выделяется в виде сернистого газа SO2:
2FeS + 3O2 + 2SiO2 = 2FeSiO3 + 2SO2
Одновременно сульфид меди(I) Cu2S окисляется:
2Cu2S + 3О2 = 2Cu2О + 2SO2
Образовавшийся на этой стадии Cu2О далее реагирует с Cu2S:
2Cu2О + Cu2S = 6Cu + SО2
В результате возникает так называемая черновая медь, в которой содержание самой меди составляет уже 98,5-99,3% по массе. Далее черновую медь подвергают рафинированию. Рафинирование на первой стадии - огневое, оно заключается в том, что черновую медь расплавляют и через расплав пропускают кислород. Примеси более активных металлов, содержащихся в черновой меди, активно реагируют с кислородом и переходят в оксидные шлаки.
На заключительной стадии медь подвергают электрохимическому рафинированию в сернокислом растворе, при этом черновая медь служит анодом, а очищенная медь выделяется на катоде. При такой очистке примеси менее активных металлов, присутствовавшие в черновой меди, выпадают в осадок в виде шлама (см. ШЛАМ), а примеси более активных металлов остаются в электролите. Чистота рафинированной (катодной) меди достигает 99,9% и более.
Физические и химические свойства
Кристаллическая решетка металлической меди кубическая гранецентрированная, параметр решетки а = 0,36150 нм. Плотность 8,92 г/см3, температура плавления 1083,4 °C, температура кипения 2567 °C. Медь среди всех других металлов обладает одной из самых высоких теплопроводностей и одним из самых низких электрических сопротивлений (при 20 °C удельное сопротивление 1,68·10-3 Ом·м).
В сухой атмосфере медь практически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3. Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения меди. Такая пленка, возникающая с течением времени на изделиях из меди и ее сплавов, называется патиной. Патина предохраняет металл от дальнейшего разрушения. Для создания на художественных предметах «налета старины» на них наносят слой меди, который затем специально патинируется.
При нагревании на воздухе медь тускнеет и в конце концов чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем - оксид CuO.
Красновато-коричневый оксид меди(I) Cu2O при растворении в бромо- и иодоводородной кислотах образует, соответственно, бромид меди(I) CuBr и иодид меди(I) CuI. При взаимодействии Cu2O с разбавленной серной кислотой возникают медь и сульфат меди:
Cu2O + H2SO4 = Cu + CuSO4 + H2O.
При нагревании на воздухе или в кислороде Cu2O окисляется до CuO, при нагревании в токе водорода - восстанавливается до свободного металла.
Черный оксид меди (II) CuO, как и Cu2O, c водой не реагирует. При взаимодействии CuO с кислотами образуются соли меди (II):
CuO + H2SO4 = CuSO4 + H2O
При сплавлении со щелочами CuO образуются купраты, например:
CuO + 2NaOH = Na2CuO2 + H2O
Нагревание Cu2O в инертной атмосфере приводит к реакции диспропорционирования:
Cu2O = CuO + Cu.
Такие восстановители, как водород, метан, аммиак, оксид углерода (II) и другие восстанавливают CuO до свободной меди, например:
CuO +СО = Cu + СО2.
Кроме оксидов меди Cu2O и CuO, получен также темно-красный оксид меди (III) Cu2O3, обладающий сильными окислительными свойствами.
Медь реагирует с галогенами (см. ГАЛОГЕНЫ), например, при нагревании хлор реагирует с медью с образованием темно-коричневого дихлорида CuCl2. Существуют также дифторид меди CuF2 и дибромид меди CuBr2, но дииодида меди нет. И CuCl2, и CuBr2 хорошо растворимы в воде, при этом ионы меди гидратируются и образуют голубые растворы.
При реакции CuCl2 с порошком металлической меди образуется бесцветный нерастворимый в воде хлорид меди (I) CuCl. Эта соль легко растворяется в концентрированной соляной кислоте, причем образуются комплексные анионы [CuCl2]-, [CuCl3]2- и [СuCl4]3-, например за счет процесса:
CuCl + НCl = H[CuCl2]
При сплавлении меди с серой образуетcя нерастворимый в воде сульфид Cu2S. Сульфид меди (II) CuS выпадает в осадок, например, при пропускании сероводорода через раствор соли меди (II):
H2S + CuSO4 = CuS + H2SO4
C водородом, азотом, графитом, кремнием медь не реагирует. При контакте с водородом медь становится хрупкой (так называемая «водородная болезнь» меди) из-за растворения водорода в этом металле.
В присутствии окислителей, прежде всего кислорода, медь может реагировать с соляной кислотой и разбавленной серной кислотой, но водород при этом не выделяется:
2Cu + 4HCl + O2 = 2CuCl2 + 2H2O.
С азотной кислотой различных концентраций медь реагирует довольно активно, при этом образуется нитрат меди (II) и выделяются различные оксиды азота. Например, с 30%-й азотной кислотой реакция меди протекает так:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
С концентрированной серной кислотой медь реагирует при сильном нагревании:
Cu + 2H2SO4 = CuSO4 + SO2+ 2H2O.
Практическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
2FeCl3 + Cu = CuCl2 + 2FeCl2
Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu2+ легко образуют комплексы с аммиаком, например, состава [Cu(NH3)]2+ . При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.
Гидроксид меди Cu(OH)2 характеризуется преобладанием основных свойств. Он реагирует с кислотами с образованием соли и воды, например:
Сu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O.
Но Сu(OH)2 реагирует и с концентрированными растворами щелочей, при этом образуются соответствующие купраты, например:
Сu(OH)2 + 2NaOH = Na2[Cu(OH)4]
Если в медноаммиачный раствор, полученный растворением Сu(OH)2 или основного сульфата меди в аммиаке, поместить целлюлозу, то наблюдается растворение целлюлозы и образуется раствор медноаммиачного комплекса целлюлозы. Из этого раствора можно изготовить медноаммиачные волокна, которые находят применение при производстве бельевого трикотажа и различных тканей.
Применение
Медь, как полагают, - первый металл, который человек научился обрабатывать и использовать для своих нужд. Найденные в верховьях реки Тигр изделия из меди датируются десятым тысячелетием до нашей эры. Позднее широкое применение сплавов меди определило материальную культуру бронзового века (см. БРОНЗОВЫЙ ВЕК) (конец 4 - начало 1 тысячелетия до нашей эры) и в дальнейшем сопровождало развитие цивилизации на всех этапах. Медь и ее использовались для изготовления посуды, утвари, украшений, различных художественных изделий. Особенно велика была роль бронзы (см. БРОНЗА) .
С 20 века главное применение меди обусловлено ее высокой электропроводимостью. Более половины добываемой меди используется в электротехнике для изготовления различных проводов, кабелей, токопроводящих частей электротехнической аппаратуры. Из-за высокой теплопроводности медь - незаменимый материал различных теплообменников и холодильной аппаратуры. Широко применяется медь в гальванотехнике - для нанесения медных покрытий, для получения тонкостенных изделий сложной формы, для изготовления клише в полиграфии и др.
Большое значение имеют медные сплавы - латуни (см. ЛАТУНЬ) (основная добавка цинк, Zn), бронзы (сплавы с разными элементами, главным образом металлами - оловом, алюминием, берилием, свинцом, кадмием и другими, кроме цинка и никеля) и медно-никелевые сплавы, в том числе мельхиор (см. МЕЛЬХИОР) и нейзильбер (см. НЕЙЗИЛЬБЕР) . В зависимости от марки (состава) сплавы используются в самых различных областях техники как конструкционные, антидикционные, стойкие к коррозии материалы, а также как материалы с заданной электро- и теплопроводностью Так называемые монетные сплавы (медь с алюминием и медь с никелем) применяют для чеканки монет - «меди» и «серебра»; но медь входит в состав и настоящих монетного серебра и монетного золота.
Биологическая роль
Медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального развития (см. Биогенные элементы (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ) ). В растениях и животных содержание меди варьируется от 10-15 до 10-3 %. Мышечная ткань человека содержит 1·10-3 % меди, костная ткань - (1-26) ·10-4%, в крови присутствует 1,01 мг/л меди. Всего в организме среднего человека (масса тела 70 кг) содержится 72 мг меди. Основная роль меди в тканях растений и животных - участие в ферментативном катализе. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов, прежде всего оксидаз (см. ОКСИДАЗЫ), катализирующих реакции биологического окисления. Медьсодержащий белок пластоцианин участвует в процессе фотосинтеза (см. ФОТОСИНТЕЗ). Другой медьсодержащий белок, гемоцианин (см. ГЕМОЦИАНИН), выполняет роль гемоглобина (см. ГЕМОГЛОБИН) у некоторых беспозвоночных. Так как медь токсична, в животном организме она находится в связанном состоянии. Значительная ее часть входит в состав образующегося в печени белка церулоплазмина, циркулирующего с током крови и деставляющего медь к местам синтеза других медьсодержащих белков. Церулоплазмин обладает также каталитической активностью и участвует в реакциях окисления. Медь необходима для осуществления различных функций организма - дыхания, кроветворения (стимулирует усвоение железа и синтез гемоглобина), обмена углеводов и минеральных веществ. Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0,5-6 мг меди.
Сульфат меди и другие соединения меди используют в сельском хозяйстве в качестве микроудобрений и для борьбы с различными вредителями растений. Однако при использовании соединений меди, при работах с ними нужно учитывать, что они ядовиты. Попадание солей меди в организм приводит к различным заболеваниям человека. ПДК для аэрозолей меди составляет 1 мг/м3, для питьевой воды содержание меди должно быть не выше 1,0 мг/л.