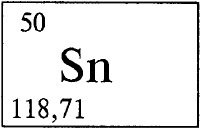Толковый словарь
м.
Химический элемент; мягкий, ковкий, серебристо-белый металл, применяемый для пайки, лужения, приготовления сплавов и т.п.
Толковый словарь Ушакова
О́ЛОВО, олова, мн. нет, ср. Мягкий, ковкий серебристо-белый металл.
Толковый словарь Ожегова
О́ЛОВО, -а, ср. Химический элемент, мягкий ковкий серебристо-белый металл.
| прил. оловянный, -ая, -ое. О. солдатик (игрушечная фигурка солдата).
Толковый словарь Даля
ОЛОВО - ср. крушец (металл) пепельно-серебристый, белее свинца, весьма мягкий, легкоплавкий, легкий весом, более прочих удобный для паянья и для отливки простых мелких вешиц;
| ·стар. свинец, откуда пословица: Слово олово, веско. Лить олово, святочное гаданье. Только у молодца и золотца, что пуговка оловца! Оловянная кружка или оловянка жен. и оловяник муж. Оловянная руда, - колчедан, - припой. Оловяничник, оловянщик муж. отливающий, работающий оловянную посуду. Оловолей, оловолитель муж., церк. оловогадатель, отливающий олово в воду, для гаданья, предсказаний. Оловянные глаза, мутные и бездушные; оловянный глаз, с бельмом. Оловок муж., зап. карандаш.
Словарь существительных
О́ЛОВО, -а, ср
Химический элемент, серебристо-белый мягкий ковкий металл.
При обычных условиях олово весьма устойчиво к химическим воздействиям, благодаря чему оно широко употребляется для защиты покрытий (консервных банок, посуды и проч.).
Энциклопедический словарь
О́ЛОВО -а; ср. Химический элемент (Sn), мягкий ковкий серебристо-белый металл (применяется для пайки, лужения, приготовления сплавов и т.п.).
* * *
о́лово (лат. Stannum), Sn, химический элемент IV группы периодической системы. Серебристо-белый металл, мягкий и пластичный; tпл 231,9°C. Полиморфно; так называемое белое олово (или β-Sn) с плотностью 7,28 г/см3 ниже 13,2°C переходит в серое олово (α-Sn) с плотностью 5,75 г/см3. На воздухе тускнеет, покрываясь плёнкой оксида, стойкой к химическим реагентам. Главные промышленные минералы - касситерит и станнин. Олово - компонент многих сплавов, например, подшипниковых (баббитов), типографских (гарт). Идёт на покрытие других металлов для защиты их от коррозии (лужение), на изготовление белой жести для консервных банок.
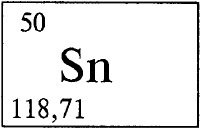
* * *
ОЛОВО - О́ЛОВО (лат. Stannum), Sn, химический элемент с атомным номером 50, атомная масса 118,710). Латинское «stannum» первоначально означало сплав серебра и свинца. «Оловом» в ряде славянских языков называли свинец. Химический символ олова Sn читается «станнум». Природное олово состоит из девяти стабильных нуклидов (см. НУКЛИД) с массовыми числами 112 (в смеси 0,96% по массе), 114 (0,66%), 115 (0,35%), 116 (14,30%), 117 (7,61%), 118 (24,03%), 119 (8,58%), 120 (32,85%), 122 (4,72%), и одного слабо радиоактивного олова-124 (5,94%). 124Sn - бета-излучатель, его период полураспада очень велик и составляет T1/2 = 1016-1017 лет. Олово расположено в пятом периоде в IVА группе периодической системы элементов Д. И. Менделеева. Конфигурация внешнего электронного слоя 5s25p2. В своих соединениях олово проявляет степени окисления +2 и +4 (соответственно валентности II и IV).
Металлический радиус нейтрального атома олова 0,158 нм, радиусы иона Sn2+ 0,118 нм и иона Sn4+ 0,069 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома олова равны 7,344 эВ, 14,632, 30,502, 40,73 и 721,3 эВ. По шкале Полинга электроотрицательность олова 1,96, то есть олово находится на условной границе между металлами и неметаллами.
История открытия
Когда человек впервые познакомился с оловом точно сказать нельзя. Олово и его сплавы известны человечеству с древнейших времен. Упоминание об олове есть в ранних книгах Ветхого Завета. Сплавы олова с медью, так называемые оловянные бронзы (см. БРОНЗА), по-видимому, стали использоваться более чем за 4000 лет до нашей эры. А с самим металлическим оловом человек познакомился значительно позже, примерно около 800 года до нашей эры. Из чистого олова в древности изготовляли посуду и украшения, очень широко применяли изделия из бронзы.
Нахождение в природе
Олово - редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Содержание олова в земной коре составляет, по разным данным, от 2·10-4 до 8·10-3% по массе. Основной минерал олова - касситерит (см. КАССИТЕРИТ) (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (см. СТАННИН) (оловянный колчедан) - Cu2FeSnS4 (27,5 % Sn).
Получение
Для добычи олова в настоящее время используют руды, в которых его содержание равно или немного выше 0,1%. На первом этапе руду обогащают (методом гравитационной флотации или магнитной сепарации). Таким образом удается повысить содержание олова в руде до 40-70%. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Затем полученный таким образом оксид SnO2 восстанавливают углем или алюминием (цинком) в электропечах:
SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Физические и химические свойства
Простое вещество олово полиморфно. В обычных условиях оно существует в виде бета-модификации (белое олово), устойчивой выше 13,2°C. Белое олово - это серебристо-белый, мягкий, пластичный металл, обладающий тетрагональной элементарной ячейкой, параметры a=0.5831, c=0.3181 нм. Координационное окружение каждого атома олова в нем - октаэдр. Плотность бета-Sn 7,29 г/см3 . Температура плавления 231,9°C, температура кипения 2270°C.
При охлаждении, например, при морозе на улице, белое олово переходит в альфа-модификацию (серое олово). Серое олово имеет структуру алмаза (кубическая кристаллическая решетка с параметром а = 0,6491 нм). В сером олове координационный полиэдр каждого атома - тетраэдр, координационное число 4. Фазовый переход бета-Sn ® альфа-Sn сопровождается увеличением удельного объема на 25,6%, что приводит к рассыпанию олова в порошок. В старые времена наблюдавшееся во время сильных холодов рассыпание оловянных изделий называли «оловянной чумой». В результате этой «чумы» пуговицы на обмундировании солдат, их пряжки, кружки, ложки рассыпались, и армия могла потерять боеспособность.
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, бета-Sn - металл, а альфа-Sn относится к числу полупроводников (см. ПОЛУПРОВОДНИКИ). Ниже 3,72 К альфа-Sn переходит в сверхпроводящее состояние. Стандартный электродный потенциал E°Sn2+/Sn равен -0.136 В, а E пары °Sn4+/Sn2+ 0.151 В. При комнатной температуре олово, подобно соседу по группе германию, (см. ГЕРМАНИЙ) устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C:
Sn + O2 = SnO2.
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
Sn + 2Cl2 = SnCl4
С концентрированной соляной кислотой олово медленно реагирует:
Sn + 4HCl = SnCl4 + H2
Возможно также образование хлороловянных кислот составов HSnCl3, H2SnCl4 и других, например:
Sn + 3HCl = HSnCl3 + 2H2
В разбавленной серной кислоте олово не растворяется, а с концентрированной реагирует очень медленно. Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте образуется оловянная кислота b-SnO2·nH2O (иногда ее формулу записывают как H2SnO3). При этом олово ведет себя как неметалл:
Sn + 4HNO3 конц. = b-SnO2·H2OЇ + 4NO2 + H2O
При взаимодействии с разбавленной азотной кислотой олово проявляет свойства металла. В результате реакции образуется соль нитрат олова(II):
3Sn + 8HNO3 разб. = 3Sn(NO3)2 + 2NO + 4H2O.
При нагревании олово, подобно свинцу, может реагировать с водными растворами щелочей. При этом выделяется водород и образуется гидроксокомплекс Sn(II), например:
Sn + 2KOH +2H2O = K2[Sn(OH)4] + H2
Гидрид олова - станнан SnH4 - можно получить по реакции:
SnCl4 + Li[AlH4] = SnH4 + LiCl + AlCl3.
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0°C. Олову отвечают два оксида SnO2 (образующийся при обезвоживании оловянных кислот) и SnO. Последний можно получить при слабом нагревании гидроксида олова(II) Sn(OH)2 в вакууме:
Sn(OH)2 = SnO + H2O
При сильном нагреве оксид олова(II) диспропорционирует:
2SnO = Sn + SnO2
При хранении на воздухе монооксид SnO постепенно окисляется:
2SnO + O2 = 2SnO2.
При гидролизе растворов солей олова(IV) образуется белый осадок - так называемая альфа-оловянная кислота:
SnCl4 + 4NH3 + 6H2O = H2[Sn(OH)6] + 4NH4Cl.
H2[Sn(OH)6] = -SnO2·nH2OЇ + 3H2O.
Свежеполученная альфа-оловянная кислота растворяется в кислотах и щелочах:
a-SnO2·nH2O + KOH = K2[Sn(OH)6],
a-SnO2·nH2O + HNO3 = Sn(NO3)4 + H2O.
При хранении альфа-оловянная кислота стареет, теряет воду и переходит в бета-оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HO-Sn группировок при стоянии и замене их на более инертные мостиковые -Sn-O-Sn- связи. При действии на раствор соли Sn(II) растворами сульфидов выпадает осадок сульфида олова(II):
Sn2+ + S2- = SnS
Этот сульфид может быть легко окислен до SnS2 раствором полисульфида аммония:
SnS + (NH4)2S2 = SnS2 + (NH4)2S
Образующийся дисульфид SnS2 растворяется в растворе сульфида аммония (NH4)2S:
SnS2 + (NH4)2S = (NH4)2SnS3. Четырехвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и других.
Применение
Важное применение олова - лужение железа и получение белой жести, которая используется в консервной промышленности. Для этих целей расходуется около 33% всего добываемого олова. До 60% производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит (см. БАББИТЫ)), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев (см. ПРИПОЙ). Олово способно прокатываться в тонкую фольгу - станиоль (см. СТАНИОЛЬ), такая фольга находит применение при производстве конденсаторов, органных труб, посуды, художественных изделий. Олово применяют для нанесения защитных покрытий на железо и другие металлы, а также на металлические изделия (лужение). Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («сусальное золото»). Искусственный радионуклид олова 119Sn - источник гамма-излучения в мессбауэровской спектроскопии.
Физиологическое действие
О роли олова в живых организмах практически ничего не известно. В теле человека содержится примерно (1-2)· 10-4% олова, а его ежедневное поступление с пищей составляет 0,2-3,5 мг. Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз - поражение легких. Очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3, ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках - 100 мг/кг. Токсическая доза олова для человека - 2 г.
Большой энциклопедический словарь
ОЛОВО (лат. Stannum) - Sn, химический элемент IV группы периодической системы, атомный номер 50, атомная масса 118,710. Серебристо-белый металл, мягкий и пластичный; tпл 231,91 .С. Полиморфно; т. н. белое олово (или ?-Sn) с плотностью 7,228 г/см³ ниже 13,2 .С переходит в серое олово (?-Sn) с плотностью 5,75 г/см³. На воздухе тускнеет, покрываясь пленкой оксида, стойкой к химическим реагентам. Главные промышленные минералы - касситерит и станнин. Олово - компонент многих сплавов, напр. подшипниковых (баббитов), типографских (гарт). Идет на покрытие других металлов для защиты их от коррозии (лужение), на изготовление белой жести для консервных банок.
Академический словарь
-а, ср.
Химический элемент, мягкий, ковкий серебристо-белый металл.
Энциклопедия Кольера
Sn (от лат. stannum, что первоначально относилось к сплаву свинца и серебра, а позднее к другому, имитирующему его сплаву, содержащему около 67% Sn; к 4 в. этим словом стали называть олово),
химический элемент IVB подгруппы (включающей C, Si, Ge, Sn и Pb) периодической системы элементов. Олово - относительно мягкий металл, используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова - в белой жести (луженое железо) для изготовления тары, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Олово образует различные соединения, многие из которых находят промышленное применение. Наиболее экономически важный оловосодержащий минерал - касситерит (оксид олова). Мировые месторождения касситерита разрабатывают в Юго-Восточной Азии, в основном в Индонезии, Малайзии и Таиланде. Другие важные месторождения касситерита находятся в Южной Америке (Бразилия и Боливия), Китае и Австралии.
См. также ОЛОВА ПРОИЗВОДСТВО.
Историческая справка. Олово начали применять, вероятно, еще во времена Гомера и Моисея. Открытие его было связано, скорее всего, со случайным восстановлением наносного касситерита (оловянного камня); наносные отложения встречаются на поверхности или близко к ней, и оловянные руды намного легче восстанавливаются, чем руды других металлов. Древние бритты были хорошо знакомы с оловом: в Корнуолле на юго-западе Англии были обнаружены древние горны со шлаком. Металл был, очевидно, малодоступен и дорог, т.к. оловянные предметы редко встречаются среди римских и греческих древностей, хотя об олове говорится в Библии в Четвертой книге Моисеевой (Числа), а слово касситерит, которое и сегодня используется для обозначения оксидной оловянной руды, - греческого происхождения. Малакка и Восточная Индия упоминаются как источники олова в арабской литературе 8-9 вв. и различными авторами в 16 в. в связи с Великими географическими открытиями. История оловянных разработок в Саксонии и Богемии относится еще к 12 в., но в 17 в. 30-летняя война (1618-1648) разрушила эту промышленность. Производство впоследствии возобновили, но вскоре оно пришло в упадок из-за открытия богатых месторождений в Америке.
Бронза. Задолго до того как научились добывать олово в чистом виде, был известен сплав олова с медью - бронза, который получали, видимо, уже в 2500-2000 до н.э. Олово в рудах часто встречается вместе с медью, так что при плавке меди в Британии, Богемии, Китае и на юге Испании образовывалась не чистая медь, а ее сплав с некоторым количеством олова. Ранние медные плотничные инструменты (долото, тесло и др.) из Ирландии содержали до 1% Sn. В Египте медная утварь 12-й династии (2000 до н.э.) содержала до 2% Sn, по-видимому, как случайную примесь. Первобытная практика выплавки меди основывалась на использовании смеси медных и оловянных руд, в результате чего и получалась бронза, содержащая до 22% Sn. СВОЙСТВА b -ОЛОВА Атомный номер 50 Атомная масса 118,710 Изотопы
стабильные 112, 114-120, 122, 124
нестабильные 108-111, 113, 121, 123, 125-127
Температура плавления, ° С 231,9 Температура кипения, ° С 2625 Плотность, г/см3 7,29 Твердость (по Бринеллю) 3,9 Содержание в земной коре, % (масс.) 0,0004 Степени окисления +2, +4
Физические свойства. Олово - мягкий серебристо-белый пластичный металл (может быть прокатан в очень тонкую фольгу - станиоль) с невысокой температурой плавления (легко выплавляется из руд), но высокой температурой кипения. Олово имеет две аллотропные модификации: a-Sn (серое олово) с гранецентрированной кубической кристаллической решеткой и b-Sn (обычное белое олово) с объемноцентрированной тетрагональной кристаллической решеткой. Фазовый переход b -> a ускоряется при низких температурах (-30° С) и в присутствии зародышей кристаллов серого олова; известны случаи, когда оловянные изделия на морозе рассыпались в серый порошок ("оловянная чума"), но это превращение даже при очень низких температурах резко тормозится наличием мельчайших примесей и поэтому редко встречается, представляя скорее научный, чем практический интерес. См. также
АЛЛОТРОПИЯ;
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ;
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ. Чистое олово обладает низкой механической прочностью при комнатной температуре (можно согнуть оловянную палочку, при этом слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется. Однако оно легко образует сплавы с большинством других черных и цветных металлов. Оловосодержащие сплавы обладают прекрасными антифрикционными свойствами в присутствии смазки, поэтому широко используются как материал подшипников.
Химические свойства. При комнатной температуре олово химически инертно к кислороду и воде. На воздухе олово постепенно покрывается защитной оксидной пленкой, которая повышает его коррозионную стойкость. С химической инертностью олова и его оксидной пленки в обычных условиях связано использование его в покрытии жестяной тары для продуктов питания, прежде всего - консервных банок. Олово легко наносится на сталь и продукты его коррозии безвредны. В соединениях олово проявляет две степени окисления: +2 и +4, причем соединения олова(II) в большинстве своем относительно нестабильны в разбавленных водных растворах и окисляются до соединений олова(IV) (их используют иногда как восстановители, например SnCl2). Разбавленные соляная и серная кислоты действуют на олово очень медленно, а концентрированные, особенно при нагревании, растворяют его, причем в соляной кислоте получается хлорид олова(II), а в серной - сульфат олова(IV). С азотной кислотой олово реагирует тем интенсивнее, чем выше концентрация и температура: в разбавленной HNO3 образуется растворимый нитрат олова(II), а в концентрированной HNO3 - нерастворимая b-оловянная кислота H2SnO3. Концентрированные щелочи растворяют олово с образованием станнитов - солей оловянистой кислоты H2SnO2; в растворах станниты существуют в гидроксоформе, например Na2[[Sn(OH)4]]. Наибольшее промышленное значение соединения олова(II) имеют в производстве гальванических покрытий. Соединения олова(IV) находят обширное промышленное применение. Оксиды олова амфотерны, проявляют и кислотные, и основные свойства. Оксид олова(IV) встречается в природе в виде минерала касситерита, а чистый SnO2 получают из чистого металла; диоксид олова SnO2 применяется для приготовления белых глазурей и эмалей. Из SnO2 при взаимодействии со щелочами получают станнаты - соли оловянной кислоты, наиболее важные из которых - станнаты калия и натрия; растворы станнатов находят широкое применение как электролиты для осаждения олова и его сплавов. SnCl4 - тетрахлорид олова, исходное соединение для многих синтезов других соединений олова, включая и оловоорганические.
Применение. В современном мире более трети добываемого олова расходуется на изготовление пищевой жести и емкостей для напитков. Жесть в основном состоит из стали, но имеет покрытие из олова обычно толщиной менее 0,4 мкм.
Сплавы. Одна треть олова идет на изготовление припоев. Припои - это сплавы олова в основном со свинцом в разных пропорциях в зависимости от назначения. Сплав, содержащий 62% Sn и 38% Pb, называется эвтектическим и имеет самую низкую температуру плавления среди сплавов системы Sn - Pb. Он входит в составы, используемые в электронике и электротехнике. Другие свинцово-оловянные сплавы, например 30% Sn + 70% Pb, имеющие широкую область затвердевания, используются для пайки трубопроводов и как присадочный материал. Применяются и оловянные припои без свинца. Сплавы олова с сурьмой и медью используются как антифрикционные сплавы (баббиты, бронзы) в технологии подшипников для различных механизмов. Современные оловянно-свинцовые сплавы содержат 90-97% Sn и небольшие добавки меди и сурьмы для увеличения твердости и прочности. В отличие от ранних и средневековых свинецсодержащих сплавов, современная посуда из cплавов олова безопасна для использования.
Покрытия из олова и его сплавов. Олово легко образует сплавы со многими металлами. Оловянные покрытия имеют хорошее сцепление с основой, обеспечивают хорошую коррозионную защиту и красивый внешний вид. Оловянные и оловянно-свинцовые покрытия можно наносить, погружая специально приготовленный предмет в ванну с расплавом, однако большинство оловянных покрытий и сплавов олова со свинцом, медью, никелем, цинком и кобальтом осаждают электролитически из водных растворов. Наличие большого диапазона составов для покрытий из олова и его сплавов позволяет решать многообразные задачи промышленного и декоративного характера.
Соединения. Олово образует различные химические соединения, многие из которых находят важное промышленное применение. Кроме многочисленных неорганических соединений, атом олова способен к образованию химической связи с углеродом, что позволяет получать металлоорганические соединения, известные как оловоорганические
(см. также МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ).
Водные растворы хлоридов, сульфатов и фтороборатов олова служат электролитами для осаждения олова и его сплавов. Оксид олова применяют в составе глазури для керамики; он придает глазури непрозрачность и служит красящим пигментом. Оксид олова можно также осаждать из растворов в виде тонкой пленки на различных изделиях, что придает прочность стеклянным изделиям (или уменьшает вес сосудов, сохраняя их прочность). Введение станната цинка и других производных олова в пластические и синтетические материалы уменьшает их возгораемость и препятствует образованию токсичного дыма, и эта область применения становится важнейшей для соединений олова. Огромное количество оловоорганических соединений расходуется в качестве стабилизаторов поливинилхлорида - вещества, используемого для изготовления тары, трубопроводов, прозрачного кровельного материала, оконных рам, водостоков и др. Другие оловоорганические соединения используются как сельскохозяйственные химикаты, для изготовления красок и консервации древесины.
ЛИТЕРАТУРА
Спиваковский В.Б. Аналитическая химия олова. М., 1975 Большаков К.А., Федоров П.И. Химия и технология малых металлов. М., 1984
Словарь древнерусского языка
ОЛОВ|О (35), -А с.
1.Свинец:
сы вълкъ… нын˫а овьча… сы олово нын˫а злато сътворенъ. СбТр XII/XIII, 187 об.; по семь въвьржена бы(с) въ конобъ мѣдѧнъ. исполненъ олова и смолы. ПрЛ 1282, 18б; и подъкѹриша ю пькломь и сѣрою и ѡловомь. Пр 1313, 6б; Маѯентии и сѹщии с нимь погрѧзоша ˫ако ѡлово въ водѣ зѣло (μόλυβδος) ГА XIV1, 204в; бьѥнъ бы(с) злѣ и съвѣщами пожьженъ и въ врѧще оловово. [так!] въверьженъ бы(с). Пр 1383, 126г; Пакы же каме(н) оловѧ(н) гл҃тьсѧ х(с)ъ. рекоша бо олово. ѿ мѣди и олова е(с)ство има(т). (τὸ κασσίτερον… μολίβδου) ГБ к. XIV, 84г; злато ˫а||ко олово видить. (μόλυβδος) ФСт XIV/XV, 36-37; оковавше раку иосифлю оловомъ отаи и въвергоша и в море. Пал 1406, 124г.
2. Олово:
ѧзо ти олово попродале и свинеце и клепание вохо. ГрБ № 439, XII/XIII; воложи олова со цетыри безмене. Там же; а в ризѣ рускому купцѣви ѿ вѣса дати ѥму ѿ бѣрковьска полъ оврѧ. ѿ воску. ѿ мѣди. ѿ олова. ѿ хмѣлю. Гр 1338-1341 (полоцк.); ѡбновл(е)на бы(с) цр҃кы ст҃а˫а Б҃ца… и покрыта бы(с) ѡловомъ ѿ верху до комаръ. и до притворовъ. ЛЛ 1377, 139 об. (1194); помостъ бѣ слитъ ѿ мѣди. и ѿ ѡлова ч(с)та ˫ако блещатисѧ ˫ако зерчалѹ. ЛИ ок. 1425, 281 об. (1259).
Поговорки
Лить олово. Кар., Новг. Гадать, пытаться предсказать судьбу с помощью расплавленного олова. СРГК 3, 131; НОС 6, 166.
Орфографический словарь
Формы слов для слова олово
о́лово, о́лова, о́лов, о́лову, о́ловам, о́ловом, о́ловами, о́лове, о́ловах
Синонимы к слову олово
сущ., кол-во синонимов: 6
Морфемно-орфографический словарь
Грамматический словарь
Этимология
Общеславянское слово, восходящее к той же основе, что и латинское albus - "белый". Металл назван по своему цвету.
Этимологический словарь
Общеслав. Того же корня, что лит. álvas «цинк», прус. alwis и проч. Суф. производное от той же основы, что лат. albus «белый», греч. alphas - тж. Металл назван по цвету.
о́лово
оловя́нный, прилаг., укр. о́лово "свинец", блр. во́лово, др.-русск., ст.-слав. олово μόλυβδος (Супр.), болг. оло́во, сербохорв. о̏лово, о̏д олова, словен. оlо̑v, ólovo (Долобко, ZfslPh 3, 131), чеш., слвц. оlоvо, польск. oɫów, в.-луж. wоɫоj, н.-луж. wóɫoj.
Родственно лит. álvas "свинец" (Даукша), лтш. аl̂vа, al̂vs "олово", др.-прусск. alwis "свинец" (но лит., вост., ãlavas заимств. из слав.; см. Буга, ИОРЯС 17, 1, 4). Далее сближают с названиями цветов: д.-в.-н. ёlо "желтый", лат. albus "белый", греч. ἀλφός; см. Траутман, ВSW 7; М.-Э. 1, 69; Фортунатов, AfslPh 4, 580; Перссон 300; Уленбек, РВВ 22, 536 и сл.; Лиден, Stud. 94. Весьма сомнительна мысль о заимствовании из того же источника, откуда греч. μόλυβδος "свинец", родосск. βόλιμος, вопреки Микколе (Ваlt. u. Slav. 41); см. Лиден, там же. Греч. слова вместе с лат. plumbum возводятся к средиземноморскому слову; см. Буазак 644; Сольмсен, Beitr. I, 59 и сл.; Гофман, Gr. Wb. 205.
Сканворды для слова олово
- Плоть игрушечной армии.
- Материал для стойких солдатиков.
- Химический элемент, металл.
- Металл, болеющий чумой.
- Металл, ставший причиной гибели экспедиции Роберта Скотта на Южный полюс.
- Серебристая капелька на паяльнике.
- Металл для лудильщика.
- Из какого металла делают «белую жесть»?
- Металл-припой.
- Металл, который в избытке можно добыть с поверхности консервных банок.
- Химический элемент, Sn.
- Металл для лужения.
- Смесь солей этого металла - «жёлтая композиция» - издавна использовалась как краситель для шерсти.
- Латинское название этого металла переводится, как «твёрдый», хотя он один из самых мягких и легкоплавких.
- Переведите с латинского слово «станнум».
- Полуда.
- Основа станиоли.
- Мягкий металл колец Альманзора.
Полезные сервисы