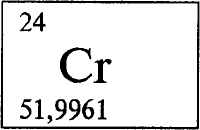ПОДГРУППА IVA. СЕМЕЙСТВО УГЛЕРОДА КРЕМНИЯ
УГЛЕРОД, КРЕМНИЙ, ГЕРМАНИЙ, ОЛОВО, СВИНЕЦ
Характерная для подгруппы IIIA особенность постепенного перехода от легкого неметаллического элемента к тяжелому типичному металлу наблюдается и в этой подгруппе. Но если в подгруппе IIIA имеется один неметалл, то в данной уже два углерод и кремний, а остальные элементы металлы (германий, олово, свинец). Общие свойства элементов этой подгруппы приведены в табл. 5.
Углерод, первый элемент подгруппы IVA периодической таблицы. В виде древесного угля и сажи углерод был известен еще доисторическому человеку. В древнем Египте древесный уголь получали тем же способом, что и теперь, прокаливанием дерева без доступа воздуха. Углерод встречается в природе в виде двух кристаллических модификаций алмаза и графита, а также виде многих некристаллических форм древесный уголь, копоть, костяная сажа. В составе сложных соединений углерод находится в угле, нефти, он составляет основу всех органических соединений, встречается в известняке, магнезите и входит в состав многих неорганических соединений. В соединениях с водородом углерод образует углеводороды (например, метан CH4, этан C2H6, бензол C6H6); в соединениях с кислородом, азотом и водородом образует различные классы веществ кислоты, спирты, амины, кетоны и др.; в сочетании со фтором углерод образует фторуглероды, сходные с углеводородами. Растения и живые организмы содержат бесчисленное количество соединений углерода. Углерод соединяется со многими металлами, образуя карбиды (например, карбид кремния SiC, карбид кальция CaC2), а с кислородом образует оксиды (оксид углерода(II) СО, оксид углерода(IV) CO2 и субоксид углерода C3O2). Оксид углерода(II) СО (монооксид углерода) хорошо известный загрязнитель воздуха, так как образуется при неполном сгорании большинства топлив; он также входит в состав светильного газа и является сильным ядом для живых существ. Оксид углерода(IV) СО2 (диоксид углерода, углекислый газ) непосредственно связан с жизненными процессами, у животных в процессе нормального дыхания происходит связывание углерода и кислорода в CO2, а растения превращают CO2 снова в углерод и кислород в процессе фотосинтеза. Питьевая сода NaHCO3 при нагревании выделяет CO2. При реакции с серой углерод образует дисульфид углерода CS2 прекрасный растворитель для воска, жиров и масел, а также пестицид, применяемый против крыс, сусликов и др. грызунов. Тетрахлорид углерода CCl4 используется как пятновыводитель и в огнетушителях (как негорючее вещество). Такие огнетушители не являются широко распространенными, так как тетрахлорид при высоких температурах может образовывать токсичное газообразное соединение фосген COCl2 (см. также УГЛЕРОД).
Кремний. Этот элемент занимает второе место по распространенности в земной коре. Выделение кремния из его природных источников, таких, как силикаты, очень сложная задача. Химическая связь кремния с кислородом очень прочная благодаря малому ионному радиусу кремния и большой зарядовой плотности иона Si4+. Зарядовая плотность кремния значительно больше, чем у углерода, т.к. электроны кремния сильнее оттянуты к кислороду, создавая больший положительный заряд у кремния. В результате образуется связь SiO с остаточным отрицательным зарядом у кислорода и положительным у кремния, что не проявляется в заметной степени у углерода и кислорода в соединении типа CO2. Такое зарядовое распределение способствует образованию тетраэдрической сетки связей SiO вместо молекулярной структуры SiO2. Схема силикатного тетраэдрического строения такова:
Свободные связи (отмеченные отрицательным зарядом) могут соединяться или ассоциировать с металлическими ионами типа ионов щелочных (подгруппа IA) и щелочноземельных (подгруппа IIA) элементов, с ионами алюминия, водорода. Если же имеются только SiO-связи, то получается кремнезем (SiO2)x. Для разрыва связей SiO и выделения элементного кремния необходим очень эффективный восстановитель. Металлический алюминий, углерод при высокой температуре и карбид кальция способны восстановить оксид кремния до кремния. Более чистый кремний получают восстановлением SiBr4 водородом на раскаленной нити или с помощью металлического натрия. Соединение кремния с железом ферросилиций FeSi получается как побочный продукт в сталелитейной промышленности, он используется как легирующая добавка для получения кремниевых сталей. Ферросилиций получается при взаимодействии кокса, оксида железа и силикатов.
Получение чистого кремния. Необходимость получения высокочистого кремния диктуется развитием производства полупроводниковых элементов, широко распространенных в электронной промышленности, для радиотранслирующего и принимающего оборудования, мощных компьютеров и т.д. Чтобы получить требуемую чистоту, порядка 99,97%, проводят зонную плавку кремния. Слиток чистого кремния, получаемого обычным способом, медленно пропускают через зону высокого нагрева, достаточного для плавления кремния. В слитке происходит постепенное по его сечению плавление и рекристаллизация, при этом примеси перемещаются, оставаясь в жидкой фазе, из-за различной растворимости их в твердой и жидкой фазах. Кремний или металлические элементы этого семейства легируют (введением очень малых количеств металлов подгрупп IIIA или VA) для получения необычных проводящих и электрических свойств, которые позволяют использовать сплавы в различных электронных устройствах. Эти сплавы можно применять в солнечных батареях или преобразователях.
См. также
Германий, олово и свинец получают из их оксидов восстановлением углеродом, водородом или другими восстановителями, менее активными, чем необходимо для получения кремния. Металлическое олово существует в нескольких и необычных модификациях:
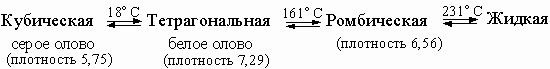
Реакции. Элементы подгруппы IVA реагируют с кислородом, образуя оксиды со степенью окисления II и IV; свинец имеет также оксиды Pb2O3 и Pb3O4, при этом степени окисления являются чисто формальными величинами, не отражая истинную валентность металла. Оксид кремния(II) известен, но плохо изучен. Весьма необычно, что ни один из двухвалентных металлов подгруппы не образует соответствующего гидроксида M(OH)2. Оксид свинца(IV) самого тяжелого металла в этой подгруппе легко восстанавливается до оксида свинца(II). Металлический свинец и его оксиды широко применяются в аккумуляторной технике. Оранжево-красный Pb3O4 (свинцовый сурик) используется как пигмент, как и белый основной карбонат свинца Pb(OH)2CO3, который иногда заменяют диоксидом титана TiO2 для тех же целей.
См. также
СВИНЦА ПРОИЗВОДСТВО И ПРИМЕНЕНИЕ
Образование галогенидов. Галогениды элементов подгруппы IVA имеют состав MX2 и MX4; имеются также сведения об образовании очень нестабильных MX. При термическом разложении SiCl4 установлено образование SiCl и SiCl2. Для углерода установлено образование всех тетрагалогенидов, тогда как свинец не образует PbBr4 и PbI4, поскольку Pb(IV) легко окисляет галогенид-ион в соответствии с реакцией
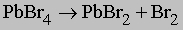
По этой схеме разлагается даже фторид, поэтому PbF4 используют как фторирующий агент. Фторид олова(II) SnF2 применяется для фторирования зубной пасты.
Различие углерода и других элементов подгруппы проявляется в способности галогенидов тяжелых металлов образовывать комплексные ионы, принимая два галогенид-иона, а CCl4 не способен принимать дополнительные хлорид-ионы. Тетрафторид кремния SiF4, принимая 2F, образует SiF62, но SiCl4 не образует SiCl62. Все остальные члены семейства образуют комплексные ионы типа MX62. Такое различие объясняется тем, что радиус атома углерода слишком мал для координирования шести лигандов и, что более важно, на внешнем электронном слое нет места для удерживания более четырех электронов. В случае кремния галогениды за исключением фтора слишком велики, чтобы кремний мог их удерживать, хотя возможности внешней электронной оболочки позволяют акцептировать электроны для образования комплексного иона MX62. Этот факт находит применение при действии HF на стекло: незначительные количества кремнезема и силикатов в стекле реагируют с HF, образуя SiF4 и H2SiF6, при этом на стекле образуется след, происходит гравирование поверхности.
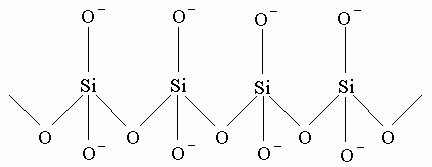
Образование цепей. Наиболее необычным свойством углерода является способность связывания атомов углерода друг с другом с образованием длинных цепей. Этим свойством обладает и кремний, но в меньшей степени, а у германия оно выражено намного слабее. Между соединениями углерода с водородом (углеводороды) и кремния с водородом (силаны) имеется сходство. Первый член семейства силанов SiH4 аналогичен метану CH4. Силан менее термически устойчив, реагирует с водой и влагой воздуха, образуя SiO2, выделяя водород и другие продукты. Стабильность силанов в ряду до Si6H14 уменьшается и возрастает комплексообразующая способность. Наибольший практический интерес представляют соединения кремния, называемые силиконами, формально аналогичные эфирам ROR. Вот схема реакций образования силиконов:
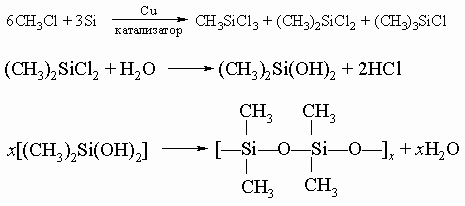
Силиконовые (кремнийорганические) полимеры обладают набором необычных свойств. Свойства их изменяются в широких диапазонах; это могут быть водоподобные жидкости, применяемые для аппретирования ткани и бумаги, в качестве полировочных покрытий и даже косметических средств, и весьма вязкие и маслянистые материалы, используемые для смазки в широком интервале температур. Некоторые кремнийорганические полимеры оказываются полезными как пенообразователи и каучукоподобные материалы
см. также КРЕМНИЙОРГАНИЧЕСКИЕ ПОЛИМЕРЫ.
Карбиды и силициды. При взаимодействии элементов подгруппы IVA с углеродом образуются карбиды. Наибольшее практическое значение имеет карбид кремния SiC, получаемый при высоких температурах из SiO2 и кокса. Карбид кремния очень твердый и термостабильный материал. Его применяют в виде абразива (круги, камни и др.) и керамических электронагревателей для создания высоких температур. Магний образует силицид магния Mg2Si, который реагирует с кислотами, выделяя ранее упоминавшиеся силаны типа SiH4 и Si2H6.
Силикаты. Силикаты некоторых металлов, например цинка и кадмия, обладают способностью излучать свет большей длины волны, чем экспонирующий их. Такой класс материалов называется люминофорами и используется для внутреннего покрытия люминесцентных ламп и в технологии телевизионных трубок. Песок, кварц (особенно чистый кремнезем SiO2) и силикаты являются основными составляющими горных пород и глин и поэтому применяются в технологии строительных материалов (бетон, кирпичи), стекла и керамики
см. также
Чистый кремнезем используют для изготовления термостойких изделий, линз и другого оптического оборудования, прозрачного в области ультрафиолетового излучения. Силикатные руды плавят и с помощью воздушного дутья создают материал, известный как минеральная или шлаковая вата, которая является хорошим теплоизолирующим материалом. Из кремнезема также изготовляют фильтры и плетут стеклоткани.