КЛАПЕЙРОНА - КЛАУЗИУСА уравнение - зависимость между давлением p и температурой T однокомпонентной системы, состоящей из двух равновесно сосуществующих фаз (напр., жидкости и пара); определяет кривую фазового перехода первого рода (парообразования, плавления и др.). Клапейрона - Клаузиуса уравнение предложено Б. П. Э. Клапейроном (1834) и усовершенствовано Р. Ю. Э. Клаузиусом (1850).
клапейрона уравнение
Энциклопедический словарь
Клапейро́на уравне́ние (Клапейрона-Менделеева уравнение), найденная Б. П. Э. Клапейроном (1834) зависимость между физическими величинами, определяющими состояние идеального газа (давлением р, его объёмом V и абсолютной температурой Т): pV = ВТ, где коэффициент B зависит от массы газа M и его молекулярной массы. Для 1 моля идеального газа (Д. И. Менделеев, 1874) pV = RT, где R - 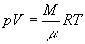 .
.
* * *
КЛАПЕЙРОНА УРАВНЕНИЕ - КЛАПЕЙРО́НА УРАВНЕ́НИЕ, уравнение состояния идеального газа (см. ИДЕАЛЬНЫЙ ГАЗ), выведенное П. Э Клапейроном (см. КЛАПЕЙРОН Эмиль) в 1834, объединившим закон Бойля-Мариотта (см. БОЙЛЯ-МАРИОТТА ЗАКОН) и закон Гей-Люссака (см. ГЕЙ-ЛЮССАКА ЗАКОНЫ).
Представляет собой зависимость между параметрами идеального газа (см. ИДЕАЛЬНЫЙ ГАЗ) (давлением p, объемом V и абсолютной температурой T) определяющими его состояние:
pV=BT.
Коэффициент пропорциональности В зависит от массы газа М и его молярной массы, то есть различается для разных газов.
В 1874 Д. И. Менделеев (см. МЕНДЕЛЕЕВ Дмитрий Иванович) на основе уравнения Клайперона вывел уравнение для 1 моля идеального газа, получившее название уравнения Клапейрона - Менделеева (см. КЛАПЕЙРОНА-МЕНДЕЛЕЕВА УРАВНЕНИЕ).
Большой энциклопедический словарь
КЛАПЕЙРОНА уравнение (Клапейрона - Менделеева уравнение) - найденная Б. П. Э. Клапейроном (1834) зависимость между физическими величинами, определяющими состояние идеального газа (давлением p, его объемом V и абсолютной температурой T): pV=BT, где B=M/? (М - масса газа, ? - его молекулярная масса, R - газовая постоянная). Для 1 моля идеального газа (Д. И. Менделеев, 1874) pV = RT.
Иллюстрированный энциклопедический словарь
КЛАПЕЙРОНА УРАВНЕНИЕ (Клапейрона-Менделеева уравнение), зависимость между давлением p, абсолютной температурой T и объемом V идеального газа массы M: pV=BT, где B=M/m (m - масса молекулы газа в атомных единицах массы). Установлена французским ученым Б.П.Э. Клапейроном в 1834. Для 1 моля газа получена Д.И. Менделеевым: pV=RT, где R - универсальная газовая постоянная. Клапейрона уравнение применимо к реальным газам при низких давлениях и высоких температурах (например, к атмосферному воздуху).
Полезные сервисы
клапейрона-клаузиуса уравнение
Энциклопедический словарь
Клапейро́на-Кла́узиуса уравне́ние - Клапейро́на-Кла́узиуса уравне́ние, зависимость между давлением р и температурой Т однокомпонентной системы, состоящей из двух равновесно сосуществующих фаз (например, жидкости и пара); определяет кривую фазового перехода первого рода (парообразования, плавления и др.). Клапейрона-Клаузиуса уравнение предложено Б. П. Э. Клапейроном (1834) и усовершенствовано Р. Ю. Э. Клаузиусом (1850).
* * *
КЛАПЕЙРОНА-КЛАУЗИУСА УРАВНЕНИЕ - КЛАПЕЙРО́НА-КЛА́УЗИУСА УРАВНЕ́НИЕ, зависимость между давлением p и температурой T однокомпонентной системы, состоящей из двух равновесно сосуществующих фаз (напр., жидкости и пара); определяет кривую фазового перехода первого рода (см. ФАЗОВЫЕ ПЕРЕХОДЫ ПЕРВОГО РОДА) (парообразования, плавления и др.). Клапейрона - Клаузиуса уравнение предложено Б. П. Э. Клапейроном (см. КЛАПЕЙРОН Эмиль) (1834) и усовершенствовано Р. Ю. Э. Клаузиусом (см. КЛАУЗИУС Рудольф Юлиус Эмануэль) (1850).
Полезные сервисы
клапейрона-менделеева уравнение
Энциклопедический словарь
КЛАПЕЙРОНА-МЕНДЕЛЕЕВА УРАВНЕНИЕ - КЛАПЕЙРО́НА-МЕНДЕЛЕЕ́ВА УРАВНЕ́НИЕ, уравнение состояния (см. УРАВНЕНИЕ СОСТОЯНИЯ) для идеального газа (см. ИДЕАЛЬНЫЙ ГАЗ), отнесенное к 1 молю (см. МОЛЬ) газа.
В 1874 Д. И. Менделеев (см. МЕНДЕЛЕЕВ Дмитрий Иванович) на основе уравнения Клапейрона (см. КЛАПЕЙРОНА УРАВНЕНИЕ), объединив его с законом Авогадро (см. АВОГАДРО ЗАКОН), используя молярный объем Vm и отнеся его к 1 молю, вывел уравнение состояния для 1 моля идеального газа:
pV = RT, где R - универсальная газовая постоянная (см. ГАЗОВАЯ ПОСТОЯННАЯ), R = 8,31 Дж/(моль.К)
Уравнение Клапейрона-Менделеева показывает, что для данной массы газа возможно одновременно изменение трех параметров, характеризующих состояние идеального газа.
Для произвольной массы газа М, молярная масса которого m:
pV = (М/m).RT.
или pV = NАkT, где
NА - число Авогадро (см. АВОГАДРО ПОСТОЯННАЯ), k - постоянная Больцмана (см. БОЛЬЦМАНА ПОСТОЯННАЯ).
Уравнение Клапейрона-Менделеева представляет собой уравнение состояния идеального газа, которое объединяет закон Бойля - Мариотта (см. БОЙЛЯ-МАРИОТТА ЗАКОН), закон Гей-Люссака (см. ГЕЙ-ЛЮССАКА ЗАКОНЫ) и закон Авогадро.
Уравнение Клапейрона-Менделеева - наиболее простое уравнение состояния, применяемое с определенной степенью точности к реальным газам при низких давлениях и высоких температурах, например, к атмосферному воздуху, когда свойства газов близки к идеальному газу.