МОЛЕКУЛ СТРОЕНИЕ (молекулярная структура), взаимное расположение атомов в молекулах. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении расположения атомов в исходных соединениях и характера изменений при образовании из них других соединений. Первые представления о структуре молекул основывались на анализе химического поведения вещества. Эти представления усложнялись по мере накопления знаний о химических свойствах веществ. Применение основных законов химии позволяло определить число и тип атомов, из которых состоит молекула данного соединения; эта информация содержится в химической формуле. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов. Этапы развития представлений о строении молекулы метана отражены на рис. 1. Современным данным отвечает структура г: молекула имеет форму правильного тетраэдра, в центре которого находится атом углерода, а в вершинах - атомы водорода.
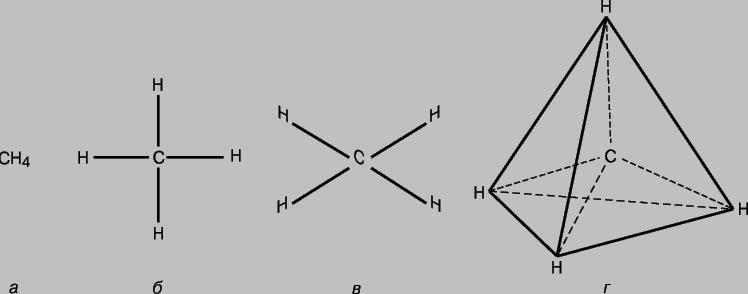
Рис. 1. ЧЕТЫРЕ СПОСОБА ИЗОБРАЖЕНИЯ МОЛЕКУЛЫ МЕТАНА. а - химическая формула. Указаны лишь число и тип атомов; б - структурная формула; в - реальная схема молекулы; г - пространственное расположение атомов в молекуле.
Подобные исследования, однако, ничего не говорили о размерах молекул.
Эта информация стала доступна лишь с разработкой соответствующих физических методов. Наиболее важным из них оказалась рентгеновская дифракция. Из картин рассеяния рентгеновских лучей на кристаллах появилась возможность определять точное положение атомов в кристалле, а для молекулярных кристаллов удалось локализовать атомы в отдельной молекуле. Среди других методов можно отметить дифракцию электронов при прохождении их через газы или пары и анализ вращательных спектров молекул. Вся эта информация дает только общее представление о структуре молекулы. Природу химических связей позволяет исследовать современная квантовая теория. И хотя с достаточно высокой точностью молекулярную структуру рассчитать пока не удается, все известные данные о химических связях можно объяснить. Было даже предсказано существование новых типов химических связей.
Простая ковалентная связь. Молекула водорода Н2 состоит из двух идентичных атомов. По данным физических измерений длина связи - расстояние между ядрами атомов водорода (протонами) - составляет 0,70 (1 = 10-8 см), что отвечает радиусу атома водорода в основном состоянии, т.е. в состоянии с минимальной энергией. Образование связи между атомами можно объяснить лишь в предположении, что их электроны локализуются в основном между ядрами, образуя облако отрицательно заряженных связывающих частиц и удерживая вместе положительно заряженные протоны. Рассмотрим два водородных атома в основном состоянии, т.е. состоянии, в котором их электроны находятся на 1s-орбитали. Каждый из этих электронов можно рассматривать как волну, а орбиталь - как стоячую волну. При сближении атомов орбитали начинают перекрываться (рис. 2), и, как в случае обычных волн, возникает интерференция - наложение волн (волновых функций) в области перекрывания. Если знаки волновых функций противоположны, то при интерференции волны уничтожают друг друга (деструктивная интерференция), а если одинаковы, то происходит их сложение (конструктивная интерференция). При сближении атомов водорода возможны два исхода в зависимости от того, находятся ли волновые функции в фазе (рис. 2,а) или в противофазе (рис. 2,б). В первом случае произойдет конструктивная интерференция, во втором - деструктивная, при этом появятся две молекулярные орбитали; для одной из них характерна высокая плотность в области между ядрами (рис. 2,в), для другой - низкая (рис. 2,г) - фактически узел с нулевой амплитудой, разделяющей ядра.
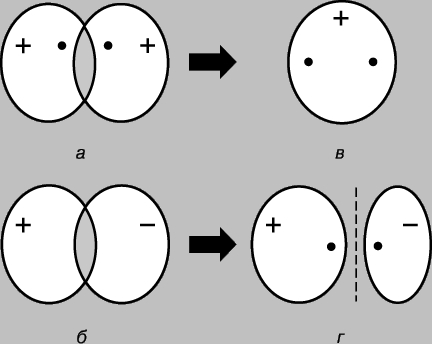
Рис. 2. РЕЗУЛЬТАТЫ ПЕРЕКРЫВАНИЯ 1S-ОРБИТАЛЕЙ АТОМОВ ВОДОРОДА. а - фазы волновых функций совпадают; наблюдается конструктивная интерференция, и в результате образуется молекулярная орбиталь с высокой плотностью в области между ядрами (в); б - фазы волновых функций не совпадают; возникает деструктивная интерференция, в результате образуется молекулярная орбиталь с низкой плотностью между атомами (г).
Таким образом, при сближении атомов водорода и их взаимодействии 1s-орбитали образуют две молекулярные орбитали, а два электрона должны заполнить какую-то одну из них. Электроны в атомах всегда стремятся занять наиболее устойчивое положение - то, в котором их энергия минимальна. Для орбитали, показанной на рис. 2,в, характерна высокая плотность в области между ядрами, и каждый электрон, занявший эту орбиталь, будет большую часть времени находиться вблизи положительно заряженных ядер, т.е. его потенциальная энергия будет мала. Напротив, у орбитали, показанной на рис. 2,г, максимальная плотность имеет место в областях, расположенных слева и справа от ядер, и энергия электронов, находящихся на этой орбитали, будет велика. Итак, электроны обладают меньшей энергией, когда они занимают орбиталь в, причем эта энергия даже меньше той, которая была бы у них при бесконечном удалении атомов друг от друга. Поскольку в данном случае имеются только два электрона, оба они могут занимать более выгодную с энергетической точки зрения орбиталь, если их спины антипараллельны (принцип Паули). Поэтому энергия системы, состоящей из двух атомов водорода, при сближении атомов уменьшается, и чтобы затем удалить атомы друг от друга, потребуется энергия, равная энергии образования стабильной молекулы водорода Н2. Заметим, что необходимым условием существования молекулы водорода является преимущественная локализация электронов между ядрами в соответствии с тем, что мы уже говорили выше. Молекулярную орбиталь в называют связывающей, а орбиталь г - разрыхляющей. Рассмотрим теперь сближение двух атомов гелия (атомный номер 2). Здесь тоже перекрывание 1s-орбиталей приводит к образованию двух молекулярных орбиталей, одной из которых соответствует более низкая, а другой - более высокая энергия. На этот раз, однако, на орбиталях необходимо разместить 4 электрона, по 2 электрона от каждого атома гелия. Низкоэнергетическую связывающую орбиталь могут заполнить только два из них, два других должны занять высокоэнергетическую орбиталь г. Уменьшение энергии вследствие благоприятной локализации первой пары примерно равно увеличению энергии, обусловленному неблагоприятным расположением второй пары. Теперь сближение атомов не дает выигрыша в энергии, и молекулярный гелий Не2 не образуется. Это удобно проиллюстрировать с помощью диаграммы (рис. 3); разные орбитали на ней представлены в виде энергетических уровней, на которых могут находиться электроны. Последние обозначены стрелками, направленными вверх и вниз, чтобы различить направления спинов. Два электрона могут занимать одну орбиталь, только если их спины антипараллельны.
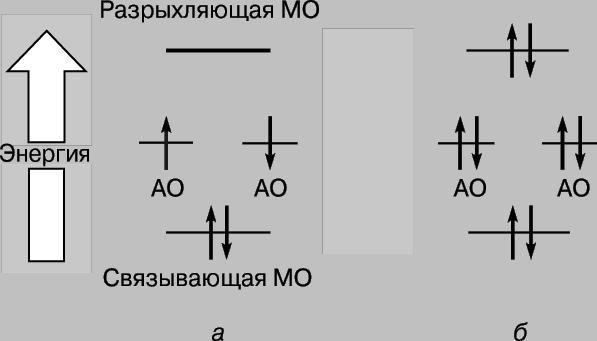
Рис. 3. ИЗМЕНЕНИЕ ЭНЕРГИИ ЭЛЕКТРОНОВ при образовании молекул водорода (а) и гелия (б). Электроны изображены стрелками, направленными вверх и вниз, чтобы различить их спины. Низкоэнергетические молекулярные орбитали являются связывающими, а высокоэнергетические - разрыхляющими.
Эти общие принципы выполняются при образовании молекул из атомов. Как только два атома сближаются настолько, что их атомные орбитали (АО) начинают перекрываться, появляются две молекулярные орбитали (МО): одна связывающая, другая разрыхляющая. Если на каждой из АО находится только по одному электрону, оба они могут занять связывающую МО с меньшей энергией, чем у АО, и образовать химическую связь. Связи такого типа, называемые теперь ковалентными, были давно известны химикам (представления о ковалентной связи легли в основу октетной теории связи, сформулированной американским физикохимиком Г.Льюисом в 1916). Их образование объясняли обобществлением пары электронов взаимодействующими атомами. Согласно современным представлениям, прочность связи зависит от степени перекрывания соответствующих орбиталей. Все сказанное выше позволяет предположить, что связи между атомами могут образовываться при обобществлении не только двух, но также одного или трех электронов. Однако они будут слабее обычных ковалентных связей по следующим причинам. При образовании одноэлектронной связи происходит уменьшение энергии только одного электрона, а в случае образования связи в результате обобществления трех электронов у двух из них энергия уменьшается, а у третьего, наоборот, увеличивается, компенсируя уменьшение энергии одного из первых двух электронов. В результате образующаяся трехэлектронная связь оказывается вдвое слабее обычной ковалентной. Обобществление одного и трех электронов происходит при образовании молекулярного иона водорода Н2+ и молекулы ННе соответственно. Вообще же связи такого типа встречаются редко, а соответствующие молекулы обладают высокой реакционной способностью.
Валентность. Донорно-акцепторные связи. Все изложенное выше предполагает, что атомы могут образовывать столько ковалентных связей, сколько орбиталей у них занято одним электроном, однако так бывает не всегда. (В принятой схеме заполнения АО вначале указывают номер оболочки, затем тип орбитали и далее, если на орбитали находится более одного электрона, - их число (верхний индекс). Так, запись (2s)2 означает, что на s-орбитали второй оболочки находятся два электрона.) Атом углерода в основном состоянии (3Р) имеет электронную конфигурацию (1s)2(2s)2(2px)(2py), при этом две орбитали не заполнены, т.е. содержат по одному электрону. Однако соединения двухвалентного углерода встречаются очень редко и обладают высокой химической активностью. Обычно углерод четырехвалентен, и связано это с тем, что для его перехода в возбужденное 5S-состояние (1s)2(2s) (2px)(2py)(2pz) с четырьмя незаполненными орбиталями нужно совсем немного энергии. Энергетические затраты, связанные с переходом 2s-электрона на свободную 2р-орбиталь, с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных связей. Для образования незаполненных АО необходимо, чтобы этот процесс был энергетически выгодным. Атом азота с электронной конфигурацией (1s)2(2s)2(2px)(2py)(2pz) не образует пятивалентных соединений, поскольку энергия, необходимая для перевода 2s-электрона на 3d-орбиталь с образованием пятивалентной конфигурации (1s)2(2s)(2px)(2py)(2pz)(3d), слишком велика. Аналогичным образом, атомы бора с обычной конфигурацией (1s)2(2s)2(2p) могут образовывать трехвалентные соединения, находясь в возбужденном состоянии (1s)2(2s)(2px)(2py), которое возникает при переходе 2s-электрона на 2р-АО, но не образует пятивалентных соединений, поскольку переход в возбужденное состояние (1s)(2s)(2px)(2py)(2pz), обусловленный переводом одного из 1s-электронов на более высокий уровень, требует слишком много энергии. Взаимодействие атомов с образованием связи между ними происходит только при наличии орбиталей с близкими энергиями, т.е. орбиталей с одинаковым главным квантовым числом. Соответствующие данные для первых 10 элементов периодической системы суммированы ниже. Под валентным состоянием атома понимают состояние, в котором он образует химические связи, например состояние 5S для четырехвалентного углерода.
Указанные закономерности проявляются в следующих примерах:
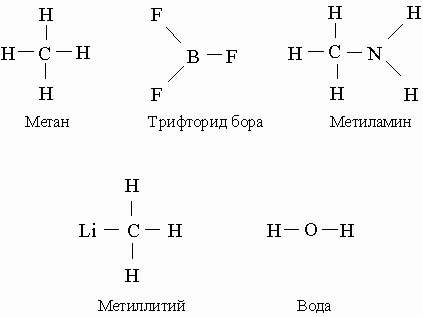
Все сказанное выше применимо лишь к нейтральным атомам. У ионов и соответствующих атомов число электронов различается; ионы могут обладать той же валентностью, что и другие атомы с таким же числом электронов. Так, у ионов N+ и В- столько же электронов (шесть), что и у нейтрального атома углерода, и соответственно они четырехвалентны. Ионы аммония NH4+ и гидрида бора ВН4- образуют комплексные соли и по своей электронной конфигурации аналогичны метану СН4. Предположим теперь, что молекулы аммиака NH3 и трифторида бора BF3 сближаются друг с другом. При переходе электрона с атома азота на атом бора мы получим два иона, NH3+ и BF3-, каждый с незаполненной орбиталью, что может привести к образованию ковалентной связи. Молекула H3N-BF3 является электронным аналогом 1,1,1-трифторэтана Н3С-СF3. Связи, образующиеся в результате межатомного переноса электрона с последующим образованием ковалентной связи, называются донорно-акцепторными.
Геометрия молекул. Гибридизация. Все атомные орбитали, кроме s, сферически несимметричны, и степень их перекрывания с АО других атомов зависит от взаимной ориентации орбиталей. Так, р-АО будет перекрываться с АО другого атома в наибольшей степени, если последняя расположена вдоль ее оси (рис. 4,а). Это означает, что связи, образующиеся в результате перекрывания АО, должны обладать специфической геометрией. Рассмотрим атом углерода в 5S-состоянии. У него имеется по одному электрону на трех р-орбиталях и на четвертой, сферически симметричной s-орбитали. Казалось бы, три связи, которые он образует, будут отличаться от четвертой, при этом р-связи будут располагаться во взаимно перпендикулярных направлениях вдоль осей р-АО. На самом деле наблюдается другая, совершенно симметричная картина. Проще всего объяснить ее следующим образом. Набор орбиталей (2s)+(2px)+(2py)+(2pz) - это некий объем "орбитального пространства", способный удерживать четыре пары электронов. Мы можем получить эквивалентное описание этой ситуации, смешав все орбитали и разделив их сумму на четыре равные части, так что на каждой из образовавшихся смешанных, или гибридных, орбиталей будет располагаться одна пара электронов. Следовательно, 5S-состояние углерода можно представить в виде (1s)2(t1)(t2)(t3)(t4), где ti - гибридные орбитали, что с успехом объясняет образование симметричной молекулы четырехвалентного углерода. Рассмотрим теперь, что произойдет при смешивании р-АО с s-АО. Усиление одной половины р-гантели при интерференции неизменно будет сопровождаться ослаблением другой ее половины (рис. 4,б), в результате чего образуется асимметричная гибридная орбиталь (рис. 4,в). Она будет эффективно перекрываться другими орбиталями, ориентированными в том же направлении, с образованием достаточно прочных связей. Это одна из причин, почему атом углерода предпочитает образовывать связи через гибридизацию АО. Но есть и другая причина. Рассмотрим типичное соединение четырехвалентного углерода, например метан СН4. В нем каждый водородный атом удерживается вблизи атома углерода парой обобществленных электронов. Эти пары взаимно отталкиваются, и оптимальной является такая конфигурация молекулы, при которой они находятся друг от друга на максимально возможном расстоянии. В этом случае атомы водорода будут располагаться в вершинах правильного тетраэдра, а атом углерода - в его центре. Такая геометрия может реализоваться с помощью т.н. sp3-гибридных орбиталей, каждая из которых образована 1/4 частью 2s-АО и одной из 2р-АО. Все эти орбитали одинаковы по форме, легко образуют связи и направлены от углеродного атома в центре правильного тетраэдра к четырем его вершинам (рис. 1,г).
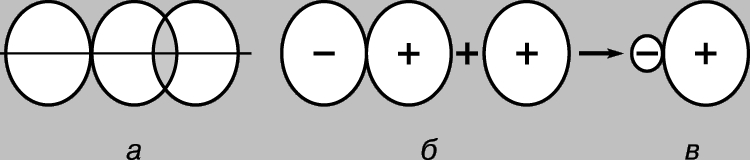
Рис. 4. ПЕРЕКРЫВАНИЕ р-ОРБИТАЛИ с орбиталью другого атома наиболее эффективно, когда последняя ориентирована вдоль той же оси (а). Перекрывание атомной p-орбитали с s-орбиталью (б) приводит к образованию асимметричной "гантели" (в).
Атом азота мог бы образовать связи только с помощью 2р-АО, углы между которыми составляли бы 90°, но взаимное отталкивание пар связывающих электронов и пар несвязывающих электронов 2-й оболочки минимизируется, если в образовании связей участвуют "тетраэдрические" sp3-орбитали. Здесь, однако, проявляется еще одна особенность. Для иона N+ конфигурации (1s)2(2s)(2p)3 и (1s)2(t)4, где t - sp3-гибридные АО, действительно эквивалентны. Другое дело - нейтральный атом азота, 7-й электрон которого может занять либо 2s-АО, и тогда получится конфигурация (1s)2(2s)(2p)4, либо t-АО в конфигурации (1s)2(t)5. Поскольку 2s-АО расположена ниже 2p-АО и, следовательно, ниже любой sp-гибридной орбитали, первая конфигурация оказывается энергетически более выгодной и можно было бы ожидать, что при прочих равных условиях трехвалентный азот предпочтет "негибридизованную" конфигурацию. Однако взаимного расталкивания пар электронов, по-видимому, достаточно для того, чтобы произошла гибридизация, при которой валентные углы в таком соединении азота, как аммиак NH3, близки к соответствующим углам в правильном тетраэдре, т.е. к 109°. То же относится и к двухвалентному кислороду в составе молекулы воды Н2О. Во всех этих случаях связанные атомы занимают три (или две) вершины тетраэдра, а пары неподеленных электронов 2-й оболочки - оставшиеся вершины. Аналогичные рассуждения применимы и к другим типичным элементам IV, V и VI групп периодической таблицы. Четырехвалентные элементы IV группы (Si, Ge, Sn и Pb) всегда образуют тетраэдрические структуры, однако другие элементы V и VI групп (P, S, As, Se, Sb, Te) отличаются от азота и кислорода и образуют соединения с валентными углами, близкими к 90°. По-видимому, из-за большего размера этих атомов взаимного отталкивания валентных электронов оказывается недостаточно, чтобы стала возможна гибридизация, наблюдаемая для N и О.
Связи с участием d-орбиталей. В отличие от азота атом фосфора может образовывать пять ковалентных связей. В основном состоянии фосфор имеет конфигурацию (1s)2(2s)2(2p)6(3s)2(3px)(3py)(3pz) и является трехвалентным, образуя, как и азот, соединения типа PF3. Однако в этом случае возможно участие 3s-электронов в образовании связей, поскольку d-АО (3d) имеют такое же главное квантовое число. Действительно, известны и соединения пятивалентного фосфора типа PF5, где фосфор находится в валентном состоянии +5, согласующемся с электронной конфигурацией (1s)2(2s)2(2p)6(3s)(3px)(3py)(3pz)(3d); связи с этом случае образуются в результате sp3d-гибридизации (т.е. в результате смешивания одной s-, трех р- и одной d-АО). Оптимальной структурой с точки зрения уменьшения взаимного отталкивания пар валентных электронов является треугольная бипирамида (рис. 5,а). Сера может быть не только двухвалентной, но также четырех- (SF4) и шестивалентной (SF6), находясь в состояниях (1s)2(2s)2(2p)6(3s)2(3px)(3py)(3pz)(3d) и (1s)2(2s)2(2p)6(3s)(3px)(3py)(3pz)(3d1)(3d2) соответственно. В соединениях четырехвалентной серы взаимное отталкивание электронов 3-й оболочки оптимизируется при гибридизации орбиталей всех ее электронов. Структура соединений этого типа подобна структуре PF5, но одна из вершин треугольной бипирамиды занята парой неподеленных электронов 3-й оболочки (рис. 5,б). В соединениях шестивалентной серы взаимное отталкивание электронов минимизируется при sp3d 2-гибридизации, когда все орбитали эквивалентны и направлены к вершинам правильного октаэдра (рис. 5,в).
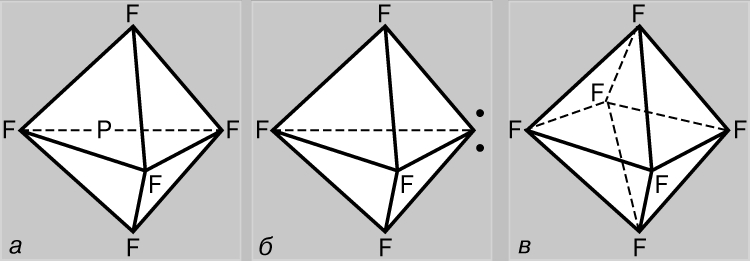
Рис. 5. ПЕНТАФТОРИД ФОСФОРА (а) образуется при участии 3s-электрона. Молекула тетрафторида серы (б) имеет аналогичную форму, но одна из вершин треугольной бипирамиды занята парой неподеленных электронов 3-й оболочки (точки). У гексафторида серы (в) все орбитали эквивалентны и направлены к вершинам правильного октаэдра.
До сих пор мы рассматривали только те элементы периодической таблицы, у которых оболочки, имеющие d-орбитали, либо целиком заполнены, либо совсем свободны. Остановимся теперь на переходных элементах, у которых эти оболочки заполнены не до конца. Энергия электронов на разных орбиталях 3-й оболочки возрастает в следующем порядке: 3s < 3p < 3d; все орбитали расположены слишком далеко от орбиталей 2-й оболочки, чтобы могла произойти их гибридизация. В то же время 3d-орбитали и орбитали 4-й оболочки энергетически достаточно близки, так что возможно взаимодействие 3d-, 4s- и 4р-орбиталей, и переходные элементы от Sс до Cu могут образовывать ковалентные связи путем гибридизации этих орбиталей. Во всех случаях, когда имеются две 3d-орбитали, образование связей происходит через d 2sp3-гибридизацию, при этом гибридные орбитали по форме похожи на sp3d 2-орбитали. Элементы в соединениях этого типа шестивалентны, а молекулы самих соединений имеют форму октаэдра (рис. 5,в). Большинство из них содержат ионы, и можно считать, что они образовались в результате взаимодействия иона центрального атома с шестью молекулами, каждая из которых имеет пару неподеленных электронов. Ковалентные связи с центральным ионом называются донорно-акцепторными. Простой пример такого соединения - гексаммин-ион трехвалентного кобальта Co(NH3)63+. Ион Co3+ имеет электронную конфигурацию (1s)2(2s)2(2p)6(3s)2(3p)6(3d1)2(3d2)2(3d3)2, причем полностью заняты три из пяти его 3d-орбиталей, а две 3d-АО свободны. Эти орбитали могут гибридизоваться с 4s- и 4р-АО с образованием шести октаэдрических d 2sp3-орбиталей; все они свободны и могут участвовать в образовании акцепторных связей с шестью молекулами аммиака. Другая картина наблюдается, когда центральный атом имеет только одну свободную d-орбиталь. В качестве примера можно привести двухзарядный ион никеля Ni2+, у которого оптимальная конфигурация возникает при образовании четырех связей с помощью dsp2-орбиталей. Эти орбитали лежат в одной плоскости под углом 90° друг к другу.
Кратные связи. Одно из известных соединений углерода - этилен С2Н4, в котором каждый атом углерода связан только с тремя другими атомами. По аналогии с бором можно предположить, что оптимальной будет такая геометрия, при которой sp2-гибридные орбитали лежат в одной плоскости. В этом случае у каждого атома углерода будет по одной неиспользованной (в sp2-гибридизации) р-орбитали, которая содержит один из четырех валентных электронов. Если все шесть атомов этилена лежат в одной плоскости, то две неиспользованные р-АО перекрываются друг с другом так, как это изображено на рис. 6,а. Такое перекрывание приводит к образованию пары МО: одной связывающей (рис. 6,б) и одной разрыхляющей (рис. 6,в). Поскольку каждая из них содержит только один электрон, они могут образовать низкоэнергетическую связывающую МО. Так возникает дополнительная связь между атомами углерода, и структурная формула этилена имеет вид
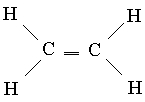
Этот новый тип связи отличается от тех, которые образуются при перекрывании орбиталей по линии соединения атомов, в двух отношениях. Связи последнего типа, одинарные связи С-С, аксиально симметричны, и поэтому на них не влияет вращение соединяемых ими групп. Напротив, перекрывание р-орбиталей зависит от того, лежат ли все шесть атомов в молекуле этилена в одной плоскости, поскольку для оптимального перекрывания р-АО должны быть параллельны. Таким образом, если вращение вокруг одинарной связи С-С может происходить относительно свободно, то вокруг двойной связи С=С оно сильно затруднено. И действительно, молекула этилена - это жесткая плоская структура. Второе различие касается степени перекрывания орбиталей. Поперечное перекрывание р-АО относительно неэффективно, и, следовательно, связи такого типа слабые. Поэтому этилен химически более активен, чем насыщенные соединения, имеющие только одинарные связи.
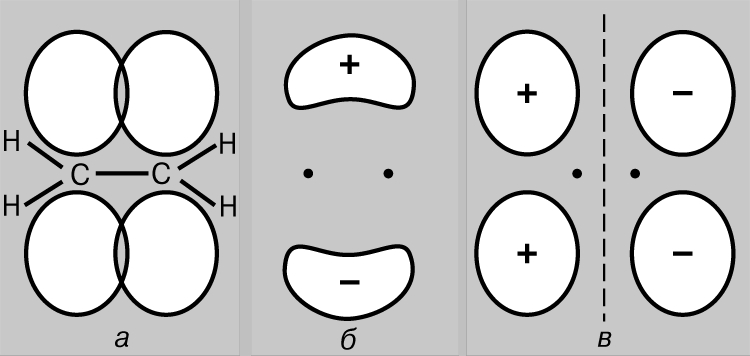
Рис. 6. ЕСЛИ ВСЕ ШЕСТЬ АТОМОВ ЭТИЛЕНА лежат в одной плоскости, то две неиспользованные атомные р-орбитали участвуют в поперечном перекрывании (а). Это приводит к образованию пары молекулярных орбиталей - связывающей (б) и разрыхляющей (в).
Связи, образующиеся при перекрывании орбиталей по линии соединения атомов (продольном перекрывании), называются s-связями, а при поперечном перекрывании - p-связями. Молекулы некоторых соединений, например ацетилена С2Н2, содержат тройные связи. В них каждый атом углерода связан со своим соседом s-связями, образованными sp-гибридными орбиталями. Они коллинеарны, поэтому четыре атома в молекуле ацетилена лежат на одной прямой. Остальные р-АО атомов углерода при перекрывании образуют две p-связи.
Ароматические соединения. Молекулу бензола С6Н6 представляют в виде шестичленного кольца из атомов углерода, к каждому из которых присоединен еще и атом водорода (рис. 7,а). Поскольку у каждого углеродного атома три соседа, можно предположить, что соответствующие связи образуются в результате sp2-гибридизации и лежат в одной плоскости под углом 120° друг к другу. И в самом деле, молекула бензола - плоская структура. Неиспользованные р-АО атомов углерода могут образовывать p-связи (рис. 7,б), однако для бензола ситуация оказывается сложнее, чем в рассмотренных выше случаях, когда связи образовывались в результате перекрывания пар АО. В бензоле 2р-АО каждого углеродного атома должна перекрываться одинаково эффективно с 2р-АО всех соседних атомов. (Здесь можно провести аналогию с многократной интерференцией волн, сопоставив перекрывание орбиталей в молекуле бензола с перекрыванием волн, дифрагировавших на двух щелях или на дифракционной решетке.) В результате для бензола получим набор кольцевых молекулярных орбиталей, охватывающих все шесть атомов углерода (рис. 7,в). Полная энергия системы при такой электронной конфигурации меньше, чем если бы р-АО попарно образовывали обычные p-связи. И действительно, бензол более стабилен и менее активен, чем можно было ожидать исходя из его "классической" структуры (рис. 7,г). Все связи в его молекуле симметричны, и их длины одинаковы, а по прочности они занимают промежуточное положение между одинарной и двойной связями. Известны и другие соединения, в которых p-электроны участвуют в образовании "многоцентровых" МО и для которых наблюдаются аналогичные особенности длин связей и химической активности.
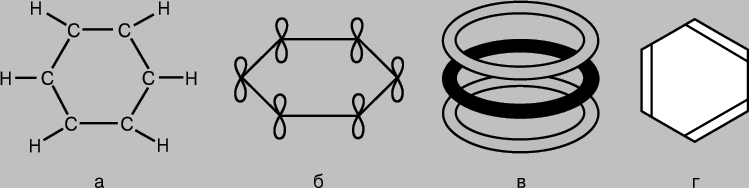
Рис. 7. МОЛЕКУЛА БЕНЗОЛА С6Н6 - это шестичленное кольцо из атомов углерода, каждый из которых соединен еще и с атомом водорода (а). "Лишние" р-орбитали атомов углерода перекрываются с образованием p-связей (б), в результате чего возникает набор кольцевых молекулярных орбиталей, охватывающих все шесть атомов (в). Благодаря этому бензол оказывается более стабильным и менее активным соединением, чем можно было ожидать исходя из его "классической" структуры (г).
Соединения, содержащие многоцентровые связи. Даже в таких простых молекулах, как СН4, отдельные молекулярные орбитали обязательно взаимодействуют друг с другом. Поэтому представление о локализованных двухцентровых ковалентных связях можно рассматривать лишь как некое приближение. Как правило, однако, эти взаимодействия слабые, поскольку степень перекрывания орбиталей невелика (за исключением p-МО в ароматических и сходных с ними соединениях). Тем не менее нельзя исключить существования молекул с многократно перекрывающимися АО, ответственными за образование связей путем обобществления электронов тремя и более атомами. В качестве примера можно привести диборан В2Н6, у которого имеется шесть пар валентных электронов; этого недостаточно для образования семи связей, необходимых для создания классической структуры Н3В-ВН3. Х.Лонге-Хиггинс предложил структуру диборана, представленную на рис. 8,а. В этой структуре центральные атомы водорода соединены трехцентровыми связями, образующимися в результате перекрывания sp3-гибридных орбиталей двух атомов бора с 1s-АО атома водорода (рис. 8,б). Четыре из шести пар валентных электронов участвуют в формировании обычных s-связей с "концевыми" водородными атомами, а две пары - трехцентровых связей. Более сложный пример многоцентровой связи дает молекула дибензолхрома (рис. 8,в). Бензольные кольца в этой молекуле соединяются с атомом металла сложными многоцентровыми орбиталями, образующимися в результате перекрывания p-МО бензола с 3d-, 4s- и 4р-АО центрального атома. Известны и другие аналогичные соединения, имеющие структуру типа сандвича.
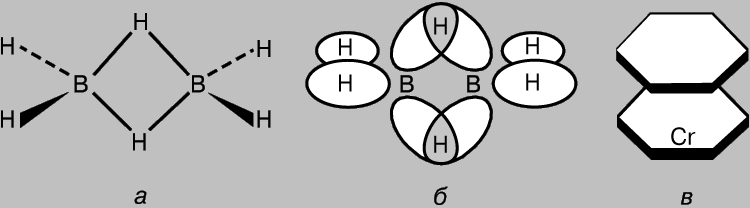
Рис. 8. У ДИБОРАНА (а) атомы водорода соединены трехцентровыми связями, образующимися в результате перекрывания sp3-гибридных орбиталей двух атомов бора с 1s-атомной орбиталью водорода (б). Более сложный пример образования связей подобного типа - молекула дибензолхрома (в).
Перспективы. К настоящему времени общие принципы строения молекул можно считать установленными. Разработаны физико-химические методы определения структуры сложных молекул, в том числе и биологических. В ближайшее время возможен прогресс в двух связанных между собой направлениях. Следует ожидать, во-первых, повышения точности квантовомеханических расчетов и, во-вторых, усовершенствования экспериментальных методов измерения соответствующих молекулярных параметров.
ЛИТЕРАТУРА
Кондратьев В.Н. Структура атомов и молекул. М., 1959 Коулсон Ч. Валентность. М., 1965 Слэтер Дж. Электронная структура молекул. М., 1965 Картмелл Э., Фоулс Г. Валентность и строение молекул. М., 1979










