МОЛЕК - муж., сев. мальга, мольга, малявка, рыбешка новолупка.
молекул строение
Энциклопедия Кольера
МОЛЕКУЛ СТРОЕНИЕ (молекулярная структура), взаимное расположение атомов в молекулах. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении расположения атомов в исходных соединениях и характера изменений при образовании из них других соединений. Первые представления о структуре молекул основывались на анализе химического поведения вещества. Эти представления усложнялись по мере накопления знаний о химических свойствах веществ. Применение основных законов химии позволяло определить число и тип атомов, из которых состоит молекула данного соединения; эта информация содержится в химической формуле. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов. Этапы развития представлений о строении молекулы метана отражены на рис. 1. Современным данным отвечает структура г: молекула имеет форму правильного тетраэдра, в центре которого находится атом углерода, а в вершинах - атомы водорода.
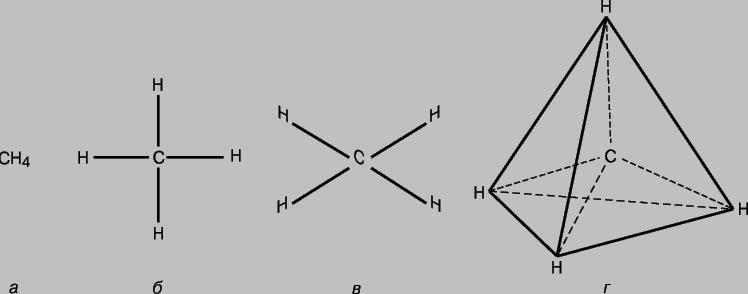
Рис. 1. ЧЕТЫРЕ СПОСОБА ИЗОБРАЖЕНИЯ МОЛЕКУЛЫ МЕТАНА. а - химическая формула. Указаны лишь число и тип атомов; б - структурная формула; в - реальная схема молекулы; г - пространственное расположение атомов в молекуле.
Подобные исследования, однако, ничего не говорили о размерах молекул.
Эта информация стала доступна лишь с разработкой соответствующих физических методов. Наиболее важным из них оказалась рентгеновская дифракция. Из картин рассеяния рентгеновских лучей на кристаллах появилась возможность определять точное положение атомов в кристалле, а для молекулярных кристаллов удалось локализовать атомы в отдельной молекуле. Среди других методов можно отметить дифракцию электронов при прохождении их через газы или пары и анализ вращательных спектров молекул. Вся эта информация дает только общее представление о структуре молекулы. Природу химических связей позволяет исследовать современная квантовая теория. И хотя с достаточно высокой точностью молекулярную структуру рассчитать пока не удается, все известные данные о химических связях можно объяснить. Было даже предсказано существование новых типов химических связей.
Простая ковалентная связь. Молекула водорода Н2 состоит из двух идентичных атомов. По данным физических измерений длина связи - расстояние между ядрами атомов водорода (протонами) - составляет 0,70 (1 = 10-8 см), что отвечает радиусу атома водорода в основном состоянии, т.е. в состоянии с минимальной энергией. Образование связи между атомами можно объяснить лишь в предположении, что их электроны локализуются в основном между ядрами, образуя облако отрицательно заряженных связывающих частиц и удерживая вместе положительно заряженные протоны. Рассмотрим два водородных атома в основном состоянии, т.е. состоянии, в котором их электроны находятся на 1s-орбитали. Каждый из этих электронов можно рассматривать как волну, а орбиталь - как стоячую волну. При сближении атомов орбитали начинают перекрываться (рис. 2), и, как в случае обычных волн, возникает интерференция - наложение волн (волновых функций) в области перекрывания. Если знаки волновых функций противоположны, то при интерференции волны уничтожают друг друга (деструктивная интерференция), а если одинаковы, то происходит их сложение (конструктивная интерференция). При сближении атомов водорода возможны два исхода в зависимости от того, находятся ли волновые функции в фазе (рис. 2,а) или в противофазе (рис. 2,б). В первом случае произойдет конструктивная интерференция, во втором - деструктивная, при этом появятся две молекулярные орбитали; для одной из них характерна высокая плотность в области между ядрами (рис. 2,в), для другой - низкая (рис. 2,г) - фактически узел с нулевой амплитудой, разделяющей ядра.
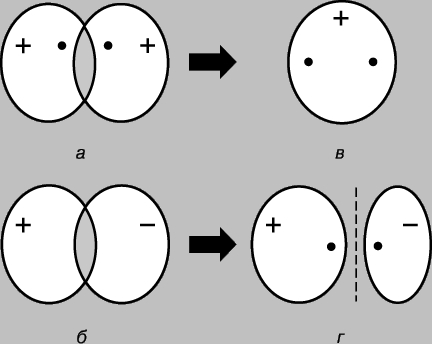
Рис. 2. РЕЗУЛЬТАТЫ ПЕРЕКРЫВАНИЯ 1S-ОРБИТАЛЕЙ АТОМОВ ВОДОРОДА. а - фазы волновых функций совпадают; наблюдается конструктивная интерференция, и в результате образуется молекулярная орбиталь с высокой плотностью в области между ядрами (в); б - фазы волновых функций не совпадают; возникает деструктивная интерференция, в результате образуется молекулярная орбиталь с низкой плотностью между атомами (г).
Таким образом, при сближении атомов водорода и их взаимодействии 1s-орбитали образуют две молекулярные орбитали, а два электрона должны заполнить какую-то одну из них. Электроны в атомах всегда стремятся занять наиболее устойчивое положение - то, в котором их энергия минимальна. Для орбитали, показанной на рис. 2,в, характерна высокая плотность в области между ядрами, и каждый электрон, занявший эту орбиталь, будет большую часть времени находиться вблизи положительно заряженных ядер, т.е. его потенциальная энергия будет мала. Напротив, у орбитали, показанной на рис. 2,г, максимальная плотность имеет место в областях, расположенных слева и справа от ядер, и энергия электронов, находящихся на этой орбитали, будет велика. Итак, электроны обладают меньшей энергией, когда они занимают орбиталь в, причем эта энергия даже меньше той, которая была бы у них при бесконечном удалении атомов друг от друга. Поскольку в данном случае имеются только два электрона, оба они могут занимать более выгодную с энергетической точки зрения орбиталь, если их спины антипараллельны (принцип Паули). Поэтому энергия системы, состоящей из двух атомов водорода, при сближении атомов уменьшается, и чтобы затем удалить атомы друг от друга, потребуется энергия, равная энергии образования стабильной молекулы водорода Н2. Заметим, что необходимым условием существования молекулы водорода является преимущественная локализация электронов между ядрами в соответствии с тем, что мы уже говорили выше. Молекулярную орбиталь в называют связывающей, а орбиталь г - разрыхляющей. Рассмотрим теперь сближение двух атомов гелия (атомный номер 2). Здесь тоже перекрывание 1s-орбиталей приводит к образованию двух молекулярных орбиталей, одной из которых соответствует более низкая, а другой - более высокая энергия. На этот раз, однако, на орбиталях необходимо разместить 4 электрона, по 2 электрона от каждого атома гелия. Низкоэнергетическую связывающую орбиталь могут заполнить только два из них, два других должны занять высокоэнергетическую орбиталь г. Уменьшение энергии вследствие благоприятной локализации первой пары примерно равно увеличению энергии, обусловленному неблагоприятным расположением второй пары. Теперь сближение атомов не дает выигрыша в энергии, и молекулярный гелий Не2 не образуется. Это удобно проиллюстрировать с помощью диаграммы (рис. 3); разные орбитали на ней представлены в виде энергетических уровней, на которых могут находиться электроны. Последние обозначены стрелками, направленными вверх и вниз, чтобы различить направления спинов. Два электрона могут занимать одну орбиталь, только если их спины антипараллельны.
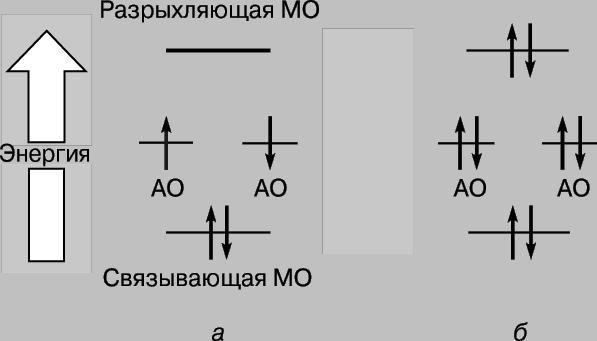
Рис. 3. ИЗМЕНЕНИЕ ЭНЕРГИИ ЭЛЕКТРОНОВ при образовании молекул водорода (а) и гелия (б). Электроны изображены стрелками, направленными вверх и вниз, чтобы различить их спины. Низкоэнергетические молекулярные орбитали являются связывающими, а высокоэнергетические - разрыхляющими.
Эти общие принципы выполняются при образовании молекул из атомов. Как только два атома сближаются настолько, что их атомные орбитали (АО) начинают перекрываться, появляются две молекулярные орбитали (МО): одна связывающая, другая разрыхляющая. Если на каждой из АО находится только по одному электрону, оба они могут занять связывающую МО с меньшей энергией, чем у АО, и образовать химическую связь. Связи такого типа, называемые теперь ковалентными, были давно известны химикам (представления о ковалентной связи легли в основу октетной теории связи, сформулированной американским физикохимиком Г.Льюисом в 1916). Их образование объясняли обобществлением пары электронов взаимодействующими атомами. Согласно современным представлениям, прочность связи зависит от степени перекрывания соответствующих орбиталей. Все сказанное выше позволяет предположить, что связи между атомами могут образовываться при обобществлении не только двух, но также одного или трех электронов. Однако они будут слабее обычных ковалентных связей по следующим причинам. При образовании одноэлектронной связи происходит уменьшение энергии только одного электрона, а в случае образования связи в результате обобществления трех электронов у двух из них энергия уменьшается, а у третьего, наоборот, увеличивается, компенсируя уменьшение энергии одного из первых двух электронов. В результате образующаяся трехэлектронная связь оказывается вдвое слабее обычной ковалентной. Обобществление одного и трех электронов происходит при образовании молекулярного иона водорода Н2+ и молекулы ННе соответственно. Вообще же связи такого типа встречаются редко, а соответствующие молекулы обладают высокой реакционной способностью.
Валентность. Донорно-акцепторные связи. Все изложенное выше предполагает, что атомы могут образовывать столько ковалентных связей, сколько орбиталей у них занято одним электроном, однако так бывает не всегда. (В принятой схеме заполнения АО вначале указывают номер оболочки, затем тип орбитали и далее, если на орбитали находится более одного электрона, - их число (верхний индекс). Так, запись (2s)2 означает, что на s-орбитали второй оболочки находятся два электрона.) Атом углерода в основном состоянии (3Р) имеет электронную конфигурацию (1s)2(2s)2(2px)(2py), при этом две орбитали не заполнены, т.е. содержат по одному электрону. Однако соединения двухвалентного углерода встречаются очень редко и обладают высокой химической активностью. Обычно углерод четырехвалентен, и связано это с тем, что для его перехода в возбужденное 5S-состояние (1s)2(2s) (2px)(2py)(2pz) с четырьмя незаполненными орбиталями нужно совсем немного энергии. Энергетические затраты, связанные с переходом 2s-электрона на свободную 2р-орбиталь, с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных связей. Для образования незаполненных АО необходимо, чтобы этот процесс был энергетически выгодным. Атом азота с электронной конфигурацией (1s)2(2s)2(2px)(2py)(2pz) не образует пятивалентных соединений, поскольку энергия, необходимая для перевода 2s-электрона на 3d-орбиталь с образованием пятивалентной конфигурации (1s)2(2s)(2px)(2py)(2pz)(3d), слишком велика. Аналогичным образом, атомы бора с обычной конфигурацией (1s)2(2s)2(2p) могут образовывать трехвалентные соединения, находясь в возбужденном состоянии (1s)2(2s)(2px)(2py), которое возникает при переходе 2s-электрона на 2р-АО, но не образует пятивалентных соединений, поскольку переход в возбужденное состояние (1s)(2s)(2px)(2py)(2pz), обусловленный переводом одного из 1s-электронов на более высокий уровень, требует слишком много энергии. Взаимодействие атомов с образованием связи между ними происходит только при наличии орбиталей с близкими энергиями, т.е. орбиталей с одинаковым главным квантовым числом. Соответствующие данные для первых 10 элементов периодической системы суммированы ниже. Под валентным состоянием атома понимают состояние, в котором он образует химические связи, например состояние 5S для четырехвалентного углерода.
Указанные закономерности проявляются в следующих примерах:
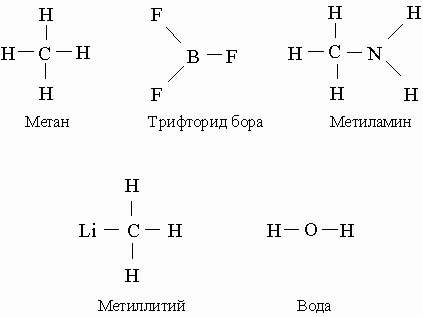
Все сказанное выше применимо лишь к нейтральным атомам. У ионов и соответствующих атомов число электронов различается; ионы могут обладать той же валентностью, что и другие атомы с таким же числом электронов. Так, у ионов N+ и В- столько же электронов (шесть), что и у нейтрального атома углерода, и соответственно они четырехвалентны. Ионы аммония NH4+ и гидрида бора ВН4- образуют комплексные соли и по своей электронной конфигурации аналогичны метану СН4. Предположим теперь, что молекулы аммиака NH3 и трифторида бора BF3 сближаются друг с другом. При переходе электрона с атома азота на атом бора мы получим два иона, NH3+ и BF3-, каждый с незаполненной орбиталью, что может привести к образованию ковалентной связи. Молекула H3N-BF3 является электронным аналогом 1,1,1-трифторэтана Н3С-СF3. Связи, образующиеся в результате межатомного переноса электрона с последующим образованием ковалентной связи, называются донорно-акцепторными.
Геометрия молекул. Гибридизация. Все атомные орбитали, кроме s, сферически несимметричны, и степень их перекрывания с АО других атомов зависит от взаимной ориентации орбиталей. Так, р-АО будет перекрываться с АО другого атома в наибольшей степени, если последняя расположена вдоль ее оси (рис. 4,а). Это означает, что связи, образующиеся в результате перекрывания АО, должны обладать специфической геометрией. Рассмотрим атом углерода в 5S-состоянии. У него имеется по одному электрону на трех р-орбиталях и на четвертой, сферически симметричной s-орбитали. Казалось бы, три связи, которые он образует, будут отличаться от четвертой, при этом р-связи будут располагаться во взаимно перпендикулярных направлениях вдоль осей р-АО. На самом деле наблюдается другая, совершенно симметричная картина. Проще всего объяснить ее следующим образом. Набор орбиталей (2s)+(2px)+(2py)+(2pz) - это некий объем "орбитального пространства", способный удерживать четыре пары электронов. Мы можем получить эквивалентное описание этой ситуации, смешав все орбитали и разделив их сумму на четыре равные части, так что на каждой из образовавшихся смешанных, или гибридных, орбиталей будет располагаться одна пара электронов. Следовательно, 5S-состояние углерода можно представить в виде (1s)2(t1)(t2)(t3)(t4), где ti - гибридные орбитали, что с успехом объясняет образование симметричной молекулы четырехвалентного углерода. Рассмотрим теперь, что произойдет при смешивании р-АО с s-АО. Усиление одной половины р-гантели при интерференции неизменно будет сопровождаться ослаблением другой ее половины (рис. 4,б), в результате чего образуется асимметричная гибридная орбиталь (рис. 4,в). Она будет эффективно перекрываться другими орбиталями, ориентированными в том же направлении, с образованием достаточно прочных связей. Это одна из причин, почему атом углерода предпочитает образовывать связи через гибридизацию АО. Но есть и другая причина. Рассмотрим типичное соединение четырехвалентного углерода, например метан СН4. В нем каждый водородный атом удерживается вблизи атома углерода парой обобществленных электронов. Эти пары взаимно отталкиваются, и оптимальной является такая конфигурация молекулы, при которой они находятся друг от друга на максимально возможном расстоянии. В этом случае атомы водорода будут располагаться в вершинах правильного тетраэдра, а атом углерода - в его центре. Такая геометрия может реализоваться с помощью т.н. sp3-гибридных орбиталей, каждая из которых образована 1/4 частью 2s-АО и одной из 2р-АО. Все эти орбитали одинаковы по форме, легко образуют связи и направлены от углеродного атома в центре правильного тетраэдра к четырем его вершинам (рис. 1,г).
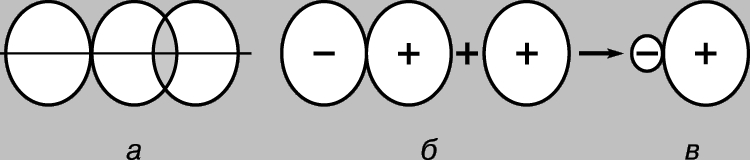
Рис. 4. ПЕРЕКРЫВАНИЕ р-ОРБИТАЛИ с орбиталью другого атома наиболее эффективно, когда последняя ориентирована вдоль той же оси (а). Перекрывание атомной p-орбитали с s-орбиталью (б) приводит к образованию асимметричной "гантели" (в).
Атом азота мог бы образовать связи только с помощью 2р-АО, углы между которыми составляли бы 90°, но взаимное отталкивание пар связывающих электронов и пар несвязывающих электронов 2-й оболочки минимизируется, если в образовании связей участвуют "тетраэдрические" sp3-орбитали. Здесь, однако, проявляется еще одна особенность. Для иона N+ конфигурации (1s)2(2s)(2p)3 и (1s)2(t)4, где t - sp3-гибридные АО, действительно эквивалентны. Другое дело - нейтральный атом азота, 7-й электрон которого может занять либо 2s-АО, и тогда получится конфигурация (1s)2(2s)(2p)4, либо t-АО в конфигурации (1s)2(t)5. Поскольку 2s-АО расположена ниже 2p-АО и, следовательно, ниже любой sp-гибридной орбитали, первая конфигурация оказывается энергетически более выгодной и можно было бы ожидать, что при прочих равных условиях трехвалентный азот предпочтет "негибридизованную" конфигурацию. Однако взаимного расталкивания пар электронов, по-видимому, достаточно для того, чтобы произошла гибридизация, при которой валентные углы в таком соединении азота, как аммиак NH3, близки к соответствующим углам в правильном тетраэдре, т.е. к 109°. То же относится и к двухвалентному кислороду в составе молекулы воды Н2О. Во всех этих случаях связанные атомы занимают три (или две) вершины тетраэдра, а пары неподеленных электронов 2-й оболочки - оставшиеся вершины. Аналогичные рассуждения применимы и к другим типичным элементам IV, V и VI групп периодической таблицы. Четырехвалентные элементы IV группы (Si, Ge, Sn и Pb) всегда образуют тетраэдрические структуры, однако другие элементы V и VI групп (P, S, As, Se, Sb, Te) отличаются от азота и кислорода и образуют соединения с валентными углами, близкими к 90°. По-видимому, из-за большего размера этих атомов взаимного отталкивания валентных электронов оказывается недостаточно, чтобы стала возможна гибридизация, наблюдаемая для N и О.
Связи с участием d-орбиталей. В отличие от азота атом фосфора может образовывать пять ковалентных связей. В основном состоянии фосфор имеет конфигурацию (1s)2(2s)2(2p)6(3s)2(3px)(3py)(3pz) и является трехвалентным, образуя, как и азот, соединения типа PF3. Однако в этом случае возможно участие 3s-электронов в образовании связей, поскольку d-АО (3d) имеют такое же главное квантовое число. Действительно, известны и соединения пятивалентного фосфора типа PF5, где фосфор находится в валентном состоянии +5, согласующемся с электронной конфигурацией (1s)2(2s)2(2p)6(3s)(3px)(3py)(3pz)(3d); связи с этом случае образуются в результате sp3d-гибридизации (т.е. в результате смешивания одной s-, трех р- и одной d-АО). Оптимальной структурой с точки зрения уменьшения взаимного отталкивания пар валентных электронов является треугольная бипирамида (рис. 5,а). Сера может быть не только двухвалентной, но также четырех- (SF4) и шестивалентной (SF6), находясь в состояниях (1s)2(2s)2(2p)6(3s)2(3px)(3py)(3pz)(3d) и (1s)2(2s)2(2p)6(3s)(3px)(3py)(3pz)(3d1)(3d2) соответственно. В соединениях четырехвалентной серы взаимное отталкивание электронов 3-й оболочки оптимизируется при гибридизации орбиталей всех ее электронов. Структура соединений этого типа подобна структуре PF5, но одна из вершин треугольной бипирамиды занята парой неподеленных электронов 3-й оболочки (рис. 5,б). В соединениях шестивалентной серы взаимное отталкивание электронов минимизируется при sp3d 2-гибридизации, когда все орбитали эквивалентны и направлены к вершинам правильного октаэдра (рис. 5,в).
Рис. 5. ПЕНТАФТОРИД ФОСФОРА (а) образуется при участии 3s-электрона. Молекула тетрафторида серы (б) имеет аналогичную форму, но одна из вершин треугольной бипирамиды занята парой неподеленных электронов 3-й оболочки (точки). У гексафторида серы (в) все орбитали эквивалентны и направлены к вершинам правильного октаэдра.
До сих пор мы рассматривали только те элементы периодической таблицы, у которых оболочки, имеющие d-орбитали, либо целиком заполнены, либо совсем свободны. Остановимся теперь на переходных элементах, у которых эти оболочки заполнены не до конца. Энергия электронов на разных орбиталях 3-й оболочки возрастает в следующем порядке: 3s < 3p < 3d; все орбитали расположены слишком далеко от орбиталей 2-й оболочки, чтобы могла произойти их гибридизация. В то же время 3d-орбитали и орбитали 4-й оболочки энергетически достаточно близки, так что возможно взаимодействие 3d-, 4s- и 4р-орбиталей, и переходные элементы от Sс до Cu могут образовывать ковалентные связи путем гибридизации этих орбиталей. Во всех случаях, когда имеются две 3d-орбитали, образование связей происходит через d 2sp3-гибридизацию, при этом гибридные орбитали по форме похожи на sp3d 2-орбитали. Элементы в соединениях этого типа шестивалентны, а молекулы самих соединений имеют форму октаэдра (рис. 5,в). Большинство из них содержат ионы, и можно считать, что они образовались в результате взаимодействия иона центрального атома с шестью молекулами, каждая из которых имеет пару неподеленных электронов. Ковалентные связи с центральным ионом называются донорно-акцепторными. Простой пример такого соединения - гексаммин-ион трехвалентного кобальта Co(NH3)63+. Ион Co3+ имеет электронную конфигурацию (1s)2(2s)2(2p)6(3s)2(3p)6(3d1)2(3d2)2(3d3)2, причем полностью заняты три из пяти его 3d-орбиталей, а две 3d-АО свободны. Эти орбитали могут гибридизоваться с 4s- и 4р-АО с образованием шести октаэдрических d 2sp3-орбиталей; все они свободны и могут участвовать в образовании акцепторных связей с шестью молекулами аммиака. Другая картина наблюдается, когда центральный атом имеет только одну свободную d-орбиталь. В качестве примера можно привести двухзарядный ион никеля Ni2+, у которого оптимальная конфигурация возникает при образовании четырех связей с помощью dsp2-орбиталей. Эти орбитали лежат в одной плоскости под углом 90° друг к другу.
Кратные связи. Одно из известных соединений углерода - этилен С2Н4, в котором каждый атом углерода связан только с тремя другими атомами. По аналогии с бором можно предположить, что оптимальной будет такая геометрия, при которой sp2-гибридные орбитали лежат в одной плоскости. В этом случае у каждого атома углерода будет по одной неиспользованной (в sp2-гибридизации) р-орбитали, которая содержит один из четырех валентных электронов. Если все шесть атомов этилена лежат в одной плоскости, то две неиспользованные р-АО перекрываются друг с другом так, как это изображено на рис. 6,а. Такое перекрывание приводит к образованию пары МО: одной связывающей (рис. 6,б) и одной разрыхляющей (рис. 6,в). Поскольку каждая из них содержит только один электрон, они могут образовать низкоэнергетическую связывающую МО. Так возникает дополнительная связь между атомами углерода, и структурная формула этилена имеет вид
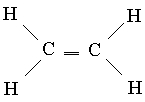
Этот новый тип связи отличается от тех, которые образуются при перекрывании орбиталей по линии соединения атомов, в двух отношениях. Связи последнего типа, одинарные связи С-С, аксиально симметричны, и поэтому на них не влияет вращение соединяемых ими групп. Напротив, перекрывание р-орбиталей зависит от того, лежат ли все шесть атомов в молекуле этилена в одной плоскости, поскольку для оптимального перекрывания р-АО должны быть параллельны. Таким образом, если вращение вокруг одинарной связи С-С может происходить относительно свободно, то вокруг двойной связи С=С оно сильно затруднено. И действительно, молекула этилена - это жесткая плоская структура. Второе различие касается степени перекрывания орбиталей. Поперечное перекрывание р-АО относительно неэффективно, и, следовательно, связи такого типа слабые. Поэтому этилен химически более активен, чем насыщенные соединения, имеющие только одинарные связи.
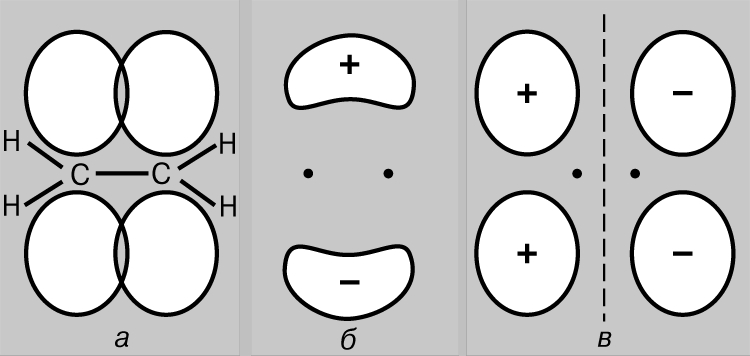
Рис. 6. ЕСЛИ ВСЕ ШЕСТЬ АТОМОВ ЭТИЛЕНА лежат в одной плоскости, то две неиспользованные атомные р-орбитали участвуют в поперечном перекрывании (а). Это приводит к образованию пары молекулярных орбиталей - связывающей (б) и разрыхляющей (в).
Связи, образующиеся при перекрывании орбиталей по линии соединения атомов (продольном перекрывании), называются s-связями, а при поперечном перекрывании - p-связями. Молекулы некоторых соединений, например ацетилена С2Н2, содержат тройные связи. В них каждый атом углерода связан со своим соседом s-связями, образованными sp-гибридными орбиталями. Они коллинеарны, поэтому четыре атома в молекуле ацетилена лежат на одной прямой. Остальные р-АО атомов углерода при перекрывании образуют две p-связи.
Ароматические соединения. Молекулу бензола С6Н6 представляют в виде шестичленного кольца из атомов углерода, к каждому из которых присоединен еще и атом водорода (рис. 7,а). Поскольку у каждого углеродного атома три соседа, можно предположить, что соответствующие связи образуются в результате sp2-гибридизации и лежат в одной плоскости под углом 120° друг к другу. И в самом деле, молекула бензола - плоская структура. Неиспользованные р-АО атомов углерода могут образовывать p-связи (рис. 7,б), однако для бензола ситуация оказывается сложнее, чем в рассмотренных выше случаях, когда связи образовывались в результате перекрывания пар АО. В бензоле 2р-АО каждого углеродного атома должна перекрываться одинаково эффективно с 2р-АО всех соседних атомов. (Здесь можно провести аналогию с многократной интерференцией волн, сопоставив перекрывание орбиталей в молекуле бензола с перекрыванием волн, дифрагировавших на двух щелях или на дифракционной решетке.) В результате для бензола получим набор кольцевых молекулярных орбиталей, охватывающих все шесть атомов углерода (рис. 7,в). Полная энергия системы при такой электронной конфигурации меньше, чем если бы р-АО попарно образовывали обычные p-связи. И действительно, бензол более стабилен и менее активен, чем можно было ожидать исходя из его "классической" структуры (рис. 7,г). Все связи в его молекуле симметричны, и их длины одинаковы, а по прочности они занимают промежуточное положение между одинарной и двойной связями. Известны и другие соединения, в которых p-электроны участвуют в образовании "многоцентровых" МО и для которых наблюдаются аналогичные особенности длин связей и химической активности.
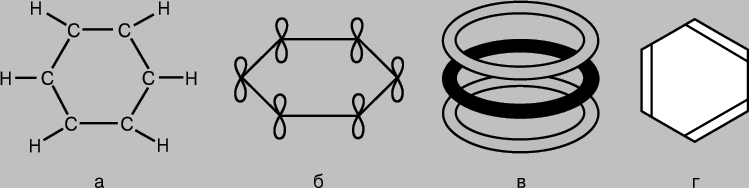
Рис. 7. МОЛЕКУЛА БЕНЗОЛА С6Н6 - это шестичленное кольцо из атомов углерода, каждый из которых соединен еще и с атомом водорода (а). "Лишние" р-орбитали атомов углерода перекрываются с образованием p-связей (б), в результате чего возникает набор кольцевых молекулярных орбиталей, охватывающих все шесть атомов (в). Благодаря этому бензол оказывается более стабильным и менее активным соединением, чем можно было ожидать исходя из его "классической" структуры (г).
Соединения, содержащие многоцентровые связи. Даже в таких простых молекулах, как СН4, отдельные молекулярные орбитали обязательно взаимодействуют друг с другом. Поэтому представление о локализованных двухцентровых ковалентных связях можно рассматривать лишь как некое приближение. Как правило, однако, эти взаимодействия слабые, поскольку степень перекрывания орбиталей невелика (за исключением p-МО в ароматических и сходных с ними соединениях). Тем не менее нельзя исключить существования молекул с многократно перекрывающимися АО, ответственными за образование связей путем обобществления электронов тремя и более атомами. В качестве примера можно привести диборан В2Н6, у которого имеется шесть пар валентных электронов; этого недостаточно для образования семи связей, необходимых для создания классической структуры Н3В-ВН3. Х.Лонге-Хиггинс предложил структуру диборана, представленную на рис. 8,а. В этой структуре центральные атомы водорода соединены трехцентровыми связями, образующимися в результате перекрывания sp3-гибридных орбиталей двух атомов бора с 1s-АО атома водорода (рис. 8,б). Четыре из шести пар валентных электронов участвуют в формировании обычных s-связей с "концевыми" водородными атомами, а две пары - трехцентровых связей. Более сложный пример многоцентровой связи дает молекула дибензолхрома (рис. 8,в). Бензольные кольца в этой молекуле соединяются с атомом металла сложными многоцентровыми орбиталями, образующимися в результате перекрывания p-МО бензола с 3d-, 4s- и 4р-АО центрального атома. Известны и другие аналогичные соединения, имеющие структуру типа сандвича.
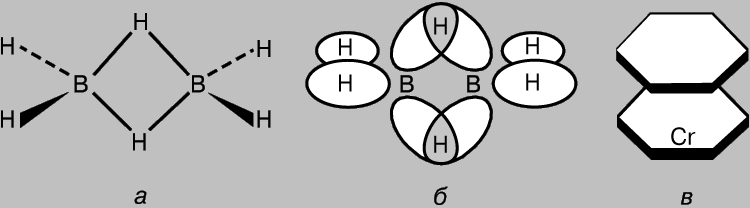
Рис. 8. У ДИБОРАНА (а) атомы водорода соединены трехцентровыми связями, образующимися в результате перекрывания sp3-гибридных орбиталей двух атомов бора с 1s-атомной орбиталью водорода (б). Более сложный пример образования связей подобного типа - молекула дибензолхрома (в).
Перспективы. К настоящему времени общие принципы строения молекул можно считать установленными. Разработаны физико-химические методы определения структуры сложных молекул, в том числе и биологических. В ближайшее время возможен прогресс в двух связанных между собой направлениях. Следует ожидать, во-первых, повышения точности квантовомеханических расчетов и, во-вторых, усовершенствования экспериментальных методов измерения соответствующих молекулярных параметров.
ЛИТЕРАТУРА
Кондратьев В.Н. Структура атомов и молекул. М., 1959 Коулсон Ч. Валентность. М., 1965 Слэтер Дж. Электронная структура молекул. М., 1965 Картмелл Э., Фоулс Г. Валентность и строение молекул. М., 1979
Полезные сервисы
молекула
Толковый словарь
Толковый словарь Ушакова
МОЛЕ́КУЛА, молекулы, жен. (от лат. moles - масса) (ест.). Мельчайшая частица вещества, способная существовать самостоятельно и обладающая всеми свойствами данного вещества. Молекулы состоят из атомов.
Толковый словарь Ожегова
МОЛЕ́КУЛА, -ы, жен. Мельчайшая частица вещества, обладающая всеми его химическими свойствами. М. состоит из атомов.
| прил. молекулярный, -ая, -ое. Молекулярная масса.
Словарь существительных
МОЛЕ́КУЛА, -ы, ж
Наименьшая частица вещества, состоящая из атомов, обладающая всеми его химическими свойствами.
Число атомов в молекуле может быть различным: от двух до сотен тысяч, например, в молекуле белков.
Энциклопедический словарь
МОЛЕ́КУЛА -ы; ж. [франц. molécule из лат.] Наименьшая частица вещества, обладающая всеми его химическими свойствами. Образование молекул воды. Водородные связи между молекулами метанола.
◁ Молекуля́рный, -ая, -ое. М-ая теория. М-ое движение. М-ая масса. М. состав вещества.
* * *
моле́кула (новолат. molecula, уменьшительное от лат. moles - масса), минимальная частица вещества, способная к самостоятельному существованию. Образована из атомов, имеет постоянный состав входящих в неё атомных ядер и фиксированное число электронов; обладает совокупностью свойств, позволяющих отличать молекулу одного вида от молекулы другого. Число атомов в молекуле может быть различным: от двух до сотен тысяч (например, в молекулах белков); состав и расположение атомов в молекуле передаёт формула химическая. Молекулярное строение вещества устанавливается рентгеноструктурным анализом, электронографией, масс-спектрометрией, ЯМР и другими методами.
* * *
МОЛЕКУЛА - МОЛЕ́КУЛА (новолат. molecula, уменьшит. от лат. moles - масса), микрочастица, образованная из атомов и способная к самостоятельному существованию. Имеет постоянный состав входящих в нее атомных ядер и фиксированное число электронов и обладает совокупностью свойств, позволяющих отличать молекулы одного вида от молекул другого. Число атомов в молекуле может быть различным: от двух до сотен тысяч (напр., в молекуле белков); состав и расположение атомов в молекуле передает формула химическая. Молекулярное строение вещества устанавливается рентгеноструктурным анализом, электронографией, масс-спектрометрией, электронным парамагнитным резонансом (ЭПР), ядерным магнитным резонансом (ЯМР) и другими методами.
Большой энциклопедический словарь
МОЛЕКУЛА (новолат. molecula - уменьшит. от лат. moles - масса), микрочастица, образованная из атомов и способная к самостоятельному существованию. Имеет постоянный состав входящих в нее атомных ядер и фиксированное Число электронов и обладает совокупностью свойств, позволяющих отличать молекулы одного вида от молекул другого. Число атомов в молекуле может быть различным: от двух до сотен тысяч (напр., в молекуле белков); состав и расположение атомов в молекуле передает формула химическая. Молекулярное строение вещества устанавливается рентгеноструктурным анализом, электронографией, масс-спектрометрией, электронным парамагнитным резонансом (ЭПР), ядерным магнитным резонансом (ЯМР) и другими методами.
Академический словарь
-ы, ж.
Наименьшая частица вещества, обладающая всеми его химическими свойствами.
[франц. molécule из лат.]
Словарь русского арго
Орфографический словарь
Словарь ударений
Формы слов для слова молекула
моле́кула, моле́кулы, моле́кул, моле́куле, моле́кулам, моле́кулу, моле́кулой, моле́кулою, моле́кулами, моле́кулах
Синонимы к слову молекула
сущ., кол-во синонимов: 10
биомолекула (1)
генонема (1)
димер (1)
макромолекула (1)
микрочастица (4)
наномолекула (1)
рибозим (1)
хромосома (11)
эксимер (1)
эписома (2)
Идеография
▲ образование (составное)
↑ атом
молекула - образование, состоящее из одинаковых или различных атомов, способное
к длительному существованию в виде индивидуального химического вещества;
между молекулами существует притяжение и отталкивание;
наименьшая частица химического соединения; первичный элемент вещества.
химическая формула.
↓ АГРЕГАТНОЕ СОСТОЯНИЕ, раствор
♥ атом
Морфемно-орфографический словарь
Грамматический словарь
Этимологический словарь
Заимств. в первой половине XIX в. из франц. яз., где molecule < н.-лат. molecula, суф. уменьшит.-ласкат. производного от moles «масса» < «усилие».
Словарь галлицизмов русского языка
МОЛЕКУЛА ы, ж. molecule f. Мельчайшая частица вещества, обладающая всеми его химическим свойствами, способная существовать самостоятельно. БАС-1. Молекюль. Веселитский 26. Молекула и молекюль. Михельсон 1865. Молекюла. Так называется безконечная вещественная частица. Лучинский 1879. А что такое, atome, molécule, particule? А что такое закон отношения числа частичек (molécules), к объему тела? 1849. Огарев - С. И. Аксакову. Значительно затруднило принятие идей Авогадро неточная номенклатура. Он сам неоднократно смешивал понятие молекула и атом в одних случах, тогда как в других он выражает атом понятием molécule élementaire, молекулу элемента - molécule constituante, а молекулу химического соединения molécule intégrale. Природа 1927 3 203.- Лекс. Толль Прил. 1866: молекула; Даль-3: молеку/л; Уш. 1938: моле/кула; СЛ. 18. молекула.
Сканворды для слова молекула
- Атомное объединение.
- «Созвездие» атомов.
- Мельчайшая частица вещества.
- Результат связи двух атомов.
- Одним из латинских переводов слова «масса» является слово «moles», а что же получилось когда к нему добавили уменьшительную частицу?
- В 1865 году Август Гофман на лекции в Лондонском Королевском обществе впервые продемонстрировал её модель при помощи крокетных шаров и вязальных спиц.
Полезные сервисы
молекулы
Энциклопедический словарь
Моле́кулы - в межзвёздной среде, молекулы и радикалы (ОН, Н2О, NH3, а также более сложные органические, всего несколько десятков), открытые в газово-пылевых облаках межзвёздной среды по спектральным линиям испускания или поглощения в диапазоне радиочастот.
* * *
МОЛЕКУЛЫ - МОЛЕ́КУЛЫ в межзвездной среде, молекулы и радикалы (ОН, Н2О, NH3, а также более сложные органические, всего несколько десятков), открытые в газово-пылевых облаках межзвездной среды по спектральным линиям испускания или поглощения в диапазоне радиочастот.
Большой энциклопедический словарь
МОЛЕКУЛЫ в межзвездной среде - молекулы и радикалы (ОН, Н2О, NH3, а также более сложные органические, всего несколько десятков), открытые в газово-пылевых облаках межзвездной среды по спектральным линиям испускания или поглощения в диапазоне радиочастот.
Полезные сервисы
молекулярная акустика
Энциклопедический словарь
Молекуля́рная аку́стика - изучает акустическими методами (главным образом на основании измерения скорости звука и его поглощения) атомно-молекулярную структуру и свойства вещества.
* * *
МОЛЕКУЛЯРНАЯ АКУСТИКА - МОЛЕКУЛЯ́РНАЯ АКУ́СТИКА, изучает акустическими методами (главным образом на основании измерения скорости звука и его поглощения) атомно-молекулярную структуру и свойства вещества.
Большой энциклопедический словарь
МОЛЕКУЛЯРНАЯ АКУСТИКА - изучает акустическими методами (главным образом на основании измерения скорости звука и его поглощения) атомно-молекулярную структуру и свойства вещества.
Полезные сервисы
молекулярная биология
Энциклопедический словарь
Молекуля́рная биоло́гия - исследует основные свойства и проявления жизни на молекулярном уровне. Выясняет, каким образом и в какой мере рост и развитие организмов, хранение и передача наследственной информации, превращение энергии в живых клетках и другие явления обусловлены структурой и свойствами биологически важных макромолекул (главным образом белков и нуклеиновых кислот). Тесно связана с биохимией и биофизикой, а исторически также с генетикой и микробиологией. Возникновение молекулярной биологии обычно относят к 1953, когда Дж. Уотсон и Ф. Крик предложили модель двойной спирали ДНК. В СССР молекулярная биология сформировалась главным образом благодаря трудам научных школ А. Н. Белозерского и В. А. Энгельгардта. Часто молекулярную биологию, включающую молекулярную генетику, объединяют с биохимией и биофизикой в физико-химическую биологию.
* * *
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - МОЛЕКУЛЯ́РНАЯ БИОЛО́ГИЯ, исследует основные свойства и проявления жизни на молекулярном уровне. Выясняет, каким образом и в какой мере рост и развитие организмов, хранение и передача наследственной информации, превращение энергии в живых клетках и др. явления обусловлены структурой и свойствами биологически важных макромолекул (главным образом белков и нуклеиновых кислот). Тесно связана с биохимией и биофизикой, а исторически также с генетикой и микробиологией. Возникновение молекулярной биологии обычно относят к 1953, когда Дж. Уотсон и Ф. Крик предложили модель двойной спирали ДНК. В СССР молекулярная биология сформировалась главным образом благодаря трудам научных школ А. Н. Белозерского (см. БЕЛОЗЕРСКИЙ Андрей Николаевич) и В. А. Энгельгардта. Часто молекулярную биологию, включающую молекулярную генетику, объединяют с биохимией и биофизикой в физико-химическую биологию.
-----------------------------------
«Молекуля́рная биоло́гия» - ежемесячный научный журнал РАН, с 1967, Москва. Учредители (1998) - Отделение биохимии, биофизики и химии физиологически активных соединений и Институт молекулярной биологии РАН.
Большой энциклопедический словарь
МОЛЕКУЛЯРНАЯ биология - исследует основные свойства и проявления жизни на молекулярном уровне. Выясняет, каким образом и в какой мере рост и развитие организмов, хранение и передача наследственной информации, превращение энергии в живых клетках и др. явления обусловлены структурой и свойствами биологически важных макромолекул (главным образом белков и нуклеиновых кислот). Тесно связана с биохимией и биофизикой, а исторически также с генетикой и микробиологией. Возникновение молекулярной биологии обычно относят к 1953, когда Дж. Уотсон и Ф. Крик предложили модель двойной спирали ДНК. В СССР молекулярная биология сформировалась главным образом благодаря трудам научных школ А. Н. Белозерского и В. А. Энгельгардта. Часто молекулярную биологию, включающую молекулярную генетику, объединяют с биохимией и биофизикой в физико-химическую биологию.
Энциклопедия Кольера
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - детальное изучение живых клеток и их составных частей (органелл), прослеживающее роль отдельных идентифицируемых соединений в функционировании этих структур. К сфере молекулярной биологии относится исследование всех связанных с жизнью процессов, таких, как питание и выделение, дыхание, секреция, рост, репродукция, старение и смерть. Важнейшее достижение молекулярной биологии - расшифровка генетического кода и выяснение механизма использования клеткой информации, необходимой, например, для синтеза ферментов. Молекулярнобиологические исследования способствуют и более полному пониманию других процессов жизнедеятельности - фотосинтеза, клеточного дыхания и мышечной активности. В молекулярной биологии предпочитают работать с относительно простыми системами, такими, как одноклеточные организмы (бактерии, некоторые водоросли), в которых число компонентов сравнительно невелико, а значит, и различить их легче. Но и при этом требуются весьма изощренные методы для того, чтобы точно локализовать отдельные вещества и отличить их от всех других. На основе физико-химических подходов и инструментария разработаны сложные, чувствительные приборы и методы, приспособленные для работы с органическими соединениями живых систем. Метод радиоавтографии основан на включении в определенные вещества радиоактивных атомов, т.н. "радиоактивной метки", которая позволяет проследить - по испускаемому излучению - химические превращения этих веществ. При изучении низкомолекулярных веществ применяют методы, позволяющие объединить малые молекулы вещества в т.н. макромолекулы, достаточно крупные для того, чтобы их можно было наблюдать при большом увеличении трансмиссионного электронного микроскопа. По дифрации рентгеновских лучей определяют общую форму макромолекул, как это было сделано, например, с дезоксирибонуклеиновой кислотой (ДНК). Для разделения смеси веществ, различающихся по размерам и химическому составу, используют различия в скорости их передвижения в электрическом поле (метод электрофореза) или разную скорость диффузии в растворителе, протекающем через неподвижную фазу, например бумагу (метод хроматографии). С помощью соответствующих ферментов можно определить нуклеотидную последовательность генов, а по ней - аминокислотную последовательность синтезируемых белков. Если у животных разных видов близки нуклеотидные последовательности генов, кодирующих общие для них белки, например гемоглобин, можно заключить, что в прошлом эти животные имели общего предка. Если же различия в их генах велики, то ясно, что расхождение видов от общего предка произошло намного раньше. Такие молекулярно-биологические исследования открыли новый подход к изучению эволюции организмов. Важный вклад в медицину должна внести идентификация вирусов по их составу. С ее помощью можно, например, установить, что вирус, вызывающий ту или иную болезнь у человека, гнездится естественным образом в каком-нибудь диком животном, от которого и передается человеку болезнь. Если у животных, которые служат в природе резервуаром данного вируса, симптомы болезни не обнаруживаются, то, видимо, здесь действует какой-то механизм иммунитета, и тогда возникает новая задача - изучить этот механизм, чтобы попытаться включить его в иммунную систему человека. Областью молекулярной биологии, вызывающей большие споры и часто неприятие, является генная инженерия, или технология рекомбинантных ДНК, суть которой в том, что в организм растения или животного встраивают чужие гены, чтобы придать ему новые свойства или же компенсировать какие-нибудь наследственные дефекты. См. также
ЛИТЕРАТУРА
Рис Э., Стернберг М. От клеток к атомам. Иллюстрированное введение в молекулярную биологию. М., 1988 Албертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки, тт. 1-3. М., 1994
Иллюстрированный энциклопедический словарь
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ, исследует основные свойства и проявления жизни на молекулярном уровне. Выясняет, каким образом и в какой мере рост и развитие организмов, хранение и передача наследственной информации, превращение энергии в живых клетках и другие явления обусловлены структурой и свойствами биологически важных макромолекул (главным образом белков и нуклеиновых кислот). Возникновение молекулярной биологии обычно относят к 1953, когда Дж. Уотсон (США) и Ф. Крик (Великобритания) предложили модель двойной спирали дезоксирибонуклеиновой кислоты(ДНК).
Полезные сервисы
молекулярная генетика
Энциклопедический словарь
Молекуля́рная гене́тика - направление в молекулярной биологии; изучает молекулярные основы наследственности и изменчивости организмов. Возникла в середине XX в. в результате использования идей и методов физики и химии для решения генетических проблем. Основные достижения молекулярной генетики - установление химической структуры гена (1953), расшифровка способов записи и реализации наследственной информации в организме, разработка методов генетической инженерии.
* * *
МОЛЕКУЛЯРНАЯ ГЕНЕТИКА - МОЛЕКУЛЯ́РНАЯ ГЕНЕ́ТИКА, изучает молекулярные основы наследственности и изменчивости организмов. Возникла в 40-50-х гг. 20 в. в результате использования идей и методов физики и химии для решения генетических проблем. Основные достижения молекулярной генетики - установление химической структуры гена (1953), расшифровка способов записи и реализации наследственной информации в организме, разработка методов генетической инженерии (см. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ).
Большой энциклопедический словарь
МОЛЕКУЛЯРНАЯ ГЕНЕТИКА - изучает молекулярные основы наследственности и изменчивости организмов. Возникла в 40-50-х гг. 20 в. в результате использования идей и методов физики и химии для решения генетических проблем. Основные достижения молекулярной генетики - установление химической структуры гена (1953), расшифровка способов записи и реализации наследственной информации в организме, разработка методов генетической инженерии.
Полезные сервисы
молекулярная масса
Энциклопедический словарь
Молекуля́рная ма́сса (молекулярный вес), масса молекулы, выраженная в атомных единицах массы. Практически равна сумме масс всех атомов, из которых состоит молекула. Величины молекулярной массы используются в химических, физических и химико-технологических расчётах.
* * *
МОЛЕКУЛЯРНАЯ МАССА - МОЛЕКУЛЯ́РНАЯ МА́ССА (молекулярный вес), масса молекулы, выраженная в атомных единицах массы. Практически равна сумме масс всех атомов, из которых состоит молекула. Величины молекулярной массы используются в химических, физических и химико-технических расчетах.
Большой энциклопедический словарь
МОЛЕКУЛЯРНАЯ масса (молекулярный вес) - масса молекулы, выраженная в атомных единицах массы. Практически равна сумме масс всех атомов, из которых состоит молекула. Величины молекулярной массы используются в химических, физических и химико-технических расчетах.
Энциклопедия Кольера
МОЛЕКУЛЯРНАЯ МАССА - масса молекулы, выраженная в относительных единицах (называемых а.е.м. или дальтон). Эта величина введена для удобства, поскольку действительная масса молекул в общепринятых единицах массы чрезвычайно мала. За единицу мол. массы принята та же величина, что и при определении атомной массы: это 1/12 массы атома изотопа углерода-12, условно принятой равной 12
(см. АТОМНАЯ МАССА).
Мол. масса численно равна сумме относительных атомных масс всех атомов данной молекулы и легко подсчитывается по формуле вещества.
Газы и пары. Согласно закону Авогадро, в равных объемах газов при одинаковых давлении и температуре содержится одинаковое число молекул. Следовательно, один моль любого газа при данных температуре и давлении должен занимать один и тот же объем (один из законов идеальных газов; см. ХИМИЯ). С учетом поправок на неидеальность объем одного моля (6,02*10 23 молекул) любого газа при 0° С и 1 атм равен 22,414 л. На основании закона Авогадро находят мол. массу газообразных веществ. В общих чертах процедура состоит в следующем. Определяют массу известного объема газа при данных давлении и температуре. После введения поправок на неидеальность приводят объем к условиям 0° С и 1 атм, используя уравнение состояния идеального газа PV = RT, где R - газовая постоянная. Зная массу и объем идеального газа при °С и 1 атм, нетрудно рассчитать массу 22,414 л газа, т.е. его мол. массу. Этим методом были получены точные значения мол. масс, которые использовались даже для определения атомных масс. Для приближенной оценки мол. массы газ считают идеальным и никаких поправок не делают. Данный метод часто применяют при определении мол. масс летучих жидкостей и твердых веществ. Для этого используют уравнение состояния газа в виде PV = wRT/M (уравнение Клапейрона - Менделеева), где w - масса паров вещества с мол. массой М, занимающих объем V при температуре Т и давлении Р. Если Р выражено в атм, а V - в см3 или мл, то R = 82,06. Отсюда получаем M = wRT/PV и, зная все величины в правой части, находим мол. массу паров вещества. Для определения таким методом мол. масс летучих жидкостей и твердых веществ было создано несколько устройств. Наибольшее распространение получил прибор немецкого химика В.Мейера (1878) - длинная вертикальная трубка, закрытая сверху и расширяющаяся книзу в виде конической колбы, окруженная нагревательной рубашкой. Известное количество изучаемой жидкости (или твердого вещества) помещали на дно колбы и испаряли. При испарении эквивалентный объем воздуха вытеснялся через боковой отвод вверху трубки в измерительное устройство. Объем вытесненного воздуха, измеренный при температуре и давлении окружающей среды, равен объему паров изучаемого вещества в этих же условиях. Зная w, Т и Р, можно вычислить М - мол. массу паров вещества. Усовершенствовав аппарат В.Мейера, можно было проводить измерения при температурах до 2000° С.
Растворы. Мол. массу трудноиспаряющихся веществ определяют, исследуя свойства их растворов. Если нелетучее вещество растворить в летучем жидком растворителе, то давление паров последнего уменьшится. Соответственно температура кипения раствора возрастет, а температура замерзания понизится по сравнению с чистым растворителем. Все эти величины пропорциональны числу молей растворенного вещества в данном объеме растворителя (при условии, что раствор является разбавленным); это позволяет определить мол. массу вещества в растворе. Пусть Dр - изменение давления паров разбавленного раствора при добавлении w2 граммов растворенного вещества с мол. массой М2 в w1 граммов растворителя с мол. массой М1, р - давление паров чистого растворителя при той же температуре. Тогда Dр = pw2 M1/w1 M2, откуда М2 = рw2 М1/w1Dр Поскольку давление паров трудно измерить с достаточной точностью, этот метод применяют довольно редко и только в усовершенствованном варианте. Наиболее распространен метод определения мол. массы растворенных веществ, основанный на измерении температур замерзания или кипения растворов. Если DТ - понижение температуры замерзания или повышение температуры кипения раствора по сравнению с чистым растворителем, то DТ = K*1000w2/w1 М2, где K - молярная криоскопическая или эбулиоскопическая постоянная для данного растворителя. Отсюда М2 = K*1000w2/w1DТ. Постоянную K можно определить экспериментально, используя растворенные вещества с известной мол. массой, или найти с помощью термодинамических расчетов. Отметим, что приведенное соотношение применимо для определения мол. масс только очень разбавленных растворов.
Метод Бекмана. В этом методе измеряют температуру замерзания известного количества растворителя (w1), затем добавляют в него заданное количество растворенного вещества (w2) и измеряют понижение температуры замерзания раствора с помощью термометра Бекмана. Этот термометр регистрирует не саму температуру, а разность температур, но с точностью 0,001° С. При измерениях могут возникать ошибки, связанные с переохлаждением раствора. Для их устранения применяют более совершенные модификации прибора. Для приближенной оценки мол. массы существует более простой метод Раста, где в качестве растворителя используют камфору, температура замерзания которой при растворении в ней различных веществ понижается очень сильно и может быть измерена обычным термометром.
Методы Ландсбергера и Котрелла. Бекман сконструировал также прибор для измерения повышения температуры кипения растворов, но здесь возникают те же проблемы, что и при измерении точки замерзания, а именно связанные с перегревом раствора. Для приближенных оценок используется метод Ландсбергера, в котором жидкость нагревают до температуры кипения, пропуская через нее пар. Для точных определений предпочтительна методика Котрелла. В ней термометр не погружают в жидкость, а помещают над ее поверхностью, так что пузырьки пара, поднимающиеся вверх, увлекают за собой жидкость, и она омывает термометр. Это позволяет избежать ошибок, связанных с перегревом.
Другие методы. Еще один метод определения мол. массы растворенных веществ основан на измерении осмотического давления. Для разбавленного раствора, содержащего известное количество w граммов растворенного вещества с мол. массой М в объеме растворителя V, осмотическое давление Р при температуре Т равно P = wRT/MV. Если Р выражено в атм, а V - в см3 или мл, то константа R = 82,06 (см. выше). Измерить осмотическое давление растворов для обычных веществ довольно трудно. Однако этот метод оказался весьма полезным для определения мол. масс высокомолекулярных соединений, поскольку создаваемое ими осмотическое давление достаточно велико и можно получить точные данные на относительно простой аппаратуре. Высокомолекулярные соединения имеют большое практическое значение, поэтому методы определения их мол. масс совершенствуются. Можно упомянуть методы, основанные на измерении вязкости и рассеяния света, а также ультрацентрифугирование. Последний применяется наиболее широко для определения мол. масс биополимеров (нуклеиновых кислот и белков).
Масс-спектрометрический метод. Этим принципиально иным, чем все рассмотренные выше, методом определяют массу разных видов молекул или разных изотопов, находящихся в исследуемом объеме. Особую ценность он представляет для изотопного анализа. Допустим, требуется определить, содержится ли в образце метана СН4 изотоп 13С помимо обычного изотопа 12С. У обычного метана мол. масса равна 16, а у его изотопического варианта 17. В масс-спектре ему соответствует отдельная линия, по положению которой можно точно определить мол. массу.
См. также СПЕКТРОСКОПИЯ.
ЛИТЕРАТУРА
Гуггенгейм Э., Пру Дж. Физико-химические расчеты. М., 1958 Некрасов Б.В. Основы общей химии. М., 1962
Полезные сервисы
молекулярная оптика
Энциклопедический словарь
Молекуля́рная о́птика - раздел оптики, изучающий связь оптических свойств вещества со свойствами его атомов и молекул. В молекулярной оптике исследуются отражение, преломление и рассеяние света, оптическая активность, магнитооптические и электрооптические явления и др.
* * *
МОЛЕКУЛЯРНАЯ ОПТИКА - МОЛЕКУЛЯ́РНАЯ О́ПТИКА, раздел оптики, изучающий связь оптических свойств вещества со свойствами его атомов и молекул. В молекулярной оптике исследуются отражение, преломление и рассеяние света, оптическая активность, магнитооптические и электрооптические явления и др.
Большой энциклопедический словарь
МОЛЕКУЛЯРНАЯ ОПТИКА - раздел оптики, изучающий связь оптических свойств вещества со свойствами его атомов и молекул. В молекулярной оптике исследуются отражение, преломление и рассеяние света, оптическая активность, магнитооптические и электрооптические явления и др.
Полезные сервисы
молекулярная физика
Энциклопедический словарь
Молекуля́рная фи́зика - раздел физики, изучающий физические свойства тел в различных агрегатных состояниях на основе рассмотрения их молекулярного строения. Из молекулярной физики выделились в самостоятельные разделы физика твёрдого тела, физическая кинетика, физическая химия и т. д.
* * *
МОЛЕКУЛЯРНАЯ ФИЗИКА - МОЛЕКУЛЯ́РНАЯ ФИ́ЗИКА, раздел физики (см. ФИЗИКА), изучающий физические свойства тел в различных агрегатных состояниях на основе рассмотрения их молекулярного строения. В зависимости от молекулярного строения тел, сил межмолекулярного взаимодействия и характера теплового движения частиц, молекулярная физика изучает особенности процессов фазового равновесия и фазовых переходов веществ - кристаллизацию и плавление, испарение и конденсацию и др., явления переноса - диффузию, теплопроводность, внутреннее трение, а также поверхностные явления на границах раздела различных фаз.
Разделами молекулярной физики являются физика газообразного состояния вещества, физика конденсированного состояния вещества (жидкости и твердые тела), физические явления в поверхностных слоях различных соприкасающихся фаз и др. Из молекулярной физики выделились в самостоятельные разделы физика твердого тела (см. ФИЗИКА ТВЕРДОГО ТЕЛА), физическая химия (см. ФИЗИЧЕСКАЯ ХИМИЯ), молекулярная биология (см. МОЛЕКУЛЯРНАЯ БИОЛОГИЯ) и т. д.
Задачи молекулярной физики решаются методами статистической физики (см. СТАТИСТИЧЕСКАЯ ФИЗИКА), термодинамики (см. ТЕРМОДИНАМИКА) и физической кинетики (см. КИНЕТИКА ФИЗИЧЕСКАЯ). Они связаны с изучением движения и взаимодействия частиц (атомов, молекул, ионов), составляющих физические тела.
Первым сформировавшимся разделом молекулярной физики была кинетическая теория газов (см. КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ). В процессе ее развития была создана классическая статистическая физика, которая наряду с термодинамическим методом легла в основу методов теоретического исследования в молекулярной физике.
Статистический метод, используемый и развитый в молекулярной физике, состоит в изучении совокупностей большого числа частиц, участвующих в тепловом движении и образующих физические тела, находящиеся в различных агрегатных состояниях. Законы поведения совокупностей большого числа частиц, исследуемых статистическими методами, называются статистическими закономерностями. Математическим аппаратом метода является теория случайных величин и процессов. То есть статистический метод является методом исследования систем, состоящих из большого количества частиц, и использующий статистические закономерности и средние значения физических величин, характеризующих всю совокупность частиц.
Статистический подход является по сути молекулярно-кинетической теорией, основанной на определенных представлениях о строении вещества. Задачей статистической механики является установление законов поведения макроскопических систем, состоящих из большого числа частиц, на основе известных динамических законов поведения отдельных частиц. При этом статистическая механика дает возможность установить связь между макроскопическими параметрами большой системы и средними значениями микроскопических величин, характеризующих отдельные молекулы. Так как макроскопические параметры системы зависят от движения молекул, задачей статистической физики заключается в том, чтобы выразить свойства системы в целом через характеристики отдельных молекул.
Термодинамический метод исследования систем, состоящих из большого числа частиц, отличается от статистического тем, что оперирует величинами, характеризующими систему в целом, такими как, например, температура и давление. Термодинамические методы не рассматривают процессы, происходящие на микроуровне.
Термодинамический метод исследования систем, состоящих из большого числа структурных элементов, строится на основе применения к системам нескольких принципов, гипотез, аксиом, которые либо являются обобщением опыта, либо их применение не противоречит ему. Термодинамика представляет собой феноменологическую теорию, основанную на небольшом числе установленных законов, таких, как, например, закон сохранения энергии. В методе не рассматривают микроструктуру систем и механизм совершающихся в них микропроцессов. Основные понятия термодинамики вводятся на основе физического эксперимента, при этом связь между различными макроскопическими параметрами устанавливается опытным путем. Поэтому результаты и методы термодинамики могут быть применимы для любых систем без конкретизации деталей их устройств. Термодинамический подход дает возможность решать конкретные задачи, не имея сведений о свойствах атомов или молекул.
На основе общих теоретических представлений молекулярной физики получили развитие такие специальные области науки, как физика металлов, физика полимеров, физика плазмы, кристаллофизика (см. КРИСТАЛЛОФИЗИКА), физико-химическую механика, физико-химия дисперсных систем и поверхностных явлений, теория тепло- и массопереноса. При всём различии объектов и методов исследования сохраняется основная идея молекулярной физики - описание макроскопических свойств вещества, исходя из особенностей микроскопической (молекулярной) картины его строения.
Большой энциклопедический словарь
МОЛЕКУЛЯРНАЯ физика - раздел физики, изучающий физические свойства тел в различных агрегатных состояниях на основе рассмотрения их молекулярного строения. Из молекулярной физики выделились в самостоятельные разделы физика твердого тела, физическая кинетика, физическая химия и т. д.
Синонимы к слову молекулярная физика
Полезные сервисы
молекулярно-кинетическая теория
Энциклопедия Кольера
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ - раздел молекулярной физики, рассматривающий многие свойства веществ исходя из представлений о быстром хаотическом движении огромного числа атомов и молекул, из которых эти вещества состоят. Молекулярно-кинетическая теория концентрирует внимание не на различиях между отдельными типами атомов и молекул, а на том общем, что имеется в их поведении. Еще древнегреческие философы, первыми высказывавшие атомистические идеи, полагали, что атомы находятся в непрерывном движении. Количественный анализ этого движения попытался дать Д.Бернулли в 1738. Принципиальный вклад в развитие молекулярно-кинетической теории был сделан в период с 1850 по 1900 Р.Клаузиусом в Германии, Л.Больцманом в Австрии и Дж.Максвеллом в Англии. Эти же физики заложили основы статистической механики - более абстрактной дисциплины, занимающейся изучением того же предмета, что и молекулярно-кинетическая теория, но без построения детальных, а потому менее общих моделей. Углубление статистического подхода в начале 20 в. связано главным образом с именем американского физика Дж.Гиббса, который считается одним из основоположников статистической механики. Революционные идеи были привнесены в эту науку также М.Планком и А.Эйнштейном. В середине 1920-х годов классическая механика окончательно уступила место новой, квантовой, механике. Она дала импульс развитию статистической механики, не прекращающемуся до сих пор.
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ТЕПЛОТЫ
Известно, что нагретые тела, остывая, отдают часть своей теплоты более холодным телам. До 19 в. считалось, что теплота - это некая жидкость (теплород), перетекающая от одного тела к другому. Одним из главных достижений физики 19 в. стало то, что теплота стала рассматриваться просто как одна из форм энергии, а именно - кинетическая энергия атомов и молекул. Такое представление распространяется на все вещества - твердые, жидкие и газообразные. Частицы нагретого тела движутся быстрее, чем холодного. Например, солнечные лучи, нагревая нашу кожу, заставляют ее молекулы колебаться быстрее, и мы ощущаем эти колебания как тепло.
На холодном ветру молекулы воздуха, сталкиваясь с молекулами поверхности нашего тела, отбирают у них энергию, и мы ощущаем холод. Во всех случаях, когда тепло передается от одного тела к другому, движение частиц в первом из них замедляется, во втором ускоряется, а энергия частиц второго тела увеличивается ровно на столько, на сколько уменьшается энергия частиц первого. Многие знакомые нам тепловые явления можно непосредственно объяснить с помощью молекулярно-кинетической теории. Поскольку теплота порождается беспорядочным движением молекул, можно повышать температуру тела (увеличивать запас теплоты в нем) не за счет подвода тепла, а, например, с помощью трения: молекулы трущихся поверхностей, соударяясь друг с другом, начинают двигаться более интенсивно, и температура поверхностей повышается. По той же причине нагревается кусок железа, когда по нему бьют молотом. Еще одно тепловое явление - увеличение давления газов при нагревании. С повышением температуры скорость движения молекул увеличивается, они чаще и сильнее ударяются о стенки сосуда, в котором газ находится, что проявляется в повышении давления. Постепенное испарение жидкостей объясняется тем, что их молекулы одна за другой переходят в воздух, при этом первыми улетучиваются самые быстрые из них, а у тех, которые остаются, энергия в среднем оказывается меньше. Вот почему при испарении жидкостей с влажной поверхности она охлаждается. Математический аппарат, построенный на молекулярно-кинетической теории, позволяет анализировать эти и многие другие эффекты, исходя из уравнений движения молекул и общих положений теории вероятностей. Предположим, что мы подняли резиновый мяч на некоторую высоту, а затем выпустили его из рук. Мяч ударится об пол, а затем несколько раз подскочит, каждый раз на меньшую высоту, чем перед этим, поскольку при ударе часть его кинетической энергии превращается в теплоту. Такой удар называется частично упругим. Кусок свинца совсем не отскакивает от пола - при первом же ударе в теплоту превращается вся его кинетическая энергия, и температура куска свинца и пола слегка повышается. Такой удар называют абсолютно неупругим. Удар, при котором вся кинетическая энергия тела сохраняется, не превращаясь в тепло, называется абсолютно упругим. В газах при столкновении атомов и молекул друг с другом происходит лишь обмен их скоростями (мы не рассматриваем здесь случай, когда в результате столкновений частицы газа взаимодействуют - вступают в химические реакции); суммарная кинетическая энергия всей совокупности атомов и молекул не может при этом превратиться в теплоту, поскольку она уже ею является. Непрерывное движение атомов и молекул вещества называется тепловым движением. В жидкостях и твердых телах картина более сложная: помимо кинетической энергии необходимо учитывать и потенциальную энергию взаимодействия частиц.
Тепловое движение в воздухе. Если воздух охладить до очень низкой температуры, то он превратится в жидкость, при этом объем образовавшейся жидкости будет очень мал. Например, при ожижении 1200 см3 атмосферного воздуха получаются 2 см3 жидкого воздуха. Основное допущение атомной теории состоит в том, что размеры атомов и молекул при изменении агрегатного состояния вещества почти не изменяются. Следовательно, в атмосферном воздухе молекулы должны находиться друг от друга на расстояниях, гораздо больших, чем в жидкости. Действительно, из 1200 см3 атмосферного воздуха более 1198 см3 занимает пустое пространство. Молекулы воздуха движутся хаотически в этом пространстве с очень высокими скоростями, постоянно сталкиваясь друг с другом наподобие бильярдных шаров.
Давление газа или пара. Рассмотрим прямоугольный сосуд, в единице объема которого содержится n молекул газа массой m каждая. Нас будут интересовать только те молекулы, которые ударяются об одну из стенок сосуда. Выберем ось x так, чтобы она была перпендикулярна этой стенке и рассмотрим молекулу, у которой составляющая скорости v вдоль выбранной нами оси равна vx. При ударе молекулы о стенку сосуда ее импульс в направлении оси x изменится на величину -2mvx. В соответствии с третьим законом Ньютона таков же будет импульс, переданный стенке. Можно показать, что если все молекулы движутся с одинаковыми скоростями, то с единицей площади стенки в 1 с сталкивается (1/2) nvx молекул. Чтобы убедиться в этом, рассмотрим пограничный слой газа вблизи одной из стенок, заполненный молекулами с одинаковыми величинами v и vx (рис. 1). Предположим, что толщина этого слоя настолько мала, что большинство молекул пролетают его без столкновений. Молекула А долетит до стенки в момент времени t = l /vx ; к этому времени о стенку ударится ровно половина молекул из пограничного слоя (другая половина движется от стенки). Их число определяется плотностью газа и объемом пограничного слоя площадью А и толщиной l: N = (1/2) nAl. Тогда число молекул, ударившихся о единичную площадку за 1 с, составит N/At = (1/2) nvx, и полный импульс, переданный этой площадке за 1 с, будет равен (1/2) nvx Ч2mvx = nmvx2. На самом деле составляющая vх неодинакова для разных молекул, поэтому величину vx2 следует заменить ее средним значением
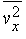
Если молекулы движутся хаотически, то среднее всех vх равно среднему для vy и vz, так что
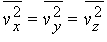
и
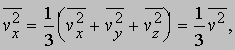
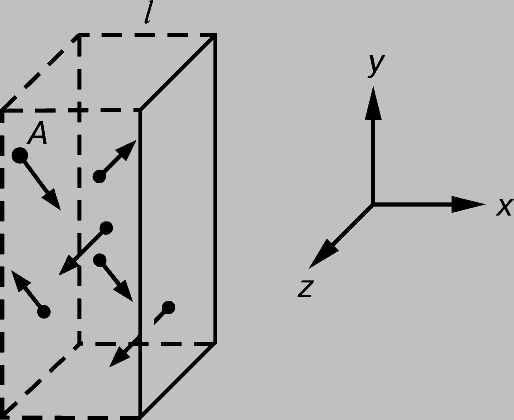
Рис. 1. ДАВЛЕНИЕ ГАЗА на стенки сосуда можно найти, рассматривая импульс, передаваемый молекулами стенкам.
где - среднее для всех молекул значение v2. Удары молекул о стенку так быстро следуют один за другим, что последовательность передаваемых импульсов воспринимается как постоянное давление Р. Величину Р можно найти, если вспомнить, что давление - это сила, действующая на единицу площади, а сила, в свою очередь, - это скорость изменения импульса. Следовательно, Р равно скорости изменения импульса, приходящегося на единицу площади, т.е.
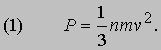
Такое же соотношение мы получим, если вместо случайного движения молекул во всех направлениях будем рассматривать движение одной шестой их числа перпендикулярно каждой из шести граней прямоугольного сосуда, считая, что каждая молекула обладает кинетической энергией
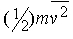
.
Закон Бойля - Мариотта. В формуле (1) через n обозначено не полное число молекул, а число молекул в единице объема. Если то же число молекул поместить в половину объема (не изменив при этом температуру), то величина n удвоится, при этом удвоится и давление, если v2 не зависит от плотности. Иначе говоря, при постоянной температуре давление газа обратно пропорционально объему. Английский физик Р. Бойль и французский физик Э. Мариотт экспериментально установили, что при низких давлениях это утверждение справедливо для любого газа. Таким образом, закон Бойля - Мариотта можно объяснить, сделав разумное предположение, что при низких давлениях скорость молекул не зависит от n.
Закон Дальтона. Если в сосуде находится смесь газов, т.е. имеются несколько разных сортов молекул, то импульс, передаваемый стенке молекулами каждого сорта, не зависит от того, присутствуют ли молекулы других сортов. Таким образом, согласно молекулярно-кинетической теории, давление смеси двух или большего числа идеальных газов равно сумме давлений, которые создавал бы каждый из газов, если бы занимал весь объем. В этом и состоит закон Дальтона, которому подчиняются газовые смеси при низких давлениях.
Скорости молекул. Формула (1) позволяет оценить среднюю скорость молекул газа. Так, атмосферное давление на уровне моря составляет примерно 106 дин/см2 (0,1 МПа), а масса 1 см3 воздуха равна 0,0013 г. Подставив эти значения в формулу (1), мы получим для скорости молекул очень большую величину:
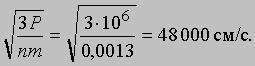
На большой высоте над уровнем моря, где атмосфера очень разрежена, молекулы воздуха за секунду могут перемещаться на огромные расстояния, не сталкиваясь друг с другом. У поверхности Земли наблюдается иная картина: за 1 с каждая молекула сталкивается с другими молекулами в среднем ок. 800 миллионов раз. Она описывает в высшей степени изломанную траекторию, и в отсутствие воздушных потоков через одну секунду с высокой вероятностью оказывается на расстоянии всего 1-2 см от того места, где она находилась в начале этой секунды.
Закон Авогадро. Как мы уже говорили, воздух при комнатной температуре имеет плотность примерно 0,0013 г/см3 и создает давление МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ106 дин/см2. Газообразный водород, плотность которого при комнатной температуре равна всего лишь 0,00008 г/см3, тоже создает давление в 106 дин/см2. Согласно формуле (1), давление газа пропорционально числу молекул в единице объема и их средней кинетической энергии. В 1811 итальянский физик А.Авогадро выдвинул гипотезу, согласно которой равные объемы различных газов при одинаковых температуре и давлении содержат одинаковое число молекул. Если эта гипотеза верна, то из соотношения (1) получим, что для разных газов при указанных выше условиях величина (1/2) mv2 одинакова, т.е. одинакова средняя кинетическая энергия молекул. Этот вывод вполне согласуется с молекулярно-кинетической теорией
(см. также ТЕПЛОТА).
Масса 1 см3 водорода мала не потому, что в данном объеме присутствует меньше молекул, а потому, что масса каждой молекулы водорода в несколько раз меньше массы молекулы азота или кислорода - газов, из которых в основном состоит воздух. Установлено, что число молекул любого газа в 1 см3 при 0° С и нормальном атмосферном давлении равно 2,687*10 19.
Средняя длина свободного пробега. Важной величиной в молекулярно-кинетической теории газов является среднее расстояние, пробегаемое молекулой между двумя столкновениями. Эта величина называется средней длиной свободного пробега и обозначается через L. Вычислить ее можно следующим образом. Представим себе, что молекулы - это сферы радиусом r ; тогда их центры при столкновении будут находиться на расстоянии 2r друг от друга. При своем движении молекула "задевает" все молекулы в пределах поперечного сечения площадью p (2r)2 и, перемещаясь на расстояние L, она "заденет" все молекулы в объеме 4pr2L, так что среднее число молекул, с которыми она столкнется, будет равно 4pr2Ln. Чтобы найти L, нужно принять это число равным 1, откуда
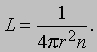
Из этого соотношения можно прямо найти радиус молекулы, если известна величина L (ее можно найти из измерений вязкости газа; см. ниже). Величина r оказывается порядка 10-8 см, что согласуется с результатами других измерений, а L для типичных газов при обычных условиях составляет от 100 до 200 диаметров молекул. В таблице приведены значения L для атмосферного воздуха на разной высоте над уровнем моря.
РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО СКОРОСТЯМ
В середине 19 в. происходило не только развитие молекулярно-кинетической теории, но и становление термодинамики. Некоторые понятия термодинамики оказались полезными и для молекулярно-кинетической теории - это в первую очередь абсолютная температура и энтропия.
Тепловое равновесие. В термодинамике свойства веществ рассматриваются в основном исходя из представления о том, что любая система стремится к состоянию с наибольшей энтропией и, достигнув такого состояния, не может самопроизвольно выйти из него. Такое представление согласуется с молекулярно-кинетическим описанием поведения газа. Совокупность молекул газа обладает некоторой суммарной энергией, которая может быть распределена между отдельными молекулами огромным числом способов. Каким бы ни было начальное распределение энергии, если газ предоставить самому себе, то энергия быстро перераспределится и газ придет в состояние теплового равновесия, т.е. в состояние с наибольшей энтропией. Попытаемся сформулировать это утверждение более строго. Пусть N (E) dЕ - это число молекул газа с кинетической энергией в интервале от E до Е + dE. Независимо от начального распределения энергии газ, предоставленный сам себе, придет в состояние теплового равновесия с характерной функцией N (E), соответствующей установившейся температуре. Вместо энергий можно рассматривать скорости молекул. Обозначим через f (v) dv число молекул со скоростями, лежащими в интервале от v до v + dv. В газе всегда найдется некоторое число молекул со скоростями в интервале от v до v + dv. Уже мгновение спустя ни одна из этих молекул не будет обладать скоростью, лежащей в указанном интервале, поскольку все они претерпят одно или несколько столкновений. Но зато другие молекулы со скоростями, ранее значительно отличавшимися от v, в результате столкновений приобретут скорости, лежащие в интервале от v до v + dv. Если газ находится в стационарном состоянии, то число молекул, которые приобретут скорость v, через достаточно большой промежуток времени будет равно числу молекул, скорость которых перестанет быть равной v. Только в этом случае функция n (v) может оставаться постоянной. Это число, разумеется, зависит от распределения молекул газа по скоростям. Форму этого распределения в покоящемся газе установил Максвелл: если всего имеется N молекул, то число молекул со скоростями в интервале от v до v + dv равно
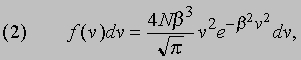
где параметр b зависит от температуры (см. ниже).
Газовые законы. Приведенные выше оценки для средней скорости молекул воздуха на уровне моря соответствовали обычной температуре. Согласно молекулярно-кинетической теории, кинетическая энергия всех молекул газа и есть та теплота, которой он обладает. При более высокой температуре молекулы движутся быстрее и газ содержит больше теплоты. Как следует из формулы (1), если объем газа постоянен, то с ростом температуры его давление повышается. Именно так ведут себя все газы (закон Шарля). Если же газ нагревать при постоянном давлении, то он будет расширяться. Установлено, что при низком давлении для любого газа объемом V, содержащим N молекул, произведение давления на объем пропорционально абсолютной температуре:
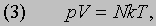
где T - абсолютная температура, k - константа. Из закона Авогадро следует, что величина k одинакова для всех газов. Она называется постоянной Больцмана и равна 1,38*10 -14 эрг/К. Сравнив выражения (1) и (3), нетрудно заметить, что полная энергия поступательного движения N молекул, равная (1/2) Nmv2, пропорциональна абсолютной температуре и равна
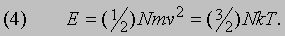
С другой стороны, проинтегрировав выражение (2), получим, что полная энергия поступательного движения N молекул равна 3Nm /4b 2. Отсюда
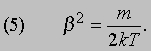
Подставив выражение (5) в формулу (2), можно найти распределение молекул по скоростям при любой температуре T. Молекулы многих распространенных газов, например азота и кислорода (основных компонентов атмосферного воздуха), состоят из двух атомов, а их молекула напоминает по форме гантель. Каждая такая молекула не только движется поступательно с огромной скоростью, но и очень быстро вращается. Помимо энергии поступательного движения, N молекул обладают энергией вращательного движения NkT, так что полная энергия N молекул равна (5/2) NkT.
Экспериментальная проверка распределения Максвелла. В 1929 появилась возможность непосредственно находить распределение молекул газа по скоростям. Если в стенке сосуда, содержащего газ или пар при определенной температуре, проделать маленькое отверстие или прорезать узкую щель, то молекулы будут вылетать через них наружу, каждая со своей скоростью. Если отверстие ведет в другой сосуд, из которого откачан воздух, то большинство молекул до первого столкновения успеют пролететь расстояние в несколько сантиметров. В установке, схематически изображенной на рис. 2, имеется сосуд V, содержащий газ или пар, молекулы которого вылетают через щель S1; S2 и S3 - щели в поперечных пластинах; W1 и W2 - два диска, насаженных на общий вал R. В каждом диске прорезано несколько радиальных щелей. Щель S3 расположена так, что, если бы не было дисков, вылетевшие из щели S1 и прошедшие сквозь щель S2 молекулы пролетали бы и сквозь щель S3 и попадали на детектор D. Если одна из щелей диска W1 окажется напротив щели S2, то молекулы, пролетевшие сквозь щели S1 и S2, пройдут и сквозь щель диска W1, но их задержит диск W2, насаженный на вал R так, что его щели не совпадают со щелями диска W1. Если диски неподвижны или медленно вращаются, то молекулы из сосуда V не попадают в детектор D. Если же диски быстро вращаются с постоянной скоростью, то некоторые из молекул проходят сквозь оба диска. Нетрудно понять, какие молекулы смогут преодолеть оба препятствия, - те, которые преодолеют расстояние от W1 до W2 за время, необходимое для смещения щели диска W2 на нужный угол. Например, если все щели диска W2 повернуты на угол 2° относительно щелей диска W1, то в детектор попадут молекулы, которые пролетают от W1 до W2 за время поворота диска W2 на 2°. Изменяя частоту вращения вала с дисками, можно измерять скорости молекул, вылетающих из сосуда V, и построить их распределение. Полученное таким образом распределение хорошо согласуется с максвелловским.
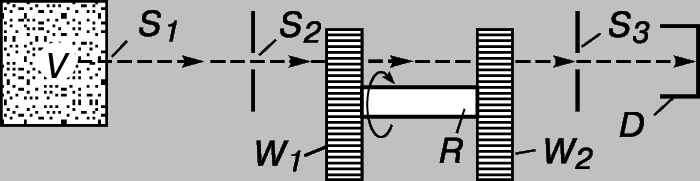
Рис. 2. СХЕМА УСТАНОВКИ для исследования распределения молекул газа по скоростям.
Броуновское движение. В 19 в. метод измерения скоростей молекул, описанный выше, еще не был известен, но одно явление позволяло наблюдать непрестанное тепловое движение молекул в жидкости. Шотландский ботаник Р.Браун (в прежней транскрипции - Броун) в 1827, наблюдая под микроскопом за частицами цветочной пыльцы, взвешенными в воде, обнаружил, что они не стоят на месте, а все время движутся, словно что-то толкает их то в одну, то в другую сторону. Позднее было высказано предположение, что хаотическое движение частиц вызвано непрерывным тепловым движением молекул жидкости, а точные исследования движения, получившего название броуновского, подтвердили правильность этой гипотезы
(см. БРОУНОВСКОЕ ДВИЖЕНИЕ).
Теплоемкость газа или пара. Количество теплоты, необходимое для повышения температуры некоторого количества вещества на 1 градус, называется его теплоемкостью. Из формулы (4) следует, что если температуру газа повысить при постоянном объеме от T до T + 1, то энергия поступательного движения увеличится на (3/2) Nk. Вся тепловая энергия одноатомного газа есть энергия поступательного движения. Следовательно, теплоемкость такого газа при постоянном объеме Cv = (3/2) Nk, а теплоемкость на одну молекулу составляет (3/2) k. Теплоемкость N двухатомных молекул, обладающих еще и энергией вращательного движения kT, равна Cv = (5/2) Nk, а на одну молекулу приходится (5/2) k. В обоих случаях теплоемкость не зависит от температуры, а тепловая энергия дается выражением
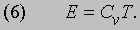
Давление насыщенного пара. Если налить немного воды в большой закрытый сосуд, в котором есть воздух, но отсутствуют водяные пары, то некоторое ее количество немедленно испарится и частички пара начнут распространяться по всему сосуду. Если объем сосуда очень велик по сравнению с объемом воды, то испарение будет идти до тех пор, пока вся вода не превратится в пар. Если же воды налито достаточно много, то испарится не вся она; скорость испарения будет постепенно уменьшаться и в конце концов процесс остановится - произойдет насыщение объема сосуда водяными парами. С позиций молекулярно-кинетической теории это объясняется следующим образом. Время от времени та или иная молекула воды, находящаяся в жидкой среде вблизи поверхности, получает от соседних молекул достаточно энергии, чтобы вырваться в паровоздушную среду. Здесь она сталкивается с другими такими же молекулами и с молекулами воздуха, описывая весьма замысловатую зигзагообразную траекторию. В своем движении она также ударяется о стенки сосуда и о поверхность воды; при этом она может отскочить от воды или поглотиться ею. Пока вода испаряется, число молекул пара, захватываемых ею из паровоздушной среды, остается меньше числа молекул, покидающих воду. Но наступает момент, когда эти величины уравниваются - устанавливается равновесие, и давление пара достигает насыщения. В таком состоянии число молекул в единице объема пара над жидкостью остается постоянным (конечно, если постоянна температура). Такая же картина наблюдается и для твердых тел, но для большинства тел давление пара становится ощутимым только при высоких температурах.
КОЛЕБАНИЯ АТОМОВ В ТВЕРДЫХ ТЕЛАХ И ЖИДКОСТЯХ
Рассматривая под микроскопом хорошо сохранившуюся древнегреческую или древнеримскую гемму, можно увидеть, что ее детали остались такими же четкими, какими они, по-видимому, были, когда гемма только что вышла из рук изготовившего ее мастера. Ясно, что за огромное время лишь очень немногие атомы смогли "вырваться" с поверхности камня, из которого сделана гемма, - в противном случае ее детали со временем потеряли бы четкость. Большинство атомов твердого тела могут совершать только колебательные движения относительно некоторого фиксированного положения, и с повышением температуры лишь увеличиваются средняя частота этих колебаний и их амплитуда. Когда вещество начинает плавиться, поведение его молекул становится похожим на поведение молекул жидкости. Если в твердом теле каждая частица колеблется в небольшом объеме, занимающем в пространстве фиксированное положение, то в жидкости и сам этот объем медленно и беспорядочно перемещается, а вместе с ним перемещается и колеблющаяся частица.
ТЕПЛОПРОВОДНОСТЬ ГАЗА
В любом неравномерно нагретом теле теплота передается от более теплых его частей к более холодным. Это явление называется теплопроводностью. Используя молекулярно-кинетическую теорию, можно найти скорость, с которой газ проводит тепло. Рассмотрим газ, заключенный в прямоугольный сосуд, верхняя поверхность которого имеет более высокую температуру, чем нижняя. Температура газа в сосуде постепенно понижается при переходе от верхних слоев к нижним - в газе существует температурный градиент. Рассмотрим тонкий горизонтальный слой газа АВ, имеющий температуру Т (рис. 3), и соседний слой CD с несколько более высокой температурой, T ў. Пусть расстояние между АВ и CD равно средней длине свободного пробега L. Согласно формуле (4), средняя энергия молекулы в слое АВ пропорциональна температуре Т, а в слое CD - температуре T'. Рассмотрим молекулу из слоя АВ, которая сталкивается с другой молекулой в точке А, после чего движется без столкновений до точки С; с большой вероятностью она попадет в слой CD с энергией, соответствующей слою АВ. И наоборот, молекула из слоя CD, движущаяся без столкновений из точки D в точку В, с большой вероятностью попадет в слой АВ с большей энергией, соответствующей слою CD, откуда она вылетела. Ясно, что при таких столкновениях от CD к АВ передается больше энергии, чем от АВ к CD, - от более теплого слоя к более холодному идет непрерывный поток тепла. Такая же картина наблюдается для всех слоев в газе.
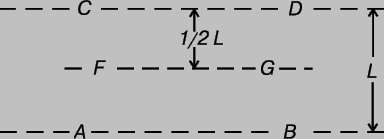
Рис. 3. АНАЛИЗ ПОВЕДЕНИЯ МОЛЕКУЛ в соседних слоях жидкости или газа при наличии градиента температуры или скорости.
Скорость распространения тепла можно вычислить с достаточно хорошей точностью, даже если пренебречь тем, что длина свободного пробега одних молекул больше, а других - меньше средней. Рассмотрим плоскость FG, параллельную плоскостям АВ и CD и проходящую посредине между ними (рис. 3), и выделим единичную площадку этой плоскости. Если в единице объема имеется n молекул, движущихся со средней скоростью с, то за 1 с (1/2) nc молекул пересекут FG снизу вверх и перенесут энергию (1/2) ncE ; такое же число молекул пересечет FG сверху вниз и перенесет энергию (1/2) ncEў, где E и Еў - средние энергии молекул при температурах Т и Т'. Таким образом, если бы оба потока молекул двигались перпендикулярно плоскости FG, то разность перенесенных энергий была бы равна (1/2) nc (Е' - Е). Но молекулы пересекают FG под всевозможными углами, и, чтобы учесть это, указанную величину следует умножить на 2/3. Используя соотношение (6), получим
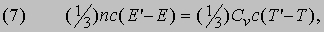
где Cv - теплоемкость n молекул, содержащихся в единице объема. При переходе от CD к АВ, находящихся друг от друга на расстоянии L, температура понижается на (Т' - Т) и если dT/dz - градиент температуры в направлении, перпендикулярном плоскости FG, то
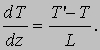
Подставляя разность температур, выраженную через градиент, в формулу (7), получаем, что полная энергия, переносимая через единичную площадку за 1 с, равна
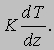
Величина K, описываемая выражением K = (1/3)CvcL,
называется коэффициентом теплопроводности газа.
ВЯЗКОСТЬ ГАЗА
Если измерять скорость течения реки на разной глубине, то можно обнаружить, что у дна вода почти неподвижна, а чем ближе к поверхности, тем быстрее она движется. Таким образом, в речном потоке имеется градиент скорости, аналогичный рассмотренному выше градиенту температуры; при этом благодаря вязкости каждый выше расположенный слой увлекает за собой соседний, лежащий под ним. Такая картина наблюдается не только в жидкостях, но и в газах. Используя молекулярно-кинетическую теорию, попытаемся определить вязкость газа. Предположим, что газ течет слева направо и что в горизонтальном слое CD на рис. 3 скорость течения больше, чем в слое АВ, расположенном непосредственно под CD. Пусть, как и прежде, расстояние между плоскостями равно средней длине свободного пробега. Молекулы газа быстро движутся по всему объему по хаотическим траекториям, но на это хаотическое движение накладывается направленное движение газа. Пусть u - скорость потока газа в слое АВ (в направлении от А к В), а u' - несколько большая скорость в слое CD (в направлении от C к D). Помимо импульса, обусловленного хаотическим движением, молекула в слое АВ обладает импульсом mu, а в слое CD - импульсом muў. Молекулы, переходящие без столкновений из АВ в CD, переносят в слой CD импульс mu, соответствующий слою АВ, тогда как частицы, попадающие из CD в АВ, смешиваются с молекулами из АВ и приносят с собой импульс mu'. Следовательно, из CD в АВ через единичную площадку плоскости FG за 1 с постоянно переносится импульс, равный
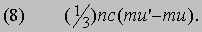
Поскольку скорость изменения импульса равна силе, мы получили выражение силы, приходящейся на единицу площади, с которой один слой действует на другой: более медленный слой тормозит более быстрый, а тот, напротив, увлекая за собой более медленный слой, ускоряет его. Аналогичные силы действуют между соседними слоями во всем объеме текущего газа. Если du/dz -градиент скорости в газе в направлении, перпендикулярном FG, то
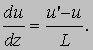
Величина nm в формуле (8) есть масса газа в единице объема; если обозначить эту величину через r, то сила, приходящаяся на единицу площади, будет равна
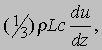
где коэффициент (1/3)rLc - вязкость газа. Из последних двух разделов статьи следуют два вывода. Первый состоит в том, что отношение вязкости к теплопроводности равно r/Cv. Второй вытекает из приведенного ранее выражения для L и состоит в том, что вязкость газа зависит только от его температуры и не зависит от давления и плотности. Правильность обоих выводов с высокой точностью подтверждена экспериментально.
См. также
ЛИТЕРАТУРА
Гиршфельд Дж., Кертисс Ч., Берд Р. Молекулярная теория газов и жидкостей. М., 1961 Френкель Я.И. Кинетическая теория жидкостей. Л., 1975 Кикоин А.К., Кикоин И.К. Молекулярная физика. М., 1976
Полезные сервисы
молекулярно-массовое распределение
Энциклопедический словарь
Молекуля́рно-ма́ссовое распределе́ние - соотношение количеств молекул различной длины (массы) в данном образце полимера. Одна из важнейших характеристик синтетических полимеров, определяющая многие их свойства, в частности механическую прочность.
* * *
МОЛЕКУЛЯРНО-МАССОВОЕ РАСПРЕДЕЛЕНИЕ - МОЛЕКУЛЯ́РНО-МА́ССОВОЕ РАСПРЕДЕЛЕ́НИЕ, соотношение количеств молекул различной длины (массы) в данном образце полимера. Одна из важнейших характеристик синтетических полимеров, определяющая многие их свойства, в частности механическую прочность.
Большой энциклопедический словарь
МОЛЕКУЛЯРНО-МАССОВОЕ РАСПРЕДЕЛЕНИЕ - соотношение количеств молекул различной длины (массы) в данном образце полимера. Одна из важнейших характеристик синтетических полимеров, определяющая многие их свойства, в частности механическую прочность.
Полезные сервисы
молекулярное течение
Энциклопедический словарь
Молекуля́рное тече́ние - течение разреженного газа, при котором свойства потока существенно зависят от беспорядочного движения его частиц (молекул, атомов, ионов и электронов), в отличие от течений, где газ рассматривается как сплошная среда. Имеет место при полёте тел в верхних слоях атмосферы, в вакуумных системах и т. п.
* * *
МОЛЕКУЛЯРНОЕ ТЕЧЕНИЕ - МОЛЕКУЛЯ́РНОЕ ТЕЧЕ́НИЕ, течение разреженного газа, при котором свойства потока существенно зависят от беспорядочного движения его частиц (молекул, атомов, ионов и электронов), в отличие от течений, где газ рассматривается как сплошная среда. Имеет место при полете тел в верхних слоях атмосферы, в вакуумных системах и т. п.
Большой энциклопедический словарь
МОЛЕКУЛЯРНОЕ ТЕЧЕНИЕ - течение разреженного газа, при котором свойства потока существенно зависят от беспорядочного движения его частиц (молекул, атомов, ионов и электронов), в отличие от течений, где газ рассматривается как сплошная среда. Имеет место при полете тел в верхних слоях атмосферы, в вакуумных системах и т. п.
Полезные сервисы
молекулярной биологии институт
Энциклопедический словарь
Молекуля́рной биоло́гии институ́т (ИМБ) им. В. А. Энгельгардта РАН, организован в Москве в 1957. Современное название с 1965. Исследование структур и функций генетического аппарата высших организмов на молекулярном уровне, химических и физических основ действия ферментов и др.
Большой энциклопедический словарь
МОЛЕКУЛЯРНОЙ БИОЛОГИИ ИНСТИТУТ (ИМБ) им. В. А. Энгельгардта РАН - организован в Москве в 1957. Современное название с 1965. Исследования структур и функций генетического аппарата высших организмов на молекулярном уровне, химических и физических основ действия ферментов и др.
Полезные сервисы
молекулярной биологии институт (имб) ран
Энциклопедический словарь
МОЛЕКУЛЯРНОЙ БИОЛОГИИ ИНСТИТУТ (ИМБ) РАН - МОЛЕКУЛЯ́РНОЙ БИОЛО́ГИИ ИНСТИТУ́Т (ИМБ) им. В. А. Энгельгардта РАН, организован в Москве в 1957. Современное название с 1965. Исследования структур и функций генетического аппарата высших организмов на молекулярном уровне, химических и физических основ действия ферментов и др.
Полезные сервисы
молекулярные
молекулярные болезни
Энциклопедический словарь
МОЛЕКУЛЯРНЫЕ БОЛЕЗНИ - «МОЛЕКУЛЯ́РНЫЕ БОЛЕ́ЗНИ», наследственные заболевания, обусловленные биохимическими нарушениями (расстройства белкового, углеводного или др. видов обмена веществ).
-----------------------------------
«молекуля́рные боле́зни» - наследственные заболевания, обусловленные биохимическими нарушениями (расстройства белкового, углеводного или других видов обмена веществ).
Большой энциклопедический словарь
"МОЛЕКУЛЯРНЫЕ БОЛЕЗНИ" - наследственные заболевания, обусловленные биохимическими нарушениями (расстройства белкового, углеводного или др. видов обмена веществ).
Полезные сервисы
молекулярные и атомные пучки
Энциклопедический словарь
Молекуля́рные и а́томные пучки́ - направленные потоки молекул или атомов, движущихся в вакууме без столкновений друг с другом и с молекулами остаточных газов. Используются в радиоспектроскопии, квантовой электронике, ускорительной технике.
* * *
МОЛЕКУЛЯРНЫЕ И АТОМНЫЕ ПУЧКИ - МОЛЕКУЛЯ́РНЫЕ И А́ТОМНЫЕ ПУЧКИ́, направленные потоки молекул или атомов, движущихся в вакууме без столкновений друг с другом и с молекулами остаточных газов. Используются в радиоспектроскопии, квантовой электронике, ускорительной технике.
Большой энциклопедический словарь
МОЛЕКУЛЯРНЫЕ И АТОМНЫЕ ПУЧКИ - направленные потоки молекул или атомов, движущихся в вакууме без столкновений друг с другом и с молекулами остаточных газов. Используются в радиоспектроскопии, квантовой электронике, ускорительной технике.
Полезные сервисы
молекулярные кристаллы
Энциклопедический словарь
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ - МОЛЕКУЛЯ́РНЫЕ КРИСТА́ЛЛЫ,. кристаллы, в узлах кристаллической решетки которых располагаются молекулы вещества, связанные друӠс другом слабыми или ван-дер-ваальсовыми силами (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ) или водородной связью (см. ВОДОРОДНАЯ СВЯЗЬ). Внутри молекул между атомами действует более прочная, обычно ковалентная связь. Силы взаимодействия между молекулами обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. Эти силы называют ван-дер-ваальсовыми, так как они имеют ту же природу, что и силы притяжения между молекулами, приводящими к отклонению газов от идеальности
Молекулярные кристаллы - рыхлые структуры с малыми координационными числами (см. КООРДИНАЦИОННОЕ ЧИСЛО), низкой температурой плавления и испарения, большой сжимаемостью. Фазовые превращения молекулярных кристаллов - плавление, возгонка, полиморфные переходы - происходят, как правило, без разрушения отдельных молекул. Большинство молекулярных кристаллов - диэлектрики (см. ДИЭЛЕКТРИКИ), обычно прозрачные для электромагнитных волн. К молекулярным кристаллам относятся благородные газы в твердом состоянии, кристаллы из насыщенных молекул, кристаллы многих полимеров, в том числе кристаллы белков и нуклеиновых кислот(биологические кристаллы).
Полезные сервисы
молекулярные сита
Энциклопедический словарь
Молекуля́рные си́та - микропористые тела, избирательно поглощающие из окружающей среды вещества, размеры молекул которых меньше размеров микропор. К ним относятся природные и синтетические цеолиты. Молекулярные сита позволяют производить адсорбционное разделение смесей веществ в газообразной и жидкой фазах.
* * *
МОЛЕКУЛЯРНЫЕ СИТА - МОЛЕКУЛЯ́РНЫЕ СИ́ТА, микропористые тела, избирательно поглощающие из окружающей среды вещества, размеры молекул которых меньше размеров микропор. К ним относятся природные и синтетические цеолиты. Молекулярные сита позволяют производить адсорбционное разделение смесей веществ в газообразной и жидкой фазах.
Большой энциклопедический словарь
МОЛЕКУЛЯРНЫЕ сита - микропористые тела, избирательно поглощающие из окружающей среды вещества, размеры молекул которых меньше размеров микропор. К ним относятся природные и синтетические цеолиты. Молекулярные сита позволяют производить адсорбционное разделение смесей веществ в газообразной и жидкой фазах.
Полезные сервисы
молекулярные спектры
Энциклопедический словарь
Молекуля́рные спе́ктры - оптические спектры испускания, поглощения и рассеяния света, принадлежащие свободным или слабо связанным молекулам. Состоят из спектральных полос и линий, структура и расположение которых типичны для испускающих их молекул. Возникают при квантовых переходах между электронными, колебательными и вращательными уровнями энергии молекул. Соответственно различают электронные, колебательные и вращательные молекулярные спектры. Усложняются с увеличением числа атомов в молекуле. По молекулярным спектрам изучают структуру, состояния, свойства молекул, а также осуществляют молекулярный спектральный анализ вещества.
* * *
МОЛЕКУЛЯРНЫЕ СПЕКТРЫ - МОЛЕКУЛЯ́РНЫЕ СПЕ́КТРЫ, оптические спектры испускания, поглощения и рассеяния света, принадлежащие свободным или слабо связанным молекулам. Состоят из спектральных полос и линий, структура и расположение которых типичны для испускающих их молекул. Возникают при квантовых переходах между электронными, колебательными и вращательными уровнями энергии молекул. Соответственно различают электронные, колебательные и вращательные молекулярные спектры. Усложняются с увеличением числа атомов в молекуле. По молекулярным спектрам изучают структуру, состояния, свойства молекул, а также осуществляют молекулярный спектральный анализ вещества.
Большой энциклопедический словарь
МОЛЕКУЛЯРНЫЕ СПЕКТРЫ - оптические спектры испускания, поглощения и рассеяния света, принадлежащие свободным или слабо связанным молекулам. Состоят из спектральных полос и линий, структура и расположение которых типичны для испускающих их молекул. Возникают при квантовых переходах между электронными, колебательными и вращательными уровнями энергии молекул. Соответственно различают электронные, колебательные и вращательные молекулярные спектры. Усложняются с увеличением числа атомов в молекуле. По молекулярным спектрам изучают структуру, состояния, свойства молекул, а также осуществляют молекулярный спектральный анализ вещества.
Полезные сервисы
молекулярный
Толковый словарь
прил.
1. соотн. с сущ. молекула, связанный с ним
2. Свойственный молекуле, характерный для неё.
3. Принадлежащий молекуле.
Толковый словарь Ушакова
МОЛЕКУЛЯ́РНЫЙ, молекулярная, молекулярное (ест.). прил. к молекула. Молекулярный вес (сумма весов атомов, входящих в состав молекулы).
Толковый словарь Ожегова
МОЛЕ́КУЛА, -ы, ж. Мельчайшая частица вещества, обладающая всеми его химическими свойствами. М. состоит из атомов.
Академический словарь
Орфографический словарь
Словарь ударений
Формы слов для слова молекулярный
молекуля́рный, молекуля́рная, молекуля́рное, молекуля́рные, молекуля́рного, молекуля́рной, молекуля́рных, молекуля́рному, молекуля́рным, молекуля́рную, молекуля́рною, молекуля́рными, молекуля́рном, молекуля́рен, молекуля́рна, молекуля́рно, молекуля́рны, молекуля́рнее, помолекуля́рнее, молекуля́рней, помолекуля́рней
Синонимы к слову молекулярный
Морфемно-орфографический словарь
Грамматический словарь
Новый словарь иностранных слов
молекуля́рный
- прил. от сл. молекула;
м-ая масса (относительная) - отношение массы молекулы данного вещества к via части массы атома изотопа углерода 12с;
м-ая физика - раздел физики, изучающий свойства тел в зависимости от их молекулярного строения, взаимодействия между молекулами (атомами, ионами) и теплового движения молекул;
м. генератор - прибор для генерирования электромагнитных колебаний сверхвысокой частоты за счет вынужденного излучения возбужденных молекул (см. мазер);
м-ые и атомные пучки - направленные потоки молекул или атомов, в которых последние движутся в вакууме практически без столкновений друг с другом и с частицами среды; примен. в радиоспектроскопии и квантовой электронике;
м-ая биология - отрасль биологии, ставящая своей задачей познание природы явлений жизнедеятельности путем изучения биологических объектов и систем на уровне, приближающемся к молекулярному;
м-ая генетика - раздел современной генетики, познающий материальные основы наследственности и изменчивости путем исследования на уровне, близком к молекулярному, процессов реализации и передачи изменения и хранения генетической информации.
Словарь галлицизмов русского языка
МОЛЕКУЛЯРНЫЙ ая, ое.moléculaire, нем. molekular. Отн. к молекуле, молекулам, свойственый им. Молекуряная теплота. Молекулярный вес. БАС-1. - Лекс. Толль Прил. 1866: молекулярные действия; Даль-3: меолекуля/рный вес; Уш. 1938: меолекуля/рный.
Полезные сервисы
молекулярный вес
Энциклопедический словарь
Молекуля́рный вес - то же, что молекулярная масса.
* * *
МОЛЕКУЛЯРНЫЙ ВЕС - МОЛЕКУЛЯ́РНЫЙ ВЕС, см. Молекулярная масса (см. МОЛЕКУЛЯРНАЯ МАССА).
Большой энциклопедический словарь
Полезные сервисы
молекулярный генератор
Энциклопедический словарь
Молекуля́рный генера́тор - квантовый генератор, в котором активной средой является молекулярный газ. Применяется главным образом в устройствах радиоспектроскопии в диапазоне сантиметровых и миллиметровых волн.
* * *
МОЛЕКУЛЯРНЫЙ ГЕНЕРАТОР - МОЛЕКУЛЯ́РНЫЙ ГЕНЕРА́ТОР, первый квантовый генератор; активная среда в нем - пучок молекул аммиака. Использовался как активный квантовый стандарт частоты; применяется как радиоспектроскоп высокого разрешения при исследованиях молекул HN3, атомов N и Н и их ядер.
Большой энциклопедический словарь
МОЛЕКУЛЯРНЫЙ генератор - первый квантовый генератор; активная среда в нем - пучок молекул аммиака. Использовался как активный квантовый стандарт частоты; применяется как радиоспектроскоп высокого разрешения при исследованиях молекул HN3, атомов N и Н и их ядер.
Полезные сервисы
молекулярный насос
Энциклопедический словарь
Молекуля́рный насо́с - вакуумный насос, действие которого основано на сообщении молекулам откачиваемого газа дополнительной скорости при соударении их с быстровращающимся (частота вращения до 90 тыс. об/мин) ротором. Различают молекулярные насосы цилиндрические, дисковые, конические и др. Остаточное давление от 10 до 10-9 Па.
* * *
МОЛЕКУЛЯРНЫЙ НАСОС - МОЛЕКУЛЯ́РНЫЙ НАСО́С, вакуумный насос, действие которого основано на сообщении молекулам откачиваемого газа дополнительной скорости при соударении их с быстро вращающимся (частота вращения до 90 тыс. об/мин) ротором. Различают молекулярные насосы цилиндрические, дисковые, конические и др. Остаточное давление от 10 до 10-9 Па.
Большой энциклопедический словарь
МОЛЕКУЛЯРНЫЙ НАСОС - вакуумный насос, действие которого основано на сообщении молекулам откачиваемого газа дополнительной скорости при соударении их с быстро вращающимся (частота вращения до 90 тыс. об/мин) ротором. Различают молекулярные насосы цилиндрические, дисковые, конические и др. Остаточное давление от 10 до 10-9 Па.
Полезные сервисы
молекулярных орбиталей метод
Энциклопедический словарь
Молекуля́рных орбита́лей ме́тод - квантовохимический расчётный метод, основанный на представлении о том, что каждый электрон молекулы описывается своей волновой функцией (молекулярной орбиталью, МО). На практике каждую МО часто представляют как линейную комбинацию атомных орбиталей (приближение ЛКАО). Волновая функция молекулы, построенная из МО тем или иным способом, далее уточняется, например, вариационным методом. Такой подход позволяет приближённо определить энергетические состояния молекулы, объяснить многие её свойства и структуру.
* * *
МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ МЕТОД - МОЛЕКУЛЯ́РНЫХ ОРБИТА́ЛЕЙ МЕ́ТОД, квантовохимический расчетный метод, основанный на представлении о том, что каждый электрон молекулы описывается своей волновой функцией (молекулярной орбиталью, МО). На практике каждую молекулярную орбиталь часто представляют как линейную комбинацию атомных орбиталей (приближение ЛКАО). Волновая функция молекулы, построенная из молекулярной орбитали тем или иным способом, далее уточняется, напр. вариационным методом. Такой подход позволяет приближенно определить энергетические состояния молекулы, объяснить многие ее свойства и структуру.
Большой энциклопедический словарь
МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ метод - квантовохимический расчетный метод, основанный на представлении о том, что каждый электрон молекулы описывается своей волновой функцией (молекулярной орбиталью, МО). На практике каждую молекулярную орбиталь часто представляют как линейную комбинацию атомных орбиталей (приближение ЛКАО). Волновая функция молекулы, построенная из молекулярной орбитали тем или иным способом, далее уточняется, напр. вариационным методом. Такой подход позволяет приближенно определить энергетические состояния молекулы, объяснить многие ее свойства и структуру.