м.
Химический элемент, лёгкий горючий газ без цвета, запаха и вкуса, в соединении с кислородом образующий воду.
м.
Химический элемент, лёгкий горючий газ без цвета, запаха и вкуса, в соединении с кислородом образующий воду.
ВОДОРО́Д, водорода, мн. нет, муж. (хим.). Самый легкий бесцветный газ, образующий в соединении с кислородом воду и не поддерживающий горения. Аэростат наполнен водородом.
ВОДОРО́Д, -а, муж. Химический элемент, самый лёгкий газ, в соединении с кислородом образующий воду.
| прил. водородный, -ая, -ое. Водородная бомба.
ВОДОРО́Д, -а, м
Химический элемент, самый легкий газ без цвета и запаха, в соединении с кислородом образующий воду.
Водород - самый распространенный элемент космоса, составляет (в виде плазмы) более 70 % массы Солнца и звезд, основная часть газов межзвездной среды и туманностей; на Земле входит в состав воды, живых организмов, каменного угля, нефти.
ВОДОРО́Д -а; м. Химический элемент (H), лёгкий газ без цвета и запаха, образующий в соединении с кислородом воду.
◁ Водоро́дный, -ая, -ое. В-ые соединения. В-ые бактерии. В-ая бомба (бомба огромной разрушительной силы, взрывное действие которой основано на термоядерной реакции). Водоро́дистый, -ая, -ое.
* * *
водоро́д (лат. Hydrogenium), химический элемент VII группы периодической системы. В природе встречаются два стабильных изотопа (протий и дейтерий) и один радиоактивный (тритий). Молекула двухатомна (Н2). Газ без цвета и запаха; плотность 0,0899 г/л, tкип - 252,76°C. Соединяется с многими элементами, с кислородом образует воду. Самый распространённый элемент космоса; составляет (в виде плазмы) более 70% массы Солнца и звёзд, основная часть газов межзвёздной среды и туманностей. Атом водорода входит в состав многих кислот и оснований, большинства органических соединений. Применяют в производстве аммиака, соляной кислоты, для гидрогенизации жиров и др., при сварке и резке металлов. Перспективен как горючее (см. Водородная энергетика).
* * *
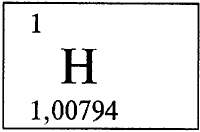
ВОДОРОД - ВОДОРО́Д (лат. Hydrogenium), H, химический элемент с атомным номером 1, атомная масса 1,00794. Химический символ водорода Н читается в нашей стране «аш», как произносится эта буква по-французски.
Природный водород состоит из смеси двух стабильных нуклидов (см. НУКЛИД)с массовыми числами 1,007825 (99,985 % в смеси) и 2,0140 (0,015 %). Кроме того, в природном водороде всегда присутствуют ничтожные количества радиоактивного нуклида - трития (см. ТРИТИЙ) 3Н (период полураспада Т1/212,43 года). Так как в ядре атома водорода содержится только 1 протон (меньше в ядре атома элемента протонов быть не может), то иногда говорят, что водород образует естественную нижнюю границу периодической системы элементов Д. И. Менделеева (хотя сам элемент водород расположен в самой верхней части таблицы). Элемент водород расположен в первом периоде таблицы Менделеева. Его относят и к 1-й группе (группе IА щелочных металлов (см. ЩЕЛОЧНЫЕ МЕТАЛЛЫ)), и к 7-й группе (группе VIIA галогенов (см. ГАЛОГЕНЫ)).
Массы атомов у изотопов водорода различаются между собой очень сильно (в разы). Это приводит к заметным различиям в их поведении в физических процессах (дистилляция, электролиз и др.) и к определенным химическим различиям (различия в поведении изотопов одного элемента называют изотопными эффектами, для водорода изотопные эффекты наиболее существенны). Поэтому в отличие от изотопов всех остальных элементов изотопы водорода имеют специальные символы и названия. Водород с массовым числом 1 называют легким водородом, или протием (лат. Protium, от греческого protos - первый), обозначают символом Н, а его ядро называют протоном (см. ПРОТОН (элементарная частица)), символ р. Водород с массовым числом 2 называют тяжелым водородом, дейтерием (см. ДЕЙТЕРИЙ)(лат Deuterium, от греческого deuteros - второй), для его обозначения используют символs 2Н, или D (читается «де»), ядро d - дейтрон. Радиоактивный изотоп с массовым числом 3 называют сверхтяжелым водородом, или тритием (лат. Tritum, от греческого tritos - третий), символ 2Н или Т (читается «те»), ядро t - тритон.
Конфигурация единственного электронного слоя нейтрального невозбужденного атома водорода 1s1. В соединениях проявляет степени окисления +1 и, реже, -1 (валентность I). Радиус нейтрального атома водорода 0,024 нм. Энергия ионизации атома 13,595 эВ, сродство к электрону 0,75 эВ. По шкале Полинга электроотрицательность водорода 2,20. Водород принадлежит к числу неметаллов.
В свободном виде - легкий горючий газ без цвета, запаха и вкуса.
История открытия
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в 16 и 17 веках на заре становления химии как науки. Знаменитый английский физик и химик Г. Кавендиш (см. КАВЕНДИШ Генри)в 1766 исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона (см. ФЛОГИСТОН)помешала ему сделать правильные выводы. Французский химик А. Лавуазье (см. ЛАВУАЗЬЕ Антуан Лоран)совместно с инженером Ж. Менье (см. МЕНЬЕ Жан Батист Мари Шарль), используя специальные газометры, в 1783 осуществил синтез воды, а затем и ее анализ, разложив водяной пар раскаленным железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из нее получен. В 1787 Лавуазье пришел к выводу, что «горючий воздух» представляет собой простое вещество, и, следовательно, относится к числу химических элементов. Он дал ему название hydrogene (от греческого hydor - вода и gennao - рождаю) - «рождающий воду». Установление состава воды положило конец «теории флогистона». Русское наименование «водород» предложил химик М. Ф. Соловьев (см. СОЛОВЬЕВ Михаил Федорович) в 1824. На рубеже 18 и 19 веков было установлено, что атом водорода очень легкий (по сравнению с атомами других элементов), и вес (масса) атома водорода был принят за единицу сравнения атомных масс элементов. Массе атома водорода приписали значение, равное 1.
Нахождение в природе
На долю водорода приходится около 1% массы земной коры (10-е место среди всех элементов). В свободном виде водород на нашей планете практически не встречается (его следы имеются в верхних слоях атмосферы), но в составе воды распространен на Земле почти повсеместно. Элемент водород входит в состав органических и неорганических соединений живых организмов, природного газа, нефти, каменного угля. Он содержится, разумеется, в составе воды (около 11% по массе), в различных природных кристаллогидратах и минералах, в составе которых имеется одна или несколько гидроксогрупп ОН.
Водород как элемент доминирует во Вселенной. На его долю приходится около половины массы Солнца и других звезд, он присутствует в атмосфере ряда планет.
Получение
Водород можно получить многими способами. В промышленности для этого используют природные газы, а также газы, получаемые при переработке нефти, коксовании и газификации угля и других топлив. При производстве водорода из природного газа (основной компонент - метан) проводят его каталитическое взаимодействие с водяным паром и неполное окисление кислородом:
CH4 + H2O = CO + 3H2 и CH4 + 1/2 O2 = CO2 + 2H2
Выделение водорода из коксового газа и газов нефтепереработки основано на их сжижении при глубоком охлаждении и удалении из смеси газов, сжижаемых легче, чем водород. При наличии дешевой электроэнергии водород получают электролизом воды, пропуская ток через растворы щелочей. В лабораторных условиях водород легко получить взаимодействием металлов с кислотами, например, цинка с соляной кислотой.
Физические и химические свойства
При обычных условиях водород - легкий (плотность при нормальных условиях 0,0899 кг/м3) бесцветный газ. Температура плавления -259,15 °C, температура кипения -252,7 °C. Жидкий водород (при температуре кипения) обладает плотностью 70,8 кг/м3 и является самой легкой жидкостью. Стандартный электродный потенциал Н2/Н- в водном растворе принимают равным 0. Водород плохо растворим в воде: при 0 °C растворимость составляет менее 0,02 см3/мл, но хорошо растворим в некоторых металлах (губчатое железо и других), особенно хорошо - в металлическом палладии (около 850 объемов водорода в 1 объеме металла). Теплота сгорания водорода равна 143,06 МДж/кг.
Существует в виде двухатомных молекул Н2. Константа диссоциации Н2 на атомы при 300 К 2,56·10-34. Энергия диссоциации молекулы Н2 на атомы 436 кДж/моль. Межъядерное расстояние в молекуле Н2 0,07414 нм.
Так как ядро каждого атома Н, входящего в состав молекулы, имеет свой спин (см. СПИН) , то молекулярный водород может находиться в двух формах: в форме ортоводорода (о-Н2) (оба спина имеют одинаковую ориентацию) и в форме параводорода (п-Н2) (спины имеют разную ориентацию). При обычных условиях нормальный водород представляет собой смесь 75% о-Н2 и 25% п-Н2. Физические свойства п- и о-Н2 немного различаются между собой. Так, если температура кипения чистого о-Н2 20,45 К, то чистого п-Н2 - 20,26 К. Превращение о-Н2 в п-Н2 сопровождается выделением 1418 Дж/моль теплоты.
В научной литературе неоднократно высказывались соображения о том, что при высоких давлениях (выше 10 ГПа) и при низких температурах (около 10 К и ниже) твердый водород, обычно кристаллизующийся в гексагональной решетке молекулярного типа, может переходить в вещество с металлическими свойствами, возможно, даже сверхпроводник. Однако пока однозначных данных о возможности такого перехода нет.
Высокая прочность химической связи между атомами в молекуле Н2 (что, например, используя метод молекулярных орбиталей, можно объяснить тем, что в этой молекуле электронная пара находится на связывающей орбитали, а разрыхляющая орбиталь электронами не заселена) приводит к тому, что при комнатной температуре газообразный водород химически малоактивен. Так, без нагревания, при простом смешивании водород реагирует (со взрывом) только с газообразным фтором:
H2 + F2 = 2HF + Q.
Если смесь водорода и хлора при комнатной температуре облучить ультрафиолетовым светом, то наблюдается немедленное образование хлороводорода НСl. Реакция водорода с кислородом происходит со взрывом, если в смесь этих газов внести катализатор - металлический палладий (или платину). При поджигании смесь водорода и кислорода (так называемый гремучий газ (см. ГРЕМУЧИЙ ГАЗ)) взрывается, при этом взрыв может произойти в смесях, в которых содержание водорода составляет от 5 до 95 объемных процентов. Чистый водород на воздухе или в чистом кислороде спокойно горит с выделением большого количества теплоты:
H2 + 1/2O2 = Н2О + 285,75 кДж/моль
С остальными неметаллами и металлами водород если и взаимодействует, то только при определенных условиях (нагревание, повышенное давление, присутствие катализатора). Так, с азотом водород обратимо реагирует при повышенном давлении (20-30 МПа и больше) и при температуре 300-400 °C в присутствии катализатора - железа:
3H2 + N2 = 2NH3 + Q.
Также только при нагревании водород реагирует с серой с образованием сероводорода H2S, с бромом - с образованием бромоводорода НBr, с иодом - с образованием иодоводорода НI. С углем (графитом) водород реагирует с образованием смеси углеводородов различного состава. С бором, кремнием, фосфором водород непосредственно не взаимодействует, соединения этих элементов с водородом получают косвенными путями.
При нагревании водород способен вступать в реакции с щелочными, щелочноземельными металлами и магнием с образованием соединений с ионным характером связи, в составе которых содержится водород в степени окисления -1. Так, при нагревании кальция в атмосфере водорода образуется солеобразный гидрид состава СаН2. Полимерный гидрид алюминия (AlH3)x - один из самых сильных восстановителей - получают косвенными путями (например, с помощью алюминийорганических соединений). Со многими переходными металлами (например, цирконием, гафнием и др.) водород образует соединения переменного состава (твердые растворы).
Водород способен реагировать не только со многими простыми, но и со сложными веществами. Прежде всего надо отметить способность водорода восстанавливать многие металлы из их оксидов (такие, как железо, никель, свинец, вольфрам, медь и др.). Так, при нагревании до температуры 400-450 °C и выше происходит восстановление железа водородом из его любого оксида, например:
Fe2O3 + 3H2 = 2Fe + 3H2O.
Следует отметить, что восстановить водородом из оксидов можно только металлы, расположенные в ряду стандартных потенциалов за марганцем. Более активные металлы (в том числе и марганец) до металла из оксидов не восстанавливаются.
Водород способен присоединяться по двойной или тройной связи ко многим органическим соединениям (это - так называемые реакции гидрирования). Например, в присутствии никелевого катализатора можно осуществить гидрирование этилена С2Н4, причем образуется этан С2Н6:
С2Н4 + Н2 = С2Н6.
Взаимодействием оксида углерода(II) и водорода в промышленности получают метанол:
2Н2 + СО = СН3ОН.
В соединениях, в которых атом водорода соединен с атомом более электроотрицательного элемента Э (Э = F, Cl, O, N), между молекулами образуются водородные связи (см. ВОДОРОДНАЯ СВЯЗЬ) (два атома Э одного и того же или двух разных элементов связаны между собой через атом Н: Э"... Н... Э"", причем все три атома расположены на одной прямой). Такие связи существуют между молекулами воды, аммиака, метанола и др. и приводят к заметному возрастанию температур кипения этих веществ, увеличению теплоты испарения и т. д.
Применение
Водород используют при синтезе аммиака NH3, хлороводорода HCl, метанола СН3ОН, при гидрокрекинге (крекинге в атмосфере водорода) природных углеводородов, как восстановитель при получении некоторых металлов. Гидрированием (см. ГИДРИРОВАНИЕ) природных растительных масел получают твердый жир - маргарин. Жидкий водород находит применение как ракетное топливо, а также как хладагент. Смесь кислорода с водородом используют при сварке.
Одно время высказывалось предположение, что в недалеком будущем основным источником получения энергии станет реакция горения водорода, и водородная энергетика вытеснит традиционные источники получения энергии (уголь, нефть и др.). При этом предполагалось, что для получения водорода в больших масштабах можно будет использовать электролиз воды. Электролиз воды - довольно энергоемкий процесс, и в настоящее время получать водород электролизом в промышленных масштабах невыгодно. Но ожидалось, что электролиз будет основан на использовании среднетемпературной (500-600 °C) теплоты, которая в больших количествах возникает при работе атомных электростанций. Эта теплота имеет ограниченное применение, и возможности получения с ее помощью водорода позволили бы решить как проблему экологии (при сгорании водорода на воздухе количество образующихся экологически вредных веществ минимально), так и проблему утилизации среднетемпературной теплоты. Однако после Чернобыльской катастрофы развитие атомной энергетики повсеместно свертывается, так что указанный источник энергии становится недоступным. Поэтому перспективы широкого использования водорода как источника энергии пока сдвигаются по меньшей мере до середины 21-го века.
Особенности обращения
Водород не ядовит, но при обращении с ним нужно постоянно учитывать его высокую пожаро- и взрывоопасность, причем взрывоопасность водорода повышена из-за высокой способности газа к диффузии даже через некоторые твердые материалы. Перед началом любых операций по нагреванию в атмосфере водорода следует убедиться в его чистоте (при поджигании водорода в перевернутой вверх дном пробирке звук должен быть глухой, а не лающий).
Биологическая роль
Биологическое значение водорода определяется тем, что он входит в состав молекул воды и всех важнейших групп природных соединений, в том числе белков, нуклеиновых кислот, липидов, углеводов. Примерно 10 % массы живых организмов приходится на водород. Способность водорода образовывать водородную связь играет решающую роль в поддержании пространственной четвертичной структуры белков, а также в осуществлении принципа комплементарности (см. КОМПЛЕМЕНТАРНОСТЬ)в построении и функциях нуклеиновых кислот (то есть в хранении и реализации генетической информации), вообще в осуществлении «узнавания» на молекулярном уровне. Водород (ион Н+) принимает участие в важнейших динамических процессах и реакциях в организме - в биологическом окислении, обеспечивающим живые клетки энергией, в фотосинтезе у растений, в реакциях биосинтеза, в азотфиксации и бактериальном фотосинтезе, в поддержании кислотно-щелочного равновесия и гомеостаза (см. ГОМЕОСТАЗ), в процессах мембранного транспорта. Таким образом, наряду с кислородом и углеродом водород образует структурную и функциональную основы явлений жизни.
ВОДОРОД (лат. Hydrogenium) - Н, химический элемент VII группы периодической системы, атомный номер 1, атомная масса 1,00794. В природе встречаются два стабильных изотопа (протий и дейтерий) и один радиоактивный (тритий). Молекула двухатомна (Н2). Газ без цвета и запаха; плотность 0,0899 г/л, tкип = 252,76 .С. Соединяется с многими элементами, с кислородом образует воду. Самый распространенный элемент космоса; составляет (в виде плазмы) более 70% массы Солнца и звезд, основная часть газов межзвездной среды и туманностей. На Земле входит в состав воды, живых организмов, каменного угля, нефти. Применяют в производстве аммиака, соляной кислоты, для гидрогенизации жиров и др., при сварке и резке металлов. Входит в состав синтез-газа. Перспективен как горючее (см. Водородная энергетика).
Н (лат. hydrogenium),
самый легкий газообразный химический элемент - член IA подгруппы периодической системы элементов, иногда его относят к VIIA подгруппе. В земной атмосфере водород в несвязанном состоянии существует только доли минуты, его количество составляет 1-2 части на 1 500 000 частей воздуха. Он выделяется обычно с другими газами при извержениях вулканов, из нефтяных скважин и в местах разложения больших количеств органических веществ. Водород соединяется с углеродом и(или) кислородом в органическом веществе типа углеводов, углеводородов, жиров и животных белков. В гидросфере водород входит в состав воды - наиболее распространенного соединения на Земле. В породах, грунтах, почвах и других частях земной коры водород соединяется с кислородом, образуя воду и гидроксид-ион OH-. Водород составляет 16% всех атомов земной коры, но по массе лишь около 1%, так как он в 16 раз легче кислорода. Масса Солнца и звезд на 70% состоит из водородной плазмы: в космосе это самый распространенный элемент. Концентрация водорода в атмосфере Земли возрастает с высотой благодаря его низкой плотности и способности подниматься на большие высоты. Обнаруженные на поверхности Земли метеориты содержат 6-10 атомов водорода на 100 атомов кремния.
Историческая справка. Еще немецкий врач и естествоиспытатель Парацельс в 16 в. установил горючесть водорода. В 1700 Н.Лемери обнаружил, что газ, выделяющийся при действии серной кислоты на железо, взрывается на воздухе. Водород как элемент идентифицировал Г.Кавендиш в 1766 и назвал его "горючим воздухом", а в 1781 он доказал, что вода - это продукт его взаимодействия с кислородом. Латинское hydrogenium, которое происходит от греческого сочетания "рождающий воду", было присвоено этому элементу А.Лавуазье.
Общая характеристика водорода. Водород - это первый элемент в периодической системе элементов; его атом состоит из одного протона и вращающегося вокруг него одного электрона
(см. также ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ).
Один из 5000 атомов водорода отличается наличием в ядре одного нейтрона, увеличивающего массу ядра с 1 до 2. Этот изотоп водорода называют дейтерием 21H или 21D. Другой, более редкий изотоп водорода содержит два нейтрона в ядре и называется тритием 31H или 31T. Тритий радиоактивен и распадается с выделением гелия и электронов. Ядра различных изотопов водорода различаются спинами протонов. Водород может быть получен а) действием активного металла на воду, б) действием кислот на определенные металлы, в) действием оснований на кремний и некоторые амфотерные металлы, г) действием перегретого пара на уголь и метан, а также на железо, д) электролитическим разложением воды и термическим разложением углеводородов. Химическая активность водорода определяется его способностью отдавать электрон другому атому или обобществлять его почти поровну с другим элементами при образовании химической связи либо присоединять электрон другого элемента в химическом соединении, называемом гидридом. Водород, производимый промышленностью, в огромных количествах расходуют на синтез аммиака, азотной кислоты, гидридов металлов. Пищевая промышленность применяет водород для гидрирования (гидрогенизации) жидких растительных масел в твердые жиры (например, маргарин). При гидрировании насыщенные органические масла, содержащие двойные связи между углеродными атомами, превращаются в насыщенные, имеющие одинарные углерод-углеродные связи. Высокочистый (99,9998%) жидкий водород используется в космических ракетах в качестве высокоэффективного горючего.
Физические свойства. Для сжижения и затвердевания водорода требуются очень низкие температуры и высокое давление (см. таблицу свойств). В нормальных условиях водород - бесцветный газ, без запаха и вкуса, очень легкий: 1 л водорода при 0° C и атмосферном давлении имеет массу 0,08987 г (ср. плотность воздуха и гелия 1,2929 и 0,1785 г/л соответственно; поэтому воздушный шар, наполненный гелием и имеющий такую же подъемную силу, как и воздушный шар с водородом, должен иметь на 8% больший объем). В таблице приведены некоторые физические и термодинамические свойства водорода. СВОЙСТВА ОБЫЧНОГО ВОДОРОДА
(при 273,16 К, или 0° С)
Атомный номер 1 Атомная масса 11Н 1,00797 Плотность, г/л
при нормальном давлении 0,08987 при 2,5*10 5 атм 0,66 при 2,7*10 18 атм 1,12*10 7
Ковалентный радиус, 0,74 Температура плавления, ° С -259,14 Температура кипения, ° С -252,5 Критическая температура, ° С -239,92 (33,24 K) Критическое давление, атм 12,8 (12,80 K) Теплоемкость, Дж/(мольЧK) 28,8 (H2) Растворимость
в воде, объем/100 объемов H2O (при стандартных условиях) 2,148 в бензоле, мл/г (35,2° С, 150,2 атм) 11,77 в аммиаке, мл/г (25° С) при 50 атм 4,47 при 1000 атм 79,25
Степени окисления -1, +1
Строение атома. Обычный водородный атом (протий) состоит из двух фундаментальных частиц (протона и электрона) и имеет атомную массу 1. Из-за огромной скорости движения электрона (2,25 км/с или 7*1015 об./с) и его дуалистической корпускулярно-волновой природы невозможно точно установить координату (положение) электрона в любой данный момент времени, но имеются некоторые области высокой вероятности нахождения электрона, и они определяют размеры атома. Большинство химических и физических свойств водорода, особенно относящихся к возбуждению (поглощению энергии), точно предсказываются математически (см. СПЕКТРОСКОПИЯ). Водород сходен со щелочными металлами в том, что все эти элементы способны отдавать электрон атому-акцептору для образования химической связи, которая может изменяться от частично ионной (переход электрона) до ковалентной (общая электронная пара). С сильным акцептором электронов водород образует положительный ион Н+, т.е. протон. На электронной орбите атома водорода могут находиться 2 электрона, поэтому водород способен также принимать электрон, образуя отрицательный ион Н-, гидрид-ион, и это роднит водород с галогенами, для которых характерно принятие электрона с образованием отрицательного галогенид-иона типа Cl-. Дуализм водорода находит отражение в том, что в периодической таблице элементов его располагают в IA подгруппе (щелочные металлы), а иногда - в VIIA подгруппе (галогены) (см. также ХИМИЯ).
Химические свойства. Химические свойства водорода определяются его единственным электроном. Количество энергии, необходимое для отрыва этого электрона, больше, чем может предоставить любой известный химический окислитель. Поэтому химическая связь водорода с другими атомами ближе к ковалентной, чем к ионной. Чисто ковалентная связь возникает при образовании молекулы водорода: H + H H2
При образовании одного моля (т.е. 2 г) H2 выделяется 434 кДж. Даже при 3000 K степень диссоциации водорода очень невелика и равна 9,03%, при 5000 K достигает 94% и лишь при 10000 K диссоциация становится полной. При образовании двух молей (36 г) воды из атомарного водорода и кислорода (4H + O2 -> 2H2O) выделяется более 1250 кДж и температура достигает 3000-4000° C, тогда как при сгорании молекулярного водорода (2H2 + O2 -> 2H2O) выделяется всего 285,8 кДж и температура пламени достигает лишь 2500° C. При комнатной температуре водород менее реакционноспособен. Для инициирования большинства реакций необходимо разорвать или ослабить прочную связь H-H, израсходовав много энергии. Скорость реакций водорода возрастает с использованием катализатора (металлы платиновой группы, оксиды переходных или тяжелых металлов) и методов возбуждения молекулы (свет, электрический разряд, электрическая дуга, высокие температуры). В таких условиях водород реагирует практически с любым элементом, кроме благородных газов. Активные щелочные и щелочноземельные элементы (например, литий и кальций) реагируют с водородом, являясь донорами электронов и образуя соединения, называемые солевыми гидридами (2Li + H2 -> 2LiH; Ca + H2 -> CaH2).
Вообще гидридами называются соединения, содержащие водород. Широкое разнообразие свойств таких соединений (в зависимости от атома, связанного с водородом) объясняется возможностями водорода проявлять заряд от -1 до практически +1. Это отчетливо проявляется в сходстве LiH и CaH2 и солей типа NaCl и CaCl2. Считается, что в гидридах водород заряжен отрицательно (Н-); такой ион является восстановителем в кислой водной среде: 2H- H2 + 2e- + 2,25B. Ион H- способен восстанавливать протон воды H+ до газообразного водорода: H- + H2O (r) H2 + OH-.
Соединения водорода с бором - бороводороды (борогидриды) - представляют необычный класс веществ, называемых боранами. Простейшим представителем их является BH3, существующий только в устойчивой форме диборана B2H6. Соединения с большим количеством атомов бора получают разными способами. Известны, например, тетраборан B4H10, стабильный пентаборан B5H9 и нестабильный пентаборан B5H11, гексаборан B6H10, декаборан B10H14. Диборан может быть получен из H2 и BCl3 через промежуточное соединение B2H5Cl, которое при 0° C диспропорционирует до B2H6, а также взаимодействием LiH или литийалюминийгидрида LiAlH4 c BCl3. В литийалюминийгидриде (комплексном соединении - солевом гидриде) четыре атома водорода образуют ковалентные связи с Al, но имеется ионная связь Li+ с [[AlH4]]-. Другим примером водородсодержащего иона является борогидрид-ион BH4-. Ниже приведена приблизительная классификация гидридов по их свойствам в соответствии с положением элементов в периодической системе элементов. Гидриды переходных металлов называются металлическими или промежуточными и часто не образуют стехиометрических соединений, т.е. отношение атомов водорода к металлу не выражается целым числом, например, гидрид ванадия VH0,6 и гидрид тория ThH3,1. Металлы платиновой группы (Ru, Rh, Pd, Os, Ir и Pt) активно поглощают водород и служат эффективными катализаторами реакций гидрирования (например, гидрогенизации жидких масел с образованием жиров, конверсии азота в аммиак, синтеза метанола CH3OH из CO). Гидриды Be, Mg, Al и подгрупп Cu, Zn, Ga - полярные, термически нестабильные.
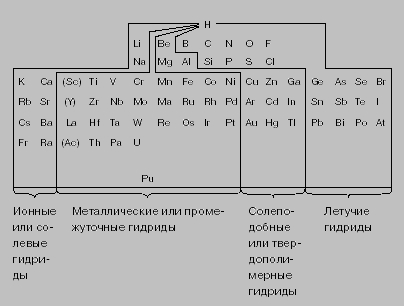
Неметаллы образуют летучие гидриды общей формулы MHx (х - целое число) с относительно низкой температурой кипения и высоким давлением паров. Эти гидриды существенно отличаются от солевых гидридов, в которых водород имеет более отрицательный заряд. У летучих гидридов (например, углеводородов) преобладает ковалентная связь между неметаллами и водородом. По мере усиления неметаллического характера образуются соединения с частично ионной связью, например H+Cl-, (H2)2+O2-, N3-(H3)3+. Отдельные примеры образования различных гидридов приведены ниже (в скобках указана теплота образования гидрида):
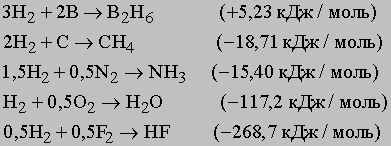
Изомерия и изотопы водорода. Атомы изотопов водорода непохожи. Обычный водород, протий, всегда представляет собой протон, вокруг которого вращается один электрон, находящийся от протона на огромном расстоянии (относительно размеров протона). Обе частицы обладают спином, поэтому атомы водорода могут различаться либо спином электрона, либо спином протона, либо и тем, и другим. Водородные атомы, различающиеся спином протона или электрона, называются изомерами. Комбинация двух атомов с параллельными спинами приводит к образованию молекулы "ортоводорода", а с противоположными спинами протонов - к молекуле "параводорода". Химически обе молекулы идентичны. Ортоводород имеет очень слабый магнитный момент. При комнатной или повышенной температуре оба изомера, ортоводород и параводород, находятся обычно в равновесии в соотношении 3:1. При охлаждении до 20 K (-253° C) содержание параводорода возрастает до 99%, так как он более стабилен. При сжижении методами промышленной очистки ортоформа переходит в параформу с выделением теплоты, что служит причиной потерь водорода от испарения. Скорость конверсии ортоформы в параформу возрастает в присутствии катализатора, например древесного угля, оксида никеля, оксида хрома, нанесенного на глинозем. Протий - необычный элемент, так как в ядре его нет нейтронов. Если в ядре появляется нейтрон, то такой водород называется дейтерий 21D. Элементы с одинаковым количеством протонов и электронов и разным количеством нейтронов называются изотопами. Природный водород содержит небольшую долю HD и D2. Аналогично, природная вода содержит в малой концентрации (менее 0,1%) DOH и D2O. Тяжелая вода D2O, имеющая массу больше, чем у H2O, отличается по физическим и химическим свойствам, например, плотность обычной воды 0,9982 г/мл (20° С), а тяжелой - 1,105 г/мл, температура плавления обычной воды 0,0° С, а тяжелой - 3,82° С, температура кипения - соответственно 100° С и 101,42° С. Реакции с участием D2O протекают с меньшей скоростью (например, электролиз природной воды, содержащей примесь D2O, с добавкой щелочи NaOH). Скорость электролитического разложения оксида протия H2O больше, чем D2O (с учетом постоянного роста доли D2O, подвергающейся электролизу). Благодаря близости свойств протия и дейтерия можно замещать протий на дейтерий. Такие соединения относятся к так называемым меткам. Смешивая соединения дейтерия с обычным водородсодержащим веществом, можно изучать пути, природу и механизм многих реакций. Таким методом пользуются для изучения биологических и биохимических реакций, например процессов пищеварения. Третий изотоп водорода, тритий (31T), присутствует в природе в следовых количествах. В отличие от стабильного дейтерия тритий радиоактивен и имеет период полураспада 12,26 лет. Тритий распадается до гелия (32He) с выделением b-частицы (электрона). Тритий и тритиды металлов используют для получения ядерной энергии; например, в водородной бомбе происходит следующая реакция термоядерного синтеза: 21H + 31H -> 42He + 10n + 17,6 МэВ
Получение водорода. Зачастую дальнейшее применение водорода определяется характером самого производства. В некоторых случаях, например при синтезе аммиака, небольшие количества азота в исходном водороде, конечно, не являются вредной примесью. Примесь оксида углерода(II) также не будет помехой, если водород используют как восстановитель. 1. Самое крупное производство водорода основано на каталитической конверсии углеводородов с водяным паром по схеме CnH2n + 2 + nH2O (r) nCO + (2n + 1)H2 и CnH2n + 2 + 2nH2O (r) nCO2 + (3n + 1)H2. Температура процесса зависит от состава катализатора. Известно, что температуру реакции с пропаном можно снизить до 370° С, используя в качестве катализатора боксит. До 95% производимого при этом CO расходуется при дальнейшей реакции с парами воды: H2O + CO -> CO2 + H2
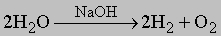
2. Метод водяного газа дает значительную часть общего производства водорода. Сущность метода заключается в реакции паров воды с коксом с образованием смеси CO и H2. Реакция эндотермична (DH° = 121,8 кДж/моль), и ее проводят при 1000° С. Нагретый кокс обрабатывают паром; выделяющаяся очищенная газовая смесь содержит некоторое количество водорода, большой процент CO и небольшую примесь CO2. Для повышения выхода H2 монооксид CO удаляют дальнейшей паровой обработкой при 370° C, при этом получается больше CO2. Углекислый газ довольно легко удалить, пропуская газовую смесь через скруббер, орошаемый водой противотоком. 3. Электролиз. В электролитическом процессе водород является фактически побочным продуктом производства главных продуктов - хлора и щелочи (NaOH). Электролиз проводят в слабощелочной водной среде при 80° C и напряжении около 2В, используя железный катод и никелевый анод:
4. Железо-паровой метод, по которому пар при 500-1000° C пропускают над железом: 3Fe + 4H2O Fe3O4 + 4H2 + 160,67 кДж. Получаемый этим методом водород обычно используют для гидрогенизации жиров и масел. Состав оксида железа зависит от температуры процесса; при nC + (n + 1)H2
6. Следующим по объему производства является метанол-паровой метод: CH3OH + H2O -> 3H2 + CO2. Реакция эндотермична и ее проводят при ВОДОРОД260° C в обычных стальных реакторах при давлении до 20 атм. 7. Каталитическое разложение аммиака: 2NH3 -> LiOH + H2
(Этот метод удобен при непосредственном применении получаемого водорода.) При взаимодействии кислот с активными металлами также выделяется водород, однако при этом он обычно загрязнен парами кислоты или другим газообразным продуктом, например фосфином PH3, сероводородом H2S, арсином AsH3. Наиболее активные металлы, реагируя с водой, вытесняют водород и образуют щелочной раствор: 2H2O + 2Na -> H2 + 2NaOH Распространен лабораторный метод получения H2 в аппарате Киппа по реакции цинка с соляной или серной кислотой:
Zn + 2HCl -> ZnCl2 + H2. Гидриды щелочноземельных металлов (например, CaH2), комплексные солевые гидриды (например, LiAlH4 или NaBH4) и некоторые бороводороды (например, B2H6) при реакции с водой или в процессе термической диссоциации выделяют водород. Бурый уголь и пар при высокой температуре также взаимодействуют с выделением водорода.
Очистка водорода. Степень требуемой чистоты водорода определяется его областью применения. Примесь углекислого газа удаляют вымораживанием или сжижением (например, пропуская газообразную смесь через жидкий азот). Эту же примесь можно полностью удалить барботированием через воду. CO может быть удален каталитическим превращением в CH4 или CO2 или сжижением при обработке жидким азотом. Примесь кислорода, образующаяся в процессе электролиза, удаляется в виде воды после искрового разряда.
Применение водорода. Водород применяется главным образом в химической промышленности для производства хлороводорода, аммиака, метанола и других органических соединений. Он используется при гидрогенизации масел, а также угля и нефти (для превращения низкосортных видов топлив в высококачественные). В металлургии с помощью водорода восстанавливают некоторые цветные металлы из их оксидов. Водород используют для охлаждения мощных электрогенераторов. Изотопы водорода находят применение в атомной энергетике. Водородно-кислородное пламя применяется для резки и сварки металлов.
ЛИТЕРАТУРА
Некрасов Б.В. Основы общей химии. М., 1973 Жидкий водород. М., 1980 Водород в металлах. М., 1981
ВОДОРОД (Hydrogenium), H, первый, наиболее легкий химический элемент периодической системы, атомная масса 1,00794; газ, tкип - 252,76°C. Ядро атома водорода называют протоном. Водород входит в состав воды, живых организмов, нефти, каменного угля, природного газа; самый распространенный элемент космоса - составляет более 70% массы Солнца и звезд. Термоядерные реакции с участием водорода - основной источник энергии звезд. Применяют водород для синтеза аммиака, метилового и других спиртов, углеводородов, соляной кислоты, для гидрогенизации пищевых жиров, при получении, сварке и резке металлов, как горючее в ракетной и космической технике и т.д. Изотопы водорода - протий (1H), дейтерий и тритий. Водород открыт в 16 веке Парацельсом, в 1766 английский физик и химик Г. Кавендиш впервые исследовал его свойства.
водоро́д, водоро́ды, водоро́да, водоро́дов, водоро́ду, водоро́дам, водоро́дом, водоро́дами, водоро́де, водоро́дах
сущ., кол-во синонимов: 10
водотвор (1)
газ (55)
гидроген (2)
дейтерий (2)
неметалл (17)
органоген (6)
протий (1)
топливо (48)
тритий (2)
элемент (159)
Буквально: "родящий воду". Этот химический элемент назван по своему свойству в сочетании с кислородом образовывать воду; любопытно, что русское водород образовано методом кальки с латинского hydrogenium, в котором элемент hydr соответствует русскому "вод", gen - русскому "род".
Словообразовательная калька лат. hydrogenium, в котором основа h.ydr- соответствует вод-, а основа gen -род. В рус. лит. яз. появилось в XVIII в.
Словообразовательная калька XVIII в. лат. hydrogenium, в котором основа hydr- соответствует вод-, а основа -gen- -род.
- «Первенец» таблицы Менделеева.
- Концентрацию ионов какого химического элемента показывает уровень pH?
- Химик Антуан Лавуазье установил, что в состав воды входит этот горючий газ.
- Его изотопы имеют собственные названия.
- Химический элемент, газ.
- Газ с именной бомбой.
- Его газообразный вид - самое неплотное вещество на Земле, а жидкий - самое плотное.
- Какой химический элемент присутствует во всех кислотах?
- Из чего состоят звёзды и межзвёздный газ?
- Самый лёгкий химический элемент.
- Какой химический элемент имеет наименьшее число изотопов - всего три?
- Самый распространённый элемент на Солнце.
- Самый распространённый элемент во Вселенной.
- Химический элемент, H.
- Именно этот химический элемент получил впервые в 1766 году Кавендиш, растворив цинк в разбавленной серной кислоте.
Водоро́да перокси́д (перекись водорода), Н2О2, бесцветная вязкая жидкость; плотность 1,45 г/см3, tпл -0,41°C, tкип 150,2°C. Легко разлагается на воду и кислород. Применяют как окислитель, инициатор полимеризации, для отбеливания волос, меха, шёлка, в медицине как антисептическое, кровоостанавливающее и дезодорирующее средство. Выпускается в виде 30-90%-ных водных растворов (30%-ный раствор называют пергидролем).
* * *
ВОДОРОДА ПЕРОКСИД - ВОДОРО́ДА ПЕРОКСИ́Д (перекись водорода), Н2О2, бесцветная вязкая жидкость; плотность 1,45 г/см3, tпл = 0,41 °С, tкип = 150,2 °С. Легко разлагается на воду и кислород. Применяют как окислитель, инициатор полимеризации, для отбеливания волос, меха, шелка, в медицине как антисептическое, кровоостанавливающее и дезодорирующее средство. Выпускается в виде 30 - 90%-ных водных растворов (30%-ный раствор называют пергидролем).
ВОДОРОДА ПЕРОКСИД (перекись водорода) - Н2О2, бесцветная вязкая жидкость; плотность 1,45 г/см³, tпл = 0,41 .С, tкип = 150,2 .С. Легко разлагается на воду и кислород. Применяют как окислитель, инициатор полимеризации, для отбеливания волос, меха, шелка, в медицине как антисептическое, кровоостанавливающее и дезодорирующее средство. Выпускается в виде 30 - 90%-ных водных растворов (30%-ный раствор называют пергидролем).
ВОДОРОДА ПЕРОКСИД (перекись водорода),H2O2, жидкость, tкип 150,2°C. 30%-й водородный раствор - пергидроль. Концентрированные водные растворы пероксида водорода взрывоопасны. Пероксид водорода применяют как окислитель в ракетных топливах, при получении различных химических веществ, для отбеливания масел, жиров, меха, кожи, тканей, бумаги, при извлечении металлов из руд, для обезвреживания сточных вод, как антисептик в медицине; гидроперит (соединение мочевины с пероксидом водорода) - для обесцвечивания волос. Пероксид водорода и его растворы обжигают кожу и слизистые оболочки.
ВОДОРО́ДИСТЫЙ и ВОДОРОДНЫЙ, водородистая, водородистое (хим.). прил. к водород.
водоро́дистый, водоро́дистая, водоро́дистое, водоро́дистые, водоро́дистого, водоро́дистой, водоро́дистых, водоро́дистому, водоро́дистым, водоро́дистую, водоро́дистою, водоро́дистыми, водоро́дистом, водоро́дист, водоро́диста, водоро́дисто, водоро́дисты, водоро́дистее, поводоро́дистее, водоро́дистей, поводоро́дистей
Водоро́дная бо́мба - ядерная бомба большой разрушительной силы, действие которой основано на использовании энергии, выделяющейся при реакции синтеза лёгких ядер (см. Термоядерные реакции). Первый термоядерный заряд (мощностью 3 Мт) взорван 1 ноября 1952 в США. Термоядерная бомба впервые испытана в СССР 12 августа 1953.
* * *
ВОДОРОДНАЯ БОМБА - ВОДОРО́ДНАЯ БО́МБА, устаревшее название ядерной бомбы большой разрушительной силы, действие которой основано на использовании энергии, выделяющейся при реакции синтеза легких ядер (см. Термоядерные реакции (см. ТЕРМОЯДЕРНЫЕ РЕАКЦИИ)). Впервые водородная бомба была испытана в СССР (1953).
ВОДОРОДНАЯ бомба - устаревшее название ядерной бомбы большой разрушительной силы, действие которой основано на использовании энергии, выделяющейся при реакции синтеза легких ядер (см. Термоядерные реакции). Впервые водородная бомба была испытана в СССР (1953).
ВОДОРОДНАЯ БОМБА - оружие большой разрушительной силы (порядка мегатонн в тротиловом эквиваленте), принцип действия которого основан на реакции термоядерного синтеза легких ядер. Источником энергии взрыва являются процессы, аналогичные процессам, протекающим на Солнце и других звездах.
Термоядерные реакции. В недрах Солнца содержится гигантское количество водорода, находящегося в состоянии сверхвысокого сжатия при температуре ок. 15 000 000 К. При столь высоких температуре и плотности плазмы ядра водорода испытывают постоянные столкновения друг с другом, часть из которых завершается их слиянием и в конечном счете образованием более тяжелых ядер гелия. Подобные реакции, носящие название термоядерного синтеза, сопровождаются выделением огромного количества энергии. Согласно законам физики, энерговыделение при термоядерном синтезе обусловлено тем, что при образовании более тяжелого ядра часть массы вошедших в его состав легких ядер превращается в колоссальное количество энергии. Именно поэтому Солнце, обладая гигантской массой, в процессе термоядерного синтеза ежедневно теряет ок. 100 млрд. т вещества и выделяет энергию, благодаря которой стала возможной жизнь на Земле.
Изотопы водорода. Атом водорода - простейший из всех существующих атомов. Он состоит из одного протона, являющегося его ядром, вокруг которого вращается единственный электрон. Тщательные исследования воды (H2O) показали, что в ней в ничтожном количестве присутствует "тяжелая" вода, содержащая "тяжелый изотоп" водорода - дейтерий (2H). Ядро дейтерия состоит из протона и нейтрона - нейтральной частицы, по массе близкой к протону. Существует третий изотоп водорода - тритий, в ядре которого содержатся один протон и два нейтрона. Тритий нестабилен и претерпевает самопроизвольный радиоактивный распад, превращаясь в изотоп гелия. Следы трития обнаружены в атмосфере Земли, где он образуется в результате взаимодействия космических лучей с молекулами газов, входящих в состав воздуха. Тритий получают искусственным путем в ядерном реакторе, облучая изотоп литий-6 потоком нейтронов.
Разработка водородной бомбы. Предварительный теоретический анализ показал, что термоядерный синтез легче всего осуществить в смеси дейтерия и трития. Приняв это за основу, ученые США в начале 1950 приступили к реализации проекта по созданию водородной бомбы (HB). Первые испытания модельного ядерного устройства были проведены на полигоне Эниветок весной 1951; термоядерный синтез был лишь частичным. Значительный успех был достигнут 1 ноября 1951 при испытании массивного ядерного устройства, мощность взрыва которого составила 4е8 Мт в тротиловом эквиваленте. Первая водородная авиабомба была взорвана в СССР 12 августа 1953, а 1 марта 1954 на атолле Бикини американцы взорвали более мощную (примерно 15 Мт) авиабомбу. С тех пор обе державы проводили взрывы усовершенствованных образцов мегатонного оружия. Взрыв на атолле Бикини сопровождался выбросом большого количества радиоактивных веществ. Часть из них выпала в сотнях километров от места взрыва на японское рыболовецкое судно "Счастливый дракон", а другая покрыла остров Ронгелап. Поскольку в результате термоядерного синтеза образуется стабильный гелий, радиоактивность при взрыве чисто водородной бомбы должна быть не больше, чем у атомного детонатора термоядерной реакции. Однако в рассматриваемом случае прогнозируемые и реальные радиоактивные осадки значительно различались по количеству и составу.
Механизм действия водородной бомбы. Последовательность процессов, происходящих при взрыве водородной бомбы, можно представить следующим образом. Сначала взрывается находящийся внутри оболочки HБ заряд-инициатор термоядерной реакции (небольшая атомная бомба), в результате чего возникает нейтронная вспышка и создается высокая температура, необходимая для инициации термоядерного синтеза. Нейтроны бомбардируют вкладыш из дейтерида лития - соединения дейтерия с литием (используется изотоп лития с массовым числом 6). Литий-6 под действием нейтронов расщепляется на гелий и тритий. Таким образом, атомный запал создает необходимые для синтеза материалы непосредственно в самой приведенной в действие бомбе. Затем начинается термоядерная реакция в смеси дейтерия с тритием, температура внутри бомбы стремительно нарастает, вовлекая в синтез все большее и большее количество водорода. При дальнейшем повышении температуры могла бы начаться реакция между ядрами дейтерия, характерная для чисто водородной бомбы. Все реакции, конечно, протекают настолько быстро, что воспринимаются как мгновенные.
Деление, синтез, деление (супербомба). На самом деле в бомбе описанная выше последовательность процессов заканчивается на стадии реакции дейтерия с тритием. Далее конструкторы бомбы предпочли использовать не синтез ядер, а их деление. В результате синтеза ядер дейтерия и трития образуются гелий и быстрые нейтроны, энергия которых достаточно велика, чтобы вызвать деление ядер урана-238 (основной изотоп урана, значительно более дешевый, чем уран-235, используемый в обычных атомных бомбах). Быстрые нейтроны расщепляют атомы урановой оболочки супербомбы. Деление одной тонны урана создает энергию, эквивалентную 18 Мт. Энергия идет не только на взрыв и выделение тепла. Каждое ядро урана расщепляется на два сильно радиоактивных "осколка". В число продуктов деления входят 36 различных химических элементов и почти 200 радиоактивных изотопов. Все это и составляет радиоактивные осадки, сопровождающие взрывы супербомб. Благодаря уникальной конструкции и описанному механизму действия оружие такого типа может быть сделано сколь угодно мощным. Оно гораздо дешевле атомных бомб той же мощности.
Последствия взрыва. Ударная волна и тепловой эффект. Прямое (первичное) воздействие взрыва супербомбы носит тройственный характер. Наиболее очевидное из прямых воздействий - это ударная волна огромной интенсивности. Сила ее воздействия, зависящая от мощности бомбы, высоты взрыва над поверхностью земли и характера местности, уменьшается с удалением от эпицентра взрыва. Тепловое воздействие взрыва определяется теми же факторами, но, кроме того, зависит и от прозрачности воздуха - туман резко уменьшает расстояние, на котором тепловая вспышка может вызвать серьезные ожоги. Согласно расчетам, при взрыве в атмосфере 20-мегатонной бомбы люди останутся живы в 50% случаев, если они 1) укрываются в подземном железобетонном убежище на расстоянии примерно 8 км от эпицентра взрыва (ЭВ), 2) находятся в обычных городских постройках на расстоянии ок. 15 км от ЭВ, 3) оказались на открытом месте на расстоянии ок. 20 км от ЭВ. В условиях плохой видимости и на расстоянии не менее 25 км, если атмосфера чистая, для людей, находящихся на открытой местности, вероятность уцелеть быстро возрастает с удалением от эпицентра; на расстоянии 32 км ее расчетная величина составляет более 90%. Площадь, на которой возникающее во время взрыва проникающее излучение вызывает летальный исход, сравнительно невелика даже в случае супербомбы высокой мощности.
Огненный шар. В зависимости от состава и массы горючего материала, вовлеченного в огненный шар, могут образовываться гигантские самоподдерживающиеся огненные ураганы, бушующие в течение многих часов. Однако самое опасное (хотя и вторичное) последствие взрыва - это радиоактивное заражение окружающей среды.
Радиоактивные осадки. Как они образуются.
При взрыве бомбы возникший огненный шар наполняется огромным количеством радиоактивных частиц. Обычно эти частицы настолько малы, что, попав в верхние слои атмосферы, могут оставаться там в течение долгого времени. Но если огненный шар соприкасается с поверхностью Земли, все, что на ней находится, он превращает в раскаленные пыль и пепел и втягивает их в огненный смерч. В вихре пламени они перемешиваются и связываются с радиоактивными частицами. Радиоактивная пыль, кроме самой крупной, оседает не сразу. Более мелкая пыль уносится возникшим в результате взрыва облаком и постепенно выпадает по мере движения его по ветру. Непосредственно в месте взрыва радиоактивные осадки могут быть чрезвычайно интенсивными - в основном это оседающая на землю крупная пыль. В сотнях километров от места взрыва и на более далеких расстояниях на землю выпадают мелкие, но все еще видимые глазом частицы пепла. Часто они образуют похожий на выпавший снег покров, смертельно опасный для всех, кто окажется поблизости. Еще более мелкие и невидимые частицы, прежде чем они осядут на землю, могут странствовать в атмосфере месяцами и даже годами, много раз огибая земной шар. К моменту выпадения их радиоактивность значительно ослабевает. Наиболее опасным остается излучение стронция-90 с периодом полураспада 28 лет. Его выпадение четко наблюдается повсюду в мире. Оседая на листве и траве, он попадает в пищевые цепи, включающие и человека. Как следствие этого, в костях жителей большинства стран обнаружены заметные, хотя и не представляющие пока опасности, количества стронция-90. Накопление стронция-90 в костях человека в долгосрочной перспективе весьма опасно, так как приводит к образованию костных злокачественных опухолей.
Длительное заражение местности радиоактивными осадками. В случае военных действий применение водородной бомбы приведет к немедленному радиоактивному загрязнению территории в радиусе ок. 100 км от эпицентра взрыва. При взрыве супербомбы загрязненным окажется район в десятки тысяч квадратных километров. Столь огромная площадь поражения одной-единственной бомбой делает ее совершенно новым видом оружия. Даже если супербомба не попадет в цель, т.е. не поразит объект ударно-тепловым воздействием, проникающее излучение и сопровождающие взрыв радиоактивные осадки сделают окружающее пространство непригодным для обитания. Такие осадки могут продолжаться в течение многих дней, недель и даже месяцев. В зависимости от их количества интенсивность радиации может достичь смертельно опасного уровня. Сравнительно небольшого числа супербомб достаточно, чтобы полностью покрыть крупную страну слоем смертельно опасной для всего живого радиоактивной пыли. Таким образом, создание сверхбомбы ознаменовало начало эпохи, когда стало возможным сделать непригодными для обитания целые континенты. Даже спустя длительное время после прекращения прямого воздействия радиоактивных осадков будет сохраняться опасность, обусловленная высокой радиотоксичностью таких изотопов, как стронций-90. С продуктами питания, выращенными на загрязненных этим изотопом почвах, радиоактивность будет поступать в организм человека.
См. также
ЛИТЕРАТУРА
Действие ядерного оружия. М., 1960 Ядерный взрыв в космосе, на земле и под землей. М., 1970
Водоро́дная связь - вид химической связи типа А-Н...А'; образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом A (N, O, S и др.), и неподелённой парой электронов другого атома А' (обычно О, N). Атомы А и А' могут принадлежать как одной, так и разным молекулам. Водородная связь приводит к ассоциации одинаковых или различных молекул в комплексы; во многом определяет свойства воды и льда, молекул кристаллов, структуру и свойства многих синтетических полиамидов, белков, нуклеиновых кислот и др.
* * *
ВОДОРОДНАЯ СВЯЗЬ - ВОДОРО́ДНАЯ СВЯЗЬ, вид химической связи типа А - Н...А"; образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом А (N, O, S и др.), и неподеленной парой электронов другого атома А" (обычно O, N). Атомы А и А" могут принадлежать как одной, так и разным молекулам. Водородная связь приводит к ассоциации одинаковых или различных молекул в комплексы; во многом определяет свойства воды и льда, молекулярных кристаллов, структуру и свойства многих синтетических полиамидов, белков, нуклеиновых кислот и др.
ВОДОРОДНАЯ связь - вид химической связи типа А - Н...А ; образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом А (N, O, S и др.), и неподеленной парой электронов другого атома А (обычно O, N). Атомы А и А могут принадлежать как одной, так и разным молекулам. Водородная связь приводит к ассоциации одинаковых или различных молекул в комплексы; во многом определяет свойства воды и льда, молекулярных кристаллов, структуру и свойства многих синтетических полиамидов, белков, нуклеиновых кислот и др.
Водоро́дная энерге́тика - включает получение Н2 из воды и другого природного сырья с затратой солнечной, ядерной или другой энергии, его хранение и использование как топлива, а также в химических способах передачи энергии на расстояние. Главные преимущества: высокая теплота сгорания (143,06 МДж/кг); неограниченные запасы сырья, если в качестве сырья рассматривать воду, и экологическую безопасность, так как продукт его сгорания - вода. Водородная энергетика пока не получила массового применения. Основная проблемы: разработка экономичной производительной аппаратуры для получения Н2, например, электролизёров, плазмотронов; способы хранения его в газообразном и сжиженном состояниях или в виде синтезированных соединений, например, гидридов интерметаллидов; транспортировка с небольшими потерями.
* * *
ВОДОРОДНАЯ ЭНЕРГЕТИКА - ВОДОРО́ДНАЯ ЭНЕРГЕ́ТИКА, включает получение Н2 из воды и другого природного сырья с затратой солнечной, ядерной или др. энергии, его хранение и использование как топлива, а также в химических способах передачи энергии. Главные преимущества: высокая теплота сгорания (143,06 МДж/кг) по сравнению с углеводородным топливом (29,3 МДж/кг); неограниченные запасы сырья, если в качестве сырья рассматривать воду, и экологическую безопасность, т. к. продукт его сгорания - вода. Водородная энергетика пока не получила массового применения. Основные проблемы: разработка экономичной производительной аппаратуры для получения Н2, напр., электролизеров, плазмотронов; способы хранения его в газообразном и сжиженном состояниях или в виде синтезированных соединений, напр., гидридов интерметаллидов; транспортировка с небольшими потерями.
ВОДОРОДНАЯ энергетика - включает получение Н2 из воды и другого природного сырья с затратой солнечной, ядерной или др. энергии, его хранение и использование как топлива, а также в химических способах передачи энергии. Главные преимущества: высокая теплота сгорания (143,06 МДж/кг) по сравнению с углеводородным топливом (29,3 МДж/кг); неограниченные запасы сырья, если в качестве сырья рассматривать воду, и экологическую безопасность, т. к. продукт его сгорания - вода. Водородная энергетика пока не получила массового применения. Основные проблемы: разработка экономичной производительной аппаратуры для получения Н2, напр., электролизеров, плазмотронов; способы хранения его в газообразном и сжиженном состояниях или в виде синтезированных соединений, напр., гидридов интерметаллидов; транспортировка с небольшими потерями.
прил.
1. соотн. с сущ. водород, связанный с ним
2. Свойственный водороду, характерный для него.
3. Содержащий в своём химическом составе водород.
4. Производимый с помощью водорода.
водоро́дный, водоро́дная, водоро́дное, водоро́дные, водоро́дного, водоро́дной, водоро́дных, водоро́дному, водоро́дным, водоро́дную, водоро́дною, водоро́дными, водоро́дном, водоро́ден, водоро́дна, водоро́дно, водоро́дны, водоро́днее, поводоро́днее, водоро́дней, поводоро́дней
Водоро́дный показа́тель (pH), характеризует концентрацию (активность) ионов водорода в растворах; численно равен отрицательному десятичному логарифму концентрации (активности) водородных ионов [H+], выраженной в молях на литр: рН = -lg[H+]. Водные растворы могут иметь pH от 1 до 14; в нейтральных растворах рН = 7, в кислых pH 7.
* * *
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ - ВОДОРО́ДНЫЙ ПОКАЗА́ТЕЛЬ (рН), характеризует концентрацию (активность) ионов водорода в растворах; численно равен отрицательному десятичному логарифму концентрации (активности) водородных ионов [H+], выраженной в молях на литр: рН=-lg[H+]. Водные растворы могут иметь рН от 1 до 14; в нейтральных растворах рН = 7, в кислых < 7, в щелочных > 7.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (рН) - характеризует концентрацию (активность) ионов водорода в растворах; численно равен отрицательному десятичному логарифму концентрации (активности) водородных ионов ВОДОРОДНЫЙ цикл (протон-протонная цепочка) - цепочка термоядерных реакций превращения водорода в гелий без участия катализаторов. Водородный цикл - основной источник энергии большинства звезд, в т. ч. Солнца.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (pH), характеризует кислотность разбавленных растворов. Определяется как отрицательный десятичный логарифм концентрации ионов H+ . В нейтральных водных растворах pH=7, в кислых 7.
Водоро́дный цикл (протон-протонная цепочка), цепочка термоядерных реакций превращения водорода в гелий без участия катализаторов. Водородный цикл - основной источник энергии большинства звёзд, в том числе Солнца.
* * *
ВОДОРОДНЫЙ ЦИКЛ - ВОДОРО́ДНЫЙ ЦИКЛ (протон-протонная цепочка), цепочка термоядерных реакций (см. ТЕРМОЯДЕРНЫЕ РЕАКЦИИ) превращения водорода в гелий без участия катализаторов. Водородный цикл - основной источник энергии большинства звезд, в т. ч. Солнца.
Водоро́дный электро́д - в электрохимии, обычно платинированная пластина, погружённая в раствор кислоты с определенной концентрацией ионов Н+ и омываемая газообразным водородом. При давлении водорода 0,1 МПа и термодинамической активности его ионов, равной единице, потенциал водородного электрода условно принят равным нулю. Такой водородный электрод называется стандартным, он служит электродом сравнения, от которого отсчитывают потенциалы других электродов.
* * *
ВОДОРОДНЫЙ ЭЛЕКТРОД - ВОДОРО́ДНЫЙ ЭЛЕКТРО́Д в электрохимии, обычно платинированная пластина, погруженная в раствор кислоты с определенной концентрацией ионов Н+ и омываемая газообразным водородом. При давлении водорода 0,1 МПa и термодинамической активности его ионов, равной единице, потенциал водородного электрода условно принят равным нулю. Такой водородный электрод называется стандартным, он служит электродом сравнения, от которого отсчитывают потенциалы других электродов.
ВОДОРОДНЫЙ электрод в электрохимии - обычно платинированная пластина, погруженная в раствор кислоты с определенной концентрацией ионов Н+ и омываемая газообразным водородом. При давлении водорода 0,1 МПa и термодинамической активности его ионов, равной единице, потенциал водородного электрода условно принят равным нулю. Такой водородный электрод называется стандартным, он служит электродом сравнения, от которого отсчитывают потенциалы других электродов.
Водородоподо́бные а́томы - атом H и ионы, состоящие (как и атом H) из ядра и одного электрона (например, однократно ионизованный Не, двукратно ионизованный Li). К водородоподобным атомам относят также атомы и ионы с одним высоковозбуждённым (ридберговским) электроном. Спектры водородоподобных атомов сходны со спектром атома H.
* * *
ВОДОРОДОПОДОБНЫЕ АТОМЫ - ВОДОРОДОПОДО́БНЫЕ А́ТОМЫ, атом Н и ионы, состоящие, как и Н, из ядра и одного электрона (напр., однократно ионизованный Не, двукратно ионизованный Li). К водородоподобным атомам относят также атомы и ионы с одним высоковозбужденным (ридберговским) электроном. Спектры водородоподобных атомов сходны со спектром Н.
ВОДОРОДОПОДОБНЫЕ АТОМЫ - атом Н и ионы, состоящие, как и Н, из ядра и одного электрона (напр., однократно ионизованный Не, двукратно ионизованный Li). К водородоподобным атомам относят также атомы и ионы с одним высоковозбужденным (ридберговским) электроном. Спектры водородоподобных атомов сходны со спектром Н.
сущ., кол-во синонимов: 12
буерак (18)
водомоина (14)
водорой (4)
водорытвина (6)
вымоина (5)
овраг (28)
промоина (13)
промой (6)
ров (28)
росточь (9)
рытвина (32)
яма (84)
- Полая форма рельефа, образующаяся в результате струйчатого размыва при ливнях или снеготаянии на пашне, насыпях, склонах оврагов.
ВО́ДОРОСЛЬ, -и, ж. Низшее водяное растение, у к-рого отсутствует расчленение на корень, стебель и листья. Пруд зарос водорослями.
во́дорослевый, во́дорослевая, во́дорослевое, во́дорослевые, во́дорослевого, во́дорослевой, во́дорослевых, во́дорослевому, во́дорослевым, во́дорослевую, во́дорослевою, во́дорослевыми, во́дорослевом, во́дорослев, во́дорослева, во́дорослево, во́дорослевы, во́дорослевее, пово́дорослевее, во́дорослевей, пово́дорослевей
мн.
1. Низшие споровые водные растения, отличающиеся от других растений отсутствием членения на стебель, корень и лист.
2. разг.
Любые водные растения.
ВО́ДОРОСЛИ -ей; мн. (ед. во́доросль, -и; ж.). Низшие водные растения, у которых отсутствует расчленение на стебель, корень и листья. Пруд зарос водорослями.
* * *
во́доросли - группа преимущественно водных организмов, обычно содержащих хлорофилл и вырабатывающих органические вещества в процессе фотосинтеза. Тело водоросли - таллом, не имеющий настоящих корней, стеблей и листьев, от долей микрона до 60 м. Неклеточные, одноклеточные, многоклеточные, колониальные организмы. Вопрос об их положении в системе органического мира остаётся открытым. Одни исследователи считают их низшими растениями, другие выделяют в особое царство - протисты; сине-зелёные водоросли относят к бактериям (см. Цианобактерии). Размножение бесполое, вегетативное и половое. Отделы (или типы) водорослей: зелёные, бурые, красные, золотистые, жёлто-зелёные, диатомовые и др. Около 30 тыс. видов водорослей - основные продуценты органического вещества в пресных водоёмах и морях. Входят в состав планктона и бентоса. Некоторые съедобны (например, ламинария, порфира), другие - сырьё для получения кормовой массы, агара, каррагена, йода и др. (многие из них - объект аквакультуры). Ряд водорослей испытывают как компоненты биокомплексов, входящих в систему жизнеобеспечения космических кораблей. Некоторые одноклеточные водоросли в симбиозе с грибами образуют лишайники.

* * *
ВОДОРОСЛИ - ВО́ДОРОСЛИ, группа низших водных растений, обычно содержащих хлорофилл и вырабатывающих органические вещества в процессе фотосинтеза. Тело водоросли - таллом, не имеющий настоящих корней, стеблей и листьев, от долей микрона до 60 м. Неклеточные, одноклеточные, многоклеточные, колониальные организмы. Размножение бесполое, вегетативное и половое. Отделы (или типы) водорослей: зеленые, бурые, красные, золотистые, желто-зеленые, диатомовые (см. ДИАТОМОВЫЕ ВОДОРОСЛИ) и др. Ок. 30 тыс. видов. Сине-зеленые водоросли чаще рассматривают как цианобактерии и относят к дробянкам (см. ДРОБЯНКИ). Водоросли - основные продуценты органического вещества в пресных водоемах и морях. Входят в состав планктона и бентоса (см. БЕНТОС). Некоторые съедобны (напр., ламинария (см. ЛАМИНАРИЯ), порфира (см. ПОРФИРА (водоросли))), другие - сырье для получения кормовой массы, агара (см. АГАР), каррагена, иода и др. (многие из них - объект аквакультуры (см. АКВАКУЛЬТУРА)). Ряд водорослей испытывают как компоненты биокомплексов, входящих в систему жизнеобеспечения космических кораблей. Некоторые одноклеточные и водоросли в симбиозе с грибами образуют лишайники.
ВОДОРОСЛИ - группа низших водных растений, обычно содержащих хлорофилл и вырабатывающих органические вещества в процессе фотосинтеза. Тело водоросли - таллом, не имеющий настоящих корней, стеблей и листьев, от долей микрона до 60 м. Неклеточные, одноклеточные, многоклеточные, колониальные организмы. Размножение бесполое, вегетативное и половое. Отделы (или типы) водорослей: зеленые, бурые, красные, золотистые, желто-зеленые, диатомовые и др. Ок. 30 тыс. видов. Сине-зеленые водоросли чаще рассматривают как цианобактерии и относят к дробянкам. Водоросли - основные продуценты органического вещества в пресных водоемах и морях. Входят в состав планктона и бентоса. Некоторые съедобны (напр., ламинария, порфира), другие - сырье для получения кормовой массы, агара, каррагена, иода и др. (многие из них - объект аквакультуры). Ряд водорослей испытывают как компоненты биокомплексов, входящих в систему жизнеобеспечения космических кораблей. Некоторые одноклеточные и водоросли в симбиозе с грибами образуют лишайники.
ВОДОРОСЛИ (Algae), обширная и неоднородная группа примитивных, напоминающих растения организмов. За немногими исключениями, они содержат зеленый пигмент хлорофилл, который необходим для питания путем фотосинтеза, т.е. синтеза глюкозы из диоксида углерода и воды. Очень редко встречаются бесцветные водоросли, но во многих случаях зеленый хлорофилл маскируется у них пигментами другого цвета. Фактически среди тысяч видов, входящих в эту группу, можно найти формы, окрашенные в любой из тонов солнечного спектра. Хотя водоросли иногда относят к наиболее примитивным организмам, это мнение можно принять лишь с существенными оговорками. Действительно, у многих из них отсутствуют сложные ткани и органы, сравнимые с хорошо известными у семенных растений, папоротниковидных и даже у мхов и печеночников, однако все процессы, необходимые для роста, питания и размножения их клеток, весьма, если не полностью, сходны с происходящими в растениях. Таким образом, физиологически водоросли достаточно сложны. Водоросли - самые многочисленные, самые важные для планеты и шире всего распространенные фотосинтезирующие организмы. Их много повсюду - в пресных водах, на суше и в морях, чего нельзя сказать, например, о печеночниках, мхах, папоротниковидных или семенных растениях. Невооруженным глазом водоросли часто можно наблюдать в виде мелких или крупных пятен зеленой или иначе окрашенной пены ("тины") на поверхности воды. На почве или древесных стволах они обычно выглядят как зеленая или сине-зеленая слизь. В море слоевища крупных водорослей (макрофитов) напоминают красные, бурые и желтые блестящие листья различной формы.
Морфология и анатомия. Размеры водорослей широко варьируют - от микроскопических форм диаметром или длиной в тысячные доли сантиметра до морских гигантов длиной более 60 м. Многие водоросли - одноклеточные или состоят из нескольких клеток, образующих рыхлые агрегаты. Некоторые представляют собой строго организованные колонии клеток, но есть и настоящие многоклеточные организмы. Клетки могут соединяться торцами, образуя цепочки и нити - как ветвистые, так и неветвистые. Вся структура в целом иногда выглядит как маленький диск, трубка, булава и даже дерево, а иногда напоминает ленту, звезду, лодочку, шар, лист или пучок волос. Поверхность клеток может быть гладкой, или же покрытой сложным узором из шипов, сосочков, ямок и гребней. У большинства водорослей клетки по общему строению сходны с зелеными клетками растений, например кукурузы или томата. Жесткая клеточная стенка, состоящая в основном из целлюлозы и пектиновых веществ, окружает протопласт, в котором различают ядро и цитоплазму с включенными в нее особыми органоидами - пластидами. Самые важные из них - хлоропласты, содержащие хлорофилл. В клетке также имеются заполненные жидкостью полости - вакуоли, которые содержат растворенные питательные вещества, минеральные соли и газы. Однако такая структура клетки свойственна не всем водорослям. У диатомовых одним их важнейших составляющих клеточной стенки является кремнезем, создающий как бы стеклянный панцирь. Зеленый цвет хлоропластов часто маскируется другими веществами, обычно - пигментами. У небольшого числа водорослей жесткой клеточной стенки нет совсем.
Локомоция. Многие водные вегетативные клетки и колонии водорослей, а также некоторые типы их репродуктивных клеток движутся довольно быстро. Они снабжены одним или несколькими бичевидными придатками - жгутиками, биение которых проталкивает их сквозь толщу воды. Некоторые лишенные клеточной стенки водоросли способны вытягивать вперед части своего тела, подтягивать к ним остальные и за счет этого "ползти" по твердым поверхностям. Такое движение называется амебоидным, поскольку примерно так же перемещаются всем известные амебы. Прямолинейная или зигзагообразная локомоция диатомовых - обладателей твердой клеточной стенки, - вероятно, обусловлена токами воды, создаваемыми различными струйчатыми движениями их цитоплазмы. Скольжение, ползание, волнообразное перемещение более или менее жестко прикрепленных к субстрату водорослей обычно сопровождается образованием и разжижением слизи.
Размножение. Почти все одноклеточные водоросли способны размножаться простым делением. Клетка делится надвое, обе дочерние клетки - тоже, и этот процесс в принципе может идти до бесконечности. Поскольку клетка погибает только в результате "несчастного случая", можно говорить о своего рода бессмертии. Особый случай - клеточное деление у диатомовых. Их панцирь состоит из двух половинок (створок), входящих друг в друга, как две части мыльницы. Каждая дочерняя клетка получает одну родительскую створку, а вторую достраивает сама. В результате у диатомеи одна створка может быть новой, а вторая - полученной в наследство от далекого предка. Протопласт некоторых вегетативных клеток способен разделяться с образованием подвижных или неподвижных спор. Из них после длительного или короткого периода покоя развивается зрелая водоросль. Это одна из форм бесполого размножения. При половом размножении у водорослей формируются мужские и женские половые клетки (гаметы). Мужская гамета сливается с женской, т.е. происходит оплодотворение, и образуется зигота. Последняя, обычно после периода покоя, длящегося в зависимости от вида водорослей от нескольких недель до нескольких лет, начинает расти и дает в конечном итоге взрослую особь. Гаметы сильно варьируют по размерам, форме и подвижности. У некоторых водорослей мужская и женская гаметы структурно сходны, а у других четко различаются, т.е. представляют собой спермии и яйцеклетки. Таким образом, половое размножение водорослей имеет множество форм и уровней сложности.
РАСПРОСТРАНЕНИЕ И ЭКОЛОГИЯ
Водные водоросли. На планете трудно найти место, где не было бы водорослей. Обычно их считают водными организмами, и, действительно, подавляющее большинство водорослей обитает в лужах и прудах, реках и озерах, морях и океанах, причем в определенные сезоны они могут становиться там очень обильными. Водоросли прикрепляются к скалам, камням, кускам древесины, к водным растениями или же свободно плавают, составляя часть планктона. Временами эта их взвесь, включающая миллиарды микроскопических форм, достигает консистенции горохового супа, заполняя собой обширные пространства озер и морей. Такое явление называют "водорослевым цветением" воды. Глубина, на которой можно встретить водоросли, зависит от прозрачности воды, т.е. ее способности пропускать необходимый для фотосинтеза свет. Большинство водорослей сосредоточено в поверхностном слое толщиной несколько дециметров, однако некоторые зеленые и красные водоросли встречаются и на значительно большей глубине. Отдельные виды способны расти в океане на глубине 60-90 м. Некоторые водоросли, даже вмерзнув в лед, могут сохранять в состоянии анабиоза жизнеспособность на протяжении многих месяцев.
Почвенные водоросли. Несмотря на свое название, водоросли встречаются не только в воде. Например, их очень много в почве. В 1 г хорошо унавоженной почвы можно обнаружить ок. 1 млн. их отдельных экземпляров. Те, что сосредоточены на поверхности почвы и непосредственно под ней, питаются путем фотосинтеза. Прочие живут в темноте, бесцветны и поглощают растворенную пищу из окружающей среды, т.е. являются сапрофитами. Основная группа почвенных водорослей - диатомовые, хотя местами в этой среде обитания обильны также зеленые, желто-зеленые и золотистые водоросли.
Снежные водоросли в больших количествах часто встречаются во льдах и снегах арктической и антарктической пустынь, а также альпийских высокогорий. В холодных полярных морях они растут столь же хорошо, как и в горячих источниках. Так называемый "красный снег" - результат присутствия в нем микроскопических водорослей. Снежные водоросли бывают окрашены в красный, зеленый, желтый и бурый цвет.
Другие типы водорослей. Водоросли живут и во многих других местообитаниях, иногда весьма необычных. Они встречаются, например, на поверхности или внутри водных и наземных растений. Поселяясь в тканях многих тропических и субтропических видов, они растут здесь настолько активно, что могут повреждать их листья: у чайного куста такая болезнь называется "ржавчиной". В умеренном климате водоросли часто покрывают зеленым налетом кору деревьев, обычно с затененной стороны. Некоторые зеленые водоросли образуют симбиотические ассоциации с определенными грибами; такие ассоциации представляют собой особые, вполне самостоятельные организмы, называемые лишайниками. Ряд мелких форм растет на поверхности и внутри более крупных водорослей, а один род зеленых водорослей - только на панцире черепах. Зеленые и красные водоросли встречаются в волосяных фолликулах трехпалых ленивцев, населяющих дождевые тропические леса Центральной и Южной Америки. Растут водоросли и на теле рыб и ракообразных. Возможно, некоторые плоские черви и кишечнополостные могут вообще не заглатывать пищу, поскольку получают ее от зеленых водорослей, обитающих в их теле.
Лимитирующие экологические факторы. Хотя водоросли встречаются практически везде, для жизни каждому их виду необходимо определенное сочетание освещенности, влажности и температуры, наличие необходимых газов и минеральных солей. Для фотосинтеза нужны свет, вода и диоксид углерода. Некоторые водоросли переносят значительные периоды почти полного высыхания, однако для роста им все равно требуется вода, служащая единственной средой обитания для подавляющего большинства форм. Содержание кислорода и СО2 в водоемах сильно варьирует, однако водорослям их обычно вполне хватает. Большие количества водорослей в мелких водоемах иногда за ночь расходуют столько кислорода, что вызывают массовый замор рыбы: ей становится нечем дышать. Для роста водорослей необходимы растворенные в воде соединения азота и многих других химических элементов. Концентрация этих минеральных солей в толще воды гораздо ниже, чем во многих почвах, но целому ряду видов ее, как правило, достаточно для массового развития. Иногда рост водорослей резко ограничивается из-за недостатка одного-единственного элемента: диатомовые, например, редки в воде, содержащей мало силикатов. Делались попытки разделить водоросли на экологические группы: водные, почвенные, снежные или накоровые формы, эпибионты и т.д. Некоторые водоросли растут и размножаются только в строго определенное время года, т.е. могут считаться однолетниками; другие - многолетники, у которых лишь размножение приурочено к определенному времени. Ряд одноклеточных и колониальных форм завершает вегетативную и репродуктивную фазы своего жизненного цикла всего за несколько дней. Все эти феномены, безусловно, связаны не только с наследственностью организмов, но и с различными факторами окружающей их среды, однако выяснение точных взаимосвязей внутри намечающихся экологических групп водорослей - дело будущего.
ВОДОРОСЛИ В ПРОШЛОМ
Вполне вероятно, что некоторые формы водорослей существовали уже в древнейшие геологические эпохи. Многие из них, судя по современным видам, не могли из-за особенностей своего строения (отсутствия твердых частей) оставить окаменелостей, поэтому сказать, какими точно они были, невозможно. Ископаемые формы основных нынешних групп водорослей, кроме диатомовых и нескольких других, известны с палеозоя (570-245 млн. лет назад). Наиболее обильными в ту эпоху, вероятно, были зеленые, бурые, красные и харовые водоросли, обитавшие в морях и океанах. Косвенное свидетельство раннего появления на нашей планете водорослей - научно доказанное существование в палеозое множества морских животных, которые должны были питаться органикой. Первичным ее источником для них скорее всего служили фотосинтезирующие водоросли, потребляющие только минеральные вещества.
Ископаемые диатомовые водоросли. Ископаемые диатомовые водоросли (диатомеи) в виде особой горной породы - т.н. диатомита - обнаружены во многих регионах. Диатомит бывает как морского, так и пресноводного происхождения. В Калифорнии, например, находится его залежь площадью примерно 30 км2 и мощностью почти 400 м. Она состоит почти исключительно из панцирей диатомей. В 1 см3 диатомита их насчитывается до 650 000.
Эволюция водорослей. Многие группы водорослей, похоже, мало изменились со времени своего возникновения. Впрочем, определенные их виды, некогда весьма обильные, сейчас вымерли. Крупных колебаний в видовом разнообразии и общей численности водорослей на протяжении истории Земли, насколько известно, не было. Водные местообитания за многие миллионы лет менялись слабо, и современные формы водорослей существуют, безусловно, уже очень долго. Маловероятно, что какая-либо крупная группа водорослей появилась позже палеозоя или раннего мезозоя (240 млн. лет назад).
ЭКОНОМИЧЕСКИЕ АСПЕКТЫ
Причиняемый вред. Некоторые водоросли наносят экономический ущерб или по крайней мере доставляют большие неприятности. Они загрязняют источники воды, часто придавая ей неприятный вкус и запах. Некоторые массово размножившиеся виды вполне можно идентифицировать по специфическому для них "аромату". К счастью, теперь существуют т.н. альгициды - вещества, эффективно убивающие водоросли и при этом не ухудшающие качества питьевой воды. Для борьбы с водорослями в рыбоводных прудах используют и такие меры, как повышение "проточности" системы, ее затенение и взмучивание. Раки, например, поддерживают мутность воды, достаточную для того, чтобы сильно замедлить рост водорослей. Некоторые водоросли, особенно в периоды своего "цветения", портят места, отведенные для купания. Многие морские макрофиты во время штормов отрываются от субстрата и выбрасываются волнами и ветром на пляж, буквально заваливая его своей гниющей массой. В их плотных скоплениях могут запутываться мальки рыб. Несколько видов водорослей, попадая в организм животных, вызывают отравления, иногда смертельные. Другие оказываются сущим бедствием в теплицах или повреждают листья растений.
Полезность водорослей. У водорослей множество полезных свойств.
Пища для водных животных. Водоросли можно считать первичным источником пищи для всех водных животных. Благодаря присутствию хлорофилла они синтезируют из неорганических веществ органические. Рыбы и другие водные животные потребляют эту органику непосредственно (поедая водоросли) или косвенно (поедая других животных), поэтому водоросли можно считать первым звеном почти всех пищевых цепей в водоемах.
Пища для человека. Во многих странах, особенно на Востоке, люди используют в пищу несколько видов крупных водорослей. Питательная ценность их невелика, однако содержание витаминов и минеральных веществ в такой "зелени" может быть довольно высоким.
Источник агара. Из некоторых моских водорослей получают агар - студенистое вещество, используемое для приготовления желе, мороженого, крема для бритья, салатов, эмульсий, слабительных средств, а также для выращивания микроорганизмов в лабораториях.
Диатомит. Диатомит применяется в составе абразивных порошков и фильтров, а также служит теплоизоляционным материалом, заменяющим асбест.
Удобрение. Водоросли - ценное удобрение, и морские макрофиты с давних времен используются для подкормки растений. Почвенные водоросли могут во многом определять плодородие участка, а развитие на голых камнях лишайников считается первой стадией почвообразовательного процесса.
Водорослевые культуры. Биологи уже давно выращивают водоросли в лабораториях. Сначала их выращивали в маленьких прозрачных чашках с прудовой водой на солнечном свету, а в последнее время применяют для этого особые культуральные среды с определенным количеством минеральных солей и специальных ростовых веществ, а также регулируемые источники искусственного света. Обнаружено, что для оптимального развития некоторых водорослей необходимы весьма специфические условия. Изучение таких лабораторных культур необыкновенно расширило наши знания о росте, питании и размножении этих организмов, а также об их химическом составе. Сейчас в разных странах уже построены опытные установки, представляющие собой своего рода огромные аквариумы. На них в строго контролируемых условиях с использованием сложной аппаратуры проводятся эксперименты для выяснения перспектив использования водорослевых культур. В результате доказано, что продукция сухого вещества водорослей на единицу площади может быть гораздо выше, чем у нынешних сельскохозяйственных растений. Некоторые из использованных видов, например одноклеточная зеленая водоросль хлорелла (Chlorella), дают "урожай", содержащий до 50% пригодного в пищу белка. Не исключено, что будущие поколения людей, особенно в густонаселенных странах, станут использовать искусственно выращенные водоросли.
КЛАССИФИКАЦИЯ ВОДОРОСЛЕЙ
В прошлом водоросли считались примитивными растениями (без специализированных проводящих, или сосудистых, тканей); их выделяли в подотдел водорослей (Algae), который вместе с подотделом грибов (Fungi) составлял отдел талломных (слоевцовых), или низших растений (Thallophyta), - один из четырех отделов царства растений (некоторые авторы вместо термина "отдел" пользуются зоологическим термином "тип"). Далее водоросли разделяли по цвету - на зеленые, красные, бурые и др. Цвет - достаточно прочная, но не единственная основа для общей классификации этих организмов. Более существенны для выделения различных групп водорослей типы формирования их колоний, способы размножения, особенности хлоропластов, клеточной стенки, запасных веществ и т.п. Старые системы обычно признавали около десяти таких групп, считавшихся классами. Одна из современных систем относит к "водорослям" (этот термин утратил классификационное значение) восемь типов (отделов) царства протистов (Protista); впрочем, такой подход признается не всеми учеными.
Зеленые водоросли составляют отдел (тип) Chlorophyta царства протистов. Обычно они цвета зеленой травы (хотя окраска может варьировать от бледно-желтой до почти черной), а фотосинтетические пигменты у них такие же, как у обычных растений. Большинство - микроскопические пресноводные формы. Многие виды растут на почве, образуя на ее влажной поверхности напоминающие войлок налеты. Бывают одно- и многоклеточными, образуют нити, шаровидные колонии, листовидные структуры и т.д. Клетки подвижные (с двумя жгутиками) или неподвижные. Половое размножение - разных уровней сложности в зависимости от вида. Видов описано несколько тысяч. Клетки содержат ядро и несколько четко оформленных хлоропластов. Один из хорошо известных родов - плеврококк (Pleurococcus), одноклеточная водоросль, образующая зеленые налеты, часто наблюдаемые на коре деревьев. Широко распространен род Spirogyra - нитчатые водоросли, образующие длинные волокна тины в ручьях и холодных речках. Весной они плавают в виде липких желтовато-зеленых скоплений на поверхности прудов. Cladophora растет в виде мягких, сильно ветвящихся "кустиков", прикрепляющихся к камням у берегов рек. Basiocladia образует зеленый налет на спине пресноводных черепах. Состоящая из многих клеток водяная сеточка (Hydrodictyon), обитающая в стоячих водах, по строению действительно напоминает "авоську". Десмидиевые - одноклеточные зеленые водоросли, предпочитающие мягкую болотную воду; их клетки отличаются причудливой формой и красиво орнаментированной поверхностью. У некоторых видов клетки соединены в нитчатые колонии. У свободноплавающей колониальной водоросли Scenedesmus серповидные или продолговатые клетки объединены в короткие цепочки. Этот род обычен в аквариумах, где его массовое размножение приводит к появлению в воде зеленого "тумана". Самая крупная зеленая водоросль - морской салат (Ulva), макрофит листовидной формы.
ВОЛЬВОКС - колониальная пресноводная зеленая водоросль. Колония выглядит как полый шар (диаметром не более 3мм), поверхность которого образована клетками, соединенными между собой тяжами протоплазмы. Предполагается, что колониальные формы такого рода - одно из звеньев, связующих одноклеточные и многоклеточные организмы.Внутри родительской колонии формируются дочерние.

ЗОНТИКОВИДНЫЕ ТАЛЛОМЫ зеленой водоросли ацетабулярии средиземноморской. Этот род широко используется в генетических исследованиях.
Красные водоросли (багрянки) составляют отдел (тип) Rhodophyta царства протистов. Большинство из них - морские листовидные, кустистые или корковые макрофиты, обитающие ниже линии отлива. Цвет их преимущественно красный из-за присутствия пигмента фикоэритрина, но может быть пурпурным или синеватым. Некоторые багрянки встречаются в пресной воде, главным образом в ручьях и прозрачных быстрых речках. Batrachospermum - студенистая на ощупь сильно ветвистая водоросль, состоящая из буроватых или красноватых похожих на бусины клеток. Lemanea - щетковидная форма, часто растущая в быстро текущих речках и водопадах, где ее талломы прикрепляются к камням. Audouinella - нитчатая водоросль, встречающаяся в мелких речках. Ирландский мох (Chondrus cripus) - обычный морской макрофит. Багрянки не образуют подвижных клеток. Их половой процесс очень сложен, и один жизненный цикл включает несколько фаз.

ПОЧТИ ВСЕ КРАСНЫЕ ВОДОРОСЛИ растут в морях. Их листоватые, кустистые или корковые жизненные формы окрашены в различные оттенки красного цвета.
Бурые водоросли составляют отдел (тип) Phaeophyta царства протистов. Почти все они - обитатели моря. Лишь немногие виды микроскопические, а среди макрофитов встречаются самые крупные водоросли в мире. К последней группе относятся ламинарии, макроцистисы, фукусы, саргассумы и лессонии ("морские пальмы"), наиболее обильные по побережьям холодных морей. Все бурые водоросли многоклеточные. Цвет их варьирует от зеленовато-желтого до темно-коричневого и обусловлен пигментом фукоксантином. Половое размножение связано с образованием подвижных гамет с двумя боковыми жгутиками. Экземпляры, образующие гаметы, часто совершенно не похожи на организмы того же вида, размножающиеся только спорами.

МОРСКИЕ МАКРОФИТЫ - самые крупные в мире водоросли. Эти многоклеточные организмы больше всех прочих водорослей напоминают зеленые растения: их талломы часто ветвистые, внешне похожие на покрытые листьями стебли. Другая черта, общая у них с растениями, - потребность в солнечном свете для фотосинтеза. Именно поэтому они не могут расти на большой глубине, куда не проникают солнечные лучи. Некоторые виды этих водорослей свободно плавают, другие прикреплены к камням в приливо-отливной зоне или на дне моря. На снимке показаны бурые водоросли.
Диатомовые водоросли (диатомеи) объединяют в класс Bacillariophyceae, который в используемой здесь классификации входит вместе с золотистыми и желто-зелеными водорослями в отдел (тип) Chrysophyta царства протистов. Диатомеи - весьма обширная группа одноклеточных морских и пресноводных видов. Окраска их от желтой до бурой из-за присутствия пигмента фукоксантина. Протопласт диатомей защищен коробчатой кремнеземной (стеклянной) оболочкой - панцирем состоящим из двух створок. Твердая поверхность створок часто покрыта характерным для вида сложным узором из штрихов, бугорков, ямок и гребней. Эти панцири - одни из самых красивых микроскопических объектов, а четкость различения их узора используется иногда для проверки разрешающей силы микроскопа. Обычно створки пронизаны порами или имеют щель, называемую швом. В клетке находится ядро. Помимо деления клеток надвое известно и половое размножение. Многие диатомеи - свободноплавающие формы, но некоторые прикреплены к подводным объектам слизистыми ножками. Иногда клетки объединяются в нити, цепочки или колонии. Различают два типа диатомей: перистые с удлиненными двусторонне-симметричными клетками (они наиболее обильны в пресных водах) и центрические, клетки которых, если смотреть со створки, выглядят округлыми или многоугольными (их больше всего в морях). Как уже упоминалось, панцири этих водорослей сохраняются после смерти клеток и оседают на дно водоемов. С течением времени мощные их скопления уплотняются в пористую горную породу - диатомит.

ДИАТОМЕИ - обширная группа одноклеточных морских и пресноводных водорослей. Клетки некоторых их видов соединяются в прямые или зигзагообразные цепочки. В отличие от других водорослей, диатомеи защищены кремнеземным панцирем из двух створок, одна из которых крупнее другой и накрывает ее, как крышка мыльницу. Створки часто покрыты сложным узором, поэтому под микроскопом многие диатомеи напоминают ювелирные изделия тонкой работы. В зависимости от того, как выглядит их панцирь со стороны створок, эти водоросли делятся на две группы - центрические и перистые. У первых - радиальная симметрия, у вторых - клетки продолговатые и симметрия двусторонняя (иногда они несколько асимметричны). На микрофотографии показаны центрические диатомеи.
Жгутиковые. Эти организмы в связи с их способностью к "животному" питанию и рядом других важных признаков сейчас нередко относят к подцарству простейших (Protozoa) царства протистов, однако их можно рассматривать и в качестве не входящего в Protozoa отдела (типа) Euglenophyta того же царства. Все жгутиковые одноклеточные и подвижные. Клетки - зеленые, красные или бесцветные. Некоторые виды способны к фотосинтезу, тогда как другие (сапрофиты) поглощают растворенную органику или даже заглатывают твердые ее частицы. Половое размножение известно лишь у некоторых видов. Обычный обитатель прудов - Euglena, зеленого цвета водоросль с красным "глазком". Она плавает с помощью единственного жгутика, способна как к фотосинтезу, так и к питанию готовой органикой. В конце лета Euglena sanguinea может окрашивать прудовую воду в красный цвет.
Динофлагеллаты. Эти одноклеточные жгутиковые организмы тоже часто причисляют к простейшим, но их можно выделять и в самостоятельный отдел (тип) Pyrrophyta царства протистов. Они в основном желто-бурые, но бывают и бесцветными. Клетки их обычно подвижны; клеточная стенка у некоторых видов отсутствует, а иногда бывает весьма причудливой формы. Половое размножение известно лишь у немногих видов. Морской род Gonyaulax - одна из причин "красных приливов": у побережий он бывает настолько обилен, что вода приобретает несвойственный ей цвет. Эта водоросль выделяет токсичные вещества, иногда приводящие к гибели рыбы и моллюсков. Некоторые динофлагеллаты вызывают фосфоресценцию воды в тропических морях.
Золотистые водоросли входят наряду с другими в отдел (тип) Chrysophyta царства протистов. Цвет их желто-бурый, а клетки бывают подвижными (жгутиковыми) или неподвижными. Размножение бесполое с образованием пропитанных кремнеземом цист.
Желто-зеленые водоросли сейчас принято объединять с золотистыми в отдел (тип) Chrysophyta, но можно считать их и самостоятельным отделом (типом) Xanthophyta царства протистов. По форме они сходны с зелеными водорослями, но отличаются преобладанием специфических желтых пигментов. Их клеточные стенки иногда состоят из двух входящих одна в другую половинок, причем у нитчатых видов эти створки в продольном сечении Н-образные. Половое размножение известно лишь у немногих форм.
Харовые (лучицы) - многоклеточные водоросли, составляющие отдел (тип) Charophyta царства протистов. Окраска их варьирует от серовато-зеленой до серой. Клеточные стенки часто инкрустированы карбонатом кальция, поэтому отмершие остатки харовых участвуют в образовании отложений мергеля. У этих водорослей есть цилиндрическая, напоминающая стебель главная ось, от которой мутовками отходят боковые отростки, похожие на листья растений. Растут харовые вертикально на мелководье, достигая в высоту 2,5-10 см. Размножение половое. Харовые вряд ли близки к какой-либо из перечисленных выше групп, хотя некоторые ботаники считают, что они произошли от зеленых водорослей. См. также СИСТЕМАТИКА РАСТЕНИЙ.

Подводный пейзаж. Залив Монтеррей, Калифорния.
ВОДОРОСЛИ, группа низших водных растений, обычно содержащих хлорофилл и вырабатывающих органические вещества в процессе фотосинтеза. Тело водорослей (таллом, слоевище) не имеет настоящих корней, стеблей и листьев. Их размеры колеблются у различных видов от долей микрона до 60 м. Неклеточные, одноклеточные, многоклеточные, колониальные, свободноплавающие и прикрепленные организмы. Размножение бесполое, вегетативное и половое. Отделы (или типы) водорослей: зеленые, бурые, красные, золотистые, желто-зеленые, диатомовые и другие. Около 30 тыс. видов. Сине-зеленые водоросли чаще рассматривают как цианобактерии. Водоросли - основные продуценты органического вещества в пресных водоемах и морях. Входят в состав планктона и бентоса. Некоторые съедобны (например, ламинария, порфира), другие - сырье для получения кормовой массы, агара, каррагена, йода и других (многие из них - объект аквакультуры). Ряд водорослей (хлорелла и другие) испытывают как компоненты биокомплексов, входящих в систему жизнеобеспечения космических кораблей. Некоторые одноклеточные водоросли в симбиозе с грибами образуют лишайники.

Кораллы и сине-зелёные водоросли.

Подводный лес.
сущ., кол-во синонимов: 10
альгофлора (1)
араме (1)
зеленая смерть (1)
луг нептуна (2)
морское сено (1)
морской огород (2)
огород нептуна (2)
подводный огород (2)
саргассы (1)
хиджики (1)
водоросли не имеют тканей и органов; у них впервые возник фотосинтез.
одноклеточные водоросли.
хлорелла. хламиномонада. диатомеи. перидинеи. каулерпа.
эвгленовые.
жгутиковые: эвглена.
бурые водоросли.
ламинария, морская капуста. хризомонады. фукус. саргассовые водоросли.
красные водоросли.
филлофора. анфельция. карраген. литотамнии.
зеленые водоросли.
спирогира. гонидии. хары. трохилиски. вольвокс.
тина. тинистый (# дно).
нитчатка. | апланоспоры.
ВО́ДОРОСЛЬ, -и, жен. Низшее водяное растение, у к-рого отсутствует расчленение на корень, стебель и листья. Пруд зарос водорослями.
| прил. водорослевый, -ая, -ое.
ВО́ДОРОСЛЬ, -и, мн род. -ей,ж, обычно мн
Низшие водные растения, отличающиеся от других водных растений отсутствием расчленения на корень, стебель и листья, а также вообще название водных растений.
Все дно было покрыто водорослями.
- Низшее водяное растение.
- «Кустик» на дне аквариума.
- Какое растение живёт на дне морском?
- Составляющая болотной тины.
- Объект изучения фикологии.