м.
Химический элемент, серебристо-белый редкоземельный металл.
ЛЮТЕ́ЦИЙ -я; м. Химический элемент (Lu) группы редкоземельных металлов (используется в ядерной, лазерной технике и т.п.). ● От названия города Лутеция в Галлии на реке Сене (Lutetia), на месте которого расположен Париж.
* * *
люте́ций (лат. Lutetium), химический элемент III группы периодической системы, относится к лантаноидам. Название от Лютеции. Серебристо-белый металл. Плотность 9,849 г/см3, tпл 1660°C.
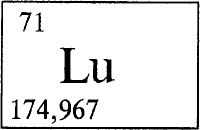
* * *
ЛЮТЕЦИЙ - ЛЮТЕ́ЦИЙ (лат. Lutetium, от галльского названия Парижа - Lutetia, Лютеция), Lu (читается «лютеций»), химический элемент с атомным номером 71, атомная масса 174,967. Природный лютеций представляет собой смесь стабильного 175Lu (97,40% по массе) и слабо радиоактивного 176Lu (2,6%, период полураспада Т1/2 = 2,4.1010 лет). Конфигурация трех внешних электронных слоев 4s2p6d10f14 5s2p6d16s2. Образует соединения в степени окисления +3 (валентность III).
Лантаноид. Расположен в группе IIIB периодической системы, в шестом периоде. Радиус нейтрального атома лютеция 0,174 нм, радиус иона Lu3+0,100-0,117 нм. Энергии последовательной ионизации атома лютеция 6,254, 12,17, 25,5, 43,7 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,14.
История открытия
Открыт в 1907 французским химиком Ж. Урбеном (см. УРБЕН Жорж), который обнаружил и выделил его из открытого в 1878 Ж. Мариньяком иттербия. (см. ИТТЕРБИЙ)
Нахождение в природе
Содержание в земной коре 8·10-5% по массе. Входит в состав таких минералов, как ксенотим (см. КСЕНОТИМ), бастнезит (см. БАСТНЕЗИТ), фергусонит (см. ФЕРГУСОНИТ), эвксенит.
Получение
При переработке смеси редкоземельных элементов, выделенной из минералов, лютеций выделяется с фракцией тяжелых редкоземельных элементов. Отделяют лютеций от других редкоземельных элементов методами ионной хроматографии или экстракции. Металлический лютеций получают восстановлением LuF3 кальцием.
Физические и химические свойства
Лютеций серебристо-серый металл. Имеет гексагональную решетку с параметрами а = 0,35031 нм и с =.0,55509 нм. Температура плавления 1660°C, температура кипения 3410°C, плотность 9,849 кг/дм3. На воздухе покрывается плотной устойчивой оксидной пленкой. При 400°C лютеций реагирует с кислородом, галогенами, серой и другими неметаллами. Реагирует с минеральными кислотами.
Оксид Lu2О3 обладает слабоосновными свойствами. Основание Lu(ОН)3 - слабое, поэтому в водных растворах ионы Lu3+ в значительной степени гидролизованы. К растворимым солям лютеция относятся хлорид, нитрат, ацетат и сульфат. Оксалат, фторид, карбонат и фосфат лютеция - плохо растворимы.
Применение
Оксид лютеция используется как добавка к высокотемпературным керамикам. Фторид лютеция используют для получения фторидных лазерных материалов.
ЛЮТЕЦИЙ (лат. Lutetium) - Lu, химический элемент III группы периодической системы, атомный номер 71, атомная масса 174,967, относится к лантаноидам. Название от Лютеции. Серебристо-белый металл. Плотность 9,849 г/см³, tпл 1660 .С.
ЛЮТЕЦИЙ (Lutetium), Lu, химический элемент III группы периодической системы, атомный номер 71, атомная масса 174,967; относится к редкоземельным элементам; металл. Открыт французским химиком Ж. Урбеном в 1907.
люте́ций
(по лат. назв. Парижа - lutecia) хим. элемент из семейства лантаноидов, символ Lu (лат. lutecium), металл.
- Редкоземельный металл.
- Название этого химического элемента произошло от галльского названия Парижа.
- Один из редкоземельных элементов был так назван в честь знаменитой европейской столицы.
- Химический элемент, Lu.