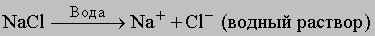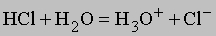ЭЛЕКТРОЛИТЫ - вещества, обладающие ионной проводимостью; их называют проводниками второго рода - прохождение тока через них сопровождается переносом вещества. К электролитам относятся расплавы солей, оксидов или гидроксидов, а также (что встречается значительно чаще) растворы солей, кислот или оснований в полярных растворителях, например в воде. Известны и твердые электролиты. Чтобы пропустить электрический ток через раствор электролита, в него опускают две металлические или угольные пластины - электроды - и соединяют их с полюсами источника постоянного тока. Положительный электрод называют анодом, отрицательный - катодом. Прохождение тока через электролит сопровождается химическими реакциями на электродах. Так, на катоде, погруженном в расплав соли или оксида либо в раствор соли, обычно осаждается металл, входящий в состав электролита. На катоде, погруженном в водный раствор кислоты, основания либо соли щелочного или щелочноземельного металла, выделяется газообразный водород. На аноде, изготовленном из инертного материала, например платины или угля, в водном растворе выделяется газообразный кислород, а в концентрированных водных растворах хлоридов или в расплавленных хлоридах - хлор. Цинковые, медные или кадмиевые аноды под действием электрического тока сами постепенно растворяются; газ в этом случае не образуется.
ЭЛЕКТРОЛИЗ
Законы Фарадея. Электролизом называют химические процессы, протекающие под действием электрического тока на электродах, погруженных в электролит. Количество образовавшегося вещества связано с количеством электричества, пропущенного через электролит (сила тока ґ время), законами Фарадея: 1) количество вещества, образовавшегося на электроде при пропускании через электролит постоянного электрического тока, прямо пропорционально количеству пропущенного электричества, т.е. силе тока и времени электролиза; 2) для разных электродных процессов при одинаковом количестве электричества, пропущенного через электролит, массы образовавшихся веществ пропорциональны их химическим эквивалентам. (Эквивалентом элемента называется такое его количество, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях, а эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с 1 экв. водорода или любого другого вещества.
См. ЭКВИВАЛЕНТНАЯ МАССА.) Законы Фарадея справедливы как для растворов, так и для расплавов и применимы к обоим электродам. Количество электричества, необходимое для образования 1 экв. любого вещества, одинаково для всех веществ; оно равно 96 485 Кл и называется числом Фарадея или постоянной Фарадея (фундаментальная физическая константа). Эта закономерность широко применяется на практике. Исходя из количества затраченного электричества, можно рассчитать массу или толщину металлического покрытия, образующегося при гальваностегии, и наоборот, задав толщину покрытия, можно оценить, какое количество электричества для этого потребуется. Законы Фарадея лежат в основе работы вольтметра и приборов, предназначенных для измерения силы постоянного тока.
См. также
Ионы. В 1833 М.Фарадей предположил, что ток через электролит переносят электрически заряженные частицы - ионы. Положительно заряженные ионы (например, ионы металлов и водорода), движущиеся через электролит по направлению к катоду, были названы катионами, а отрицательно заряженные, перемещающиеся к аноду, - анионами. Предполагалось, что на электродах ионы теряют заряд, при этом на катоде из катионов образуются атомы металла или водорода, а на аноде из анионов - галогены или кислород. Эти представления - с незначительными изменениями - считаются справедливыми и сегодня. Положительным ионом (катионом) называют атом или группу атомов, утративших один или несколько электронов, а отрицательным ионом (анионом) - атом или группу атомов с одним или более избыточным электроном. На катоде катионы электролита приобретают недостающие электроны и нейтрализуют свой положительный заряд. Аналогично анионы отдают избыточные электроны, достигая анода. Если материал анода реакционноспособен, он может сам служить источником электронов, поскольку его атомы отдают электроны легче, чем анионы. Образующиеся катионы переходят при этом в раствор. Поскольку для осаждения или нейтрализации 1 экв. любого вещества требуется одно и то же количество электричества, очевидно, что заряд, переносимый ионами, содержащимися в 1 экв., одинаков для всех веществ. Число эквивалентов в одном моле ионов равно валентности иона, поэтому число единичных зарядов (электронов), переносимых ионом, можно отождествить с его валентностью. Таким образом, у одновалентного катиона (например, Na+, K+, Ag+) недостает одного электрона по сравнению с нейтральным атомом; этот катион переносит единичный положительный заряд. У двухвалентного катиона (например, Ca2+, Zn2+, Cu2+) недостает двух электронов, он переносит два единичных положительных заряда и т.д. Единичный отрицательный заряд одновалентного аниона (Cl-, Br-) создается одним избыточным по отношению к нейтральному атому электроном.
ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТОВ
Теория Аррениуса. Предположив, что электрический ток в электролитах переносят ионы, Фарадей ничего не сказал об их происхождении. Некоторые соображения по этому поводу были высказаны немецким физиком Р.Клаузиусом в 1857, а первое наиболее полное описание процесса образования ионов принадлежит шведскому физикохимику С.Аррениусу (1883-1897). Аррениус предположил, что соли, кислоты и основания при растворении в подходящем растворителе (например, в воде) распадаются (диссоциируют) на ионы. Например, хлорид натрия NaCl диссоциирует на ионы натрия Na+ и хлора Cl-. Электрический ток в самом процессе диссоциации никак не участвует, он лишь направляет ионы к соответствующим электродам. Теория электролитической диссоциации не только объясняет образование ионов в растворе, но и проливает свет на многие ранее непонятные явления. Так, в 1887 нидерландский физикохимик Я.Вант-Гофф обнаружил, что температура замерзания растворов электролитов значительно ниже, а температура кипения намного выше, чем рассчитанные исходя из их молекулярных масс (см. также РАСТВОРЫ). Природа этих отклонений становится ясной, если учесть, что свойства разбавленных растворов зависят не от природы растворенных частиц, а от их числа. При диссоциации из одной молекулы электролита образуются два и более иона, а число частиц в растворе становится гораздо больше, чем в случаях, когда электролитическая диссоциация по каким-то причинам не происходит.
Константа диссоциации. Согласно Аррениусу, степень диссоциации, т.е. доля молекул, распавшихся на ионы, возрастает по мере разбавления раствора. Предположив, что скорости перемещения ионов через электролит не зависят от концентрации раствора, и измерив электропроводность, Аррениус рассчитал степень диссоциации нескольких электролитов при разных концентрациях. В.Оствальд в 1888 использовал этот метод для расчета концентрации свободных ионов и недиссоциированных молекул в растворе, а отсюда - константы равновесия (константы диссоциации) реакции диссоциации. Обратимая диссоциация электролита CA на ионы C+ и A- описывается уравнением CA C+ + A-, а константа диссоциации равна
K = [[C+]][[A-]]/[[CA]]
(величины в квадратных скобках - концентрации). Последнее соотношение удовлетворительно описывает поведение только растворов слабых электролитов - слабых кислот и оснований. Сильные электролиты, т.е. водные растворы сильных кислот, оснований и большинства солей, ведут себя иначе; оказалось, что фундаментальный постулат Аррениуса о постоянстве скоростей перемещения ионов и независимости их от концентрации неприменим к сильным электролитам.
ТЕОРИЯ МЕЖИОННОГО ВЗАИМОДЕЙСТВИЯ
Согласно современным представлениям, основанным на теории валентности и данных по рентгеноструктурному анализу кристаллов, большинство солей ионизировано уже в твердом состоянии; при этом положительные и отрицательные ионы удерживаются вместе электростатическими силами. Когда соль растворяется (например, в воде), ионы притягивают к себе молекулы растворителя - сольватируются (или гидратируются, если растворитель - вода). Выделяющейся в процессе сольватации энергии достаточно для преодоления электростатических сил притяжения ионов, так что ионы в растворе отделяются друг от друга, т.е. происходит электролитическая диссоциация. Сильные электролиты, в частности галогениды и нитраты щелочных и щелочноземельных металлов, полностью ионизированы в растворе при всех приемлемых концентрациях. Противоположно заряженные ионы в растворе притягиваются друг к другу, причем степень притяжения возрастает с увеличением концентрации, поскольку расстояние между ионами уменьшается. Диссоциация, особенно при высоких концентрациях, никогда не бывает полной. Здесь нужно остановиться на различии между диссоциацией и ионизацией. Сильные электролиты (например, соль) в растворе полностью ионизированы фактически при всех концентрациях, но степень их диссоциации зависит от концентрации и становится достаточно высокой только в очень разбавленных растворах. Слабые электролиты, напротив, ионизированы лишь частично, и степень ионизации у них очень мало отличается от степени диссоциации; это и подтверждают измерения электропроводности.
Теория Дебая - Хюккеля. Описанные выше представления составляют основу теории межионного взаимодействия электролитов. Вкратце суть ее состоит в следующем: электростатическое притяжение между ионами существует во всех электролитах, но в слабых электролитах, где число ионов относительно мало и поэтому они находятся далеко друг от друга, оно несущественно. Таким образом, концепция межионного взаимодействия относится главным образом к сильным электролитам. В количественном виде эту концепцию представили П.Дебай и Э.Хюккель в 1923, и она называется теорией Дебая - Хюккеля. Основная ее идея состоит в том, что вследствие электростатического притяжения между положительными и отрицательными ионами вблизи каждого иона находятся главным образом ионы противоположного знака, т.е. ион как бы окружен ионной атмосферой. Суммарный заряд этой атмосферы по абсолютной величине равен заряду центрального иона, но противоположен ему по знаку. Тормозящее действие ионной атмосферы на передвижение ионов проявляется таким образом, что все свойства, зависящие от концентрации ионов (такие, как электрическая проводимость, осмотическое давление и т.д.), отвечают заниженной степени диссоциации - кажущейся степени диссоциации. Для оценки состояния ионов в растворе пользуются понятием активности иона - его условной концентрации, соответственно которой он действует при химических реакциях: a = fC, где a - активность иона, C - его концентрация, f - коэффициент активности. Значение f < 1 указывает на связывающее взаимодействие ионов; если f близок к единице, это говорит о слабом межионном взаимодействии. В очень разбавленных растворах действие межионных сил почти не проявляется. Применяя различные математические методы для описания свойств ионной атмосферы, во многом удалось объяснить поведение разбавленных растворов сильных электролитов. Поведение же их концентрированных растворов требует дальнейших исследований.
ЛИТЕРАТУРА
Робинсон Р., Стокс Р. Растворы электролитов. М., 1963 Измайлов А.А. Электрохимия растворов. М., 1976