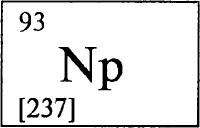
Непту́ний (лат. Neptunium), химический элемент III группы периодической системы, относится к актиноидам. Радиоактивен, наиболее устойчивый изотоп 237Np (период полураспада 2,14·106 лет). Название - от планеты Нептун. Серебристо-белый металл; плотность 20,45 г/см3, tпл 639°C. Получен искусственно (в природе обнаружен в ничтожных количествах).
* * *
НЕПТУНИЙ - НЕПТУ́НИЙ (лат. Neptunium, от названия планеты Нептун), Np (читается «нептуний»), радиоактивный искусственно полученный химический элемент с атомным номером 93. Актиноид. Расположен в IIIB группе периодической системы, в 7-м периоде. Электронная конфигурация трех внешних слоев невозбужденного атома нептуния 5s2p6d10f46s2p6d17s2. В соединениях проявляет степени окисления +3 , +4, +5 (наиболее характерна), +6 и +7, валентности III, IV, V, VI и VII.
Радиус нейтрального атома 0,155 нм, Np3+ 0,0986 нм, Np 4+ 0,0913 нм, Np 5+ 0,087 нм, Np 6+0,082 нм. Энергия ионизации нейтрального атома 6,16 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,22.
Впервые получен в 1940 американскими исследователямиЭ. М. Макмилланом (см. МАКМИЛЛАН Эдвин Маттисон) и Ф. Х. Эйблсоном облучением нейтронами238U. Сначала протекает ядерная реакция 238U(n,)239U. Образующийся 239U быстро (период полураспада Т1/2 23 мин) превращается в 239Np (b-радиоактивен, Т1/2 2,3 суток). Известно более 15 изотопов нептуния с массовыми числами 227-241. Наиболее устойчив 237Np (a-распад, Т1/2 = 2,14·106 лет).
В ничтожных количествах присутствует в урановых рудах. К образованию в них нептуния приводит реакция ядер 238U с нейтронами космического излучения и нейтронами, возникающими при спонтанном делении ядер урана и других тяжелых элементов.
Природные источники нептуния никакого практического значения не имеют. В настоящее время нептуний извлекают из продуктов длительного облучения урана в ядерных реакторах как побочный продукт при извлечении плутония. При отделении нептуния от урана и плутония используют различия в устойчивости степеней окисления +4, +5 и +6 для плутония (наиболее устойчив в растворе в степени окисления +4), нептуния (наиболее устойчив в растворе в степени окисления +5) и урана (наиболее устойчив в растворе в степени окисления +6). Мировое производство нептуния достигает сотен килограммов в год. Для получения металлического нептуния обычно тетрафторид нептуния NpF4 обрабатывают при температуре выше 700°C парами бария или кальция.
Физические и химические свойства
Нептуний - хрупкий серебристо-белый металл. Существует в трех полиморфных модификациях. Ниже 280°C устойчива a-модификация с орторомбической решеткой, параметры а = 0,472нм, в = 0,488 нм и с = 0,666 нм, плотность 20,45 кг/дм3. От 280°C до 576°C устойчива b-модификация с тетрагональной решеткой (параметры а = 0,489 нм, с = 0,338 нм). Выше 576°C и до температуры плавления, 639°C устойчива модификация с кубической гранецентрированной решеткой (а = 0,343 нм). Температура кипения 4082°C.
Нептуний реакционноспособен. Растворяется в соляной кислоте с образованием солей Np3+ (в инертной среде) и солей Np4+ (на воздухе). При прокаливании соединений нептуния, способных к термолизу, образуется оксид NpО2. Этот оксид образуется при прокаливании нептуния при 800-1000°C. Известны оксиды нептуния NpО, Np3О8 и Np2О5.
Оксиды нептуния при сплавлении с оксидами активных металлов образуют нептунаты, где нептуний входит в состав аниона.
Взаимодействием NpО2 c HF, CCl4, AlBr3 или АlI3 в присутствии восстановителей получены тригалогениды нептуния NpHal3:
3NpO2 + 3AlBr3 + Al = 3NpBr3 + 2Al2O3
Взаимодействием NpО2 c HF, CCl4 или AlBr3 при 300-500°C получены NpF4, NpCl4 и NpBr4. Взаимодействуя со фтором, NpF4 при 250°C образует NpF6.
Синтезированы оксигалогениды нептуния NpOX2 (X = F, Cl или Br) и оксигалогениды, содержащие нептуний в степенях окисления выше +4. Получены гидриды нептуния переменного состава и тригидрид NpH3, сульфиды нептуния Np2S3 и NpS3, нитрид нептуния NpN, карбид нептуния NpC2.
Стандартный окислительный потенциал пары Np(IV)/Np(III) 0,155 B, пары Np(V)/Np(IV) 0,739 B, пары Np(VI)/Np(V) 1,137 B, пары Np(VII)/Np(VI) 2,04 B, пары Np(V)/Np(III) 0,477 B, пары Np(VI)/Np(III) 0,677 B, пары Np(VI)/Np(IV) 0,938 B. В растворе ионы Np3+ имеют фиолетово-голубую окраску, ионы Np4+ - желто-зеленую, ионы NpO2+(нептуноил-ионы) - зелено-голубую, ионы NpO22+( нептунил-ионы)- розовую и ионы NpO23+ - зеленую в щелочной среде и коричневую в растворе хлорной кислоты НСlО4.В растворах наиболее устойчивы соединения нептуния в степени окисления +5. Склонен к диспропорционированию, гидролизу и комплексообразованию. Например, самая устойчивая в растворах форма нептуния, NpO2+ стабильна в растворах разбавленных кислот. При высокой кислотности наблюдается ее диспропорционирование:
2NpO2+ + 4H+ Np4+ + NpO22+ +2H2O
Гидролиз ионов Np3+ и Np4+ происходит ступенчато и связан с образованием полимерных форм типа [Np(OH)2]xx(n-2)+ и [Np(OH)3]xx(n-3)+.
Для получения в растворе соединений Np (VII), на соединения Np(VI) в щелочных растворах действуют сильными окислителями (озон, гипохлорит, гипобромит). В кислой среде соединения Np (VII) неустойчив и переходит в соединения Np (VI).
Нептуний и его соединения высокотоксичны. Для 237Np ПДК в воздухе рабочих помещений 2,6·10-3 Бк/м3.