АЦИ см. ачи
ацид
ацидемия
ацидиметрия
Энциклопедический словарь
Ацидиме́трия - см. Алкалиметрия и ацидиметрия.
* * *
АЦИДИМЕТРИЯ - АЦИДИМЕ́ТРИЯ, см. Алкалиметрия и ацидиметрия (см. АЛКАЛИМЕТРИЯ И АЦИДИМЕТРИЯ).
Большой энциклопедический словарь
АЦИДИМЕТРИЯ - см. Алкалиметрия и ацидиметрия.
Слитно. Раздельно. Через дефис
Орфографический словарь
Словарь ударений
Словарь галлицизмов русского языка
АЦИДИМЕТРИЯ и, ж. acidimétrie f. В 1805-1806 гг. тот же автор <Франсуа Антуан Анри Декруазиль (1751-1825) разработал объемные способы определения кислот и щелочей) алкалиметрию и ацидиметрию. Джуа 221.
Словарь иностранных слов
Сканворды для слова ацидиметрия
- Способ объёмного химического анализа, применяемый для количественного определения щелочи в испытуемом растворе путём добавления к нему раствора кислоты.
Полезные сервисы
ацидобутирометр
ацидоз
Энциклопедический словарь
Ацидо́з (от лат. acidus - кислый), сдвиг кислотно-щелочного равновесия в организме в сторону относительного увеличения количества анионов кислот.
* * *
АЦИДОЗ - АЦИДО́З (от лат. acidus - кислый), сдвиг кислотно-щелочного равновесия в организме в сторону относительного увеличения количества анионов кислот.
Большой энциклопедический словарь
АЦИДОЗ (от лат. acidus - кислый) - сдвиг кислотно-щелочного равновесия в организме в сторону относительного увеличения количества анионов кислот.
Орфографический словарь
Словарь ударений
Формы слов для слова ацидоз
ацидо́з, ацидо́зы, ацидо́за, ацидо́зов, ацидо́зу, ацидо́зам, ацидо́зом, ацидо́зами, ацидо́зе, ацидо́зах
Синонимы к слову ацидоз
Грамматический словарь
Новый словарь иностранных слов
ацидо́з
(лат. acidus кислый) накопление в крови и других тканях организма отрицательно заряженных частиц (анионов) кислот ср. алкалоз).
Сканворды для слова ацидоз
- Сдвиг кислотно-щелочного равновесия в организме в сторону относительного увеличения количества анионов кислот.
Полезные сервисы
ацидофилин
Толковый словарь
Энциклопедический словарь
АЦИДОФИЛИ́Н -а; м. [от лат. acidus - кислый и греч. phileō - люблю]. Кисломолочный напиток, приготовляемый сквашиванием молока при помощи особых бактерий.
* * *
ацидофили́н - кисломолочный напиток, получаемый сквашиванием молока ацидофильными организмами (бактериями).
* * *
АЦИДОФИЛИН - АЦИДОФИЛИ́Н, кисломолочный напиток, получаемый сквашиванием молока ацидофильными организмами (бактериями).
Большой энциклопедический словарь
АЦИДОФИЛИН - кисломолочный напиток, получаемый сквашиванием молока ацидофильными организмами (бактериями).
Академический словарь
-а, м.
Молоко, сквашенное при помощи особых бактерий.
[От лат. acidus - кислый и греч. φιλέω - люблю]
Орфографический словарь
Словарь ударений
Формы слов для слова ацидофилин
ацидофили́н, ацидофили́ны, ацидофили́на, ацидофили́нов, ацидофили́ну, ацидофили́нам, ацидофили́ном, ацидофили́нами, ацидофили́не, ацидофили́нах
Синонимы к слову ацидофилин
Морфемно-орфографический словарь
Грамматический словарь
Этимология
Мы произносим слова, не задумываясь над тем, откуда и как они появились. Знакомое с детства слово ацидофилин образовалось путем сложения двух элементов, принадлежащих разным языкам; acidus на латинском языке означает "кислый", a fileo по-гречески означает любить. "Ацидофильные", любящие кислоту - так назвали бактерии, с помощью которых получают этот питательный продукт.
Этимологический словарь
Искон. Неологизм Советской эпохи. Суф. производное (суф. -ин) от лат. acidophilum (bacterium) «ацидофильная (палочка)», сложения лат. acidus «кислый» и греч. phileō «люблю».
Новый словарь иностранных слов
ацидофили́н
(лат. acidus кислый гр. phileo люблю) диетический продукт - молоко, заквашенное особыми (ацидофильныйв) бактериями.
Сканворды для слова ацидофилин
Полезные сервисы
ацидофилия
Орфографический словарь
Словарь ударений
Формы слов для слова ацидофилия
ацидофили́я, ацидофили́и, ацидофили́й, ацидофили́ям, ацидофили́ю, ацидофили́ей, ацидофили́ею, ацидофили́ями, ацидофили́ях
Синонимы к слову ацидофилия
Морфемно-орфографический словарь
Грамматический словарь
Новый словарь иностранных слов
ацидофили́я
(лат. acidus квелый + ...филия) способность клеток и тканей животного или растения окрашиваться кислыми красителями, что обусловлено щелочными свойствами окрашивающихся структур ср. базофилия).
Сканворды для слова ацидофилия
Полезные сервисы
ацидофильные организмы
Энциклопедический словарь
Ацидофи́льные органи́змы (от лат. acidus - кислый и греч. philéō - люблю), способны существовать в условиях значительной кислотности среды. Например, уксуснокислые и молочнокислые бактерии, из высших растений - сфагнум, вереск, люпин и др.
* * *
АЦИДОФИЛЬНЫЕ ОРГАНИЗМЫ - АЦИДОФИ́ЛЬНЫЕ ОРГАНИ́ЗМЫ (от лат. acidus - кислый и греч. phileó - люблю), способны существовать в условиях значительной кислотности среды. Напр., уксуснокислые и молочнокислые бактерии, из высших растений - сфагнум (см. СФАГНУМ), вереск (см. ВЕРЕСК), люпин (см. ЛЮПИН) и др.
Большой энциклопедический словарь
АЦИДОФИЛЬНЫЕ ОРГАНИЗМЫ (от лат. acidus - кислый и греч. phileo - люблю) - способны существовать в условиях значительной кислотности среды. Напр., уксуснокислые и молочнокислые бактерии, из высших растений - сфагнум, вереск, люпин и др.
Полезные сервисы
ацидофильный
Энциклопедический словарь
АЦИДОФИ́ЛЬНЫЙ -ая, -ое.
◊ Ацидофи́льные организмы. Организмы, способные существовать в среде с высокой кислотностью (уксуснокислые и молочнокислые бактерии, некоторые растения: сфагнум, вереск, люпин и т.п.). А-ое молоко (проф.; = ацидофили́н).
Орфографический словарь
Формы слов для слова ацидофильный
ацидофи́льный, ацидофи́льная, ацидофи́льное, ацидофи́льные, ацидофи́льного, ацидофи́льной, ацидофи́льных, ацидофи́льному, ацидофи́льным, ацидофи́льную, ацидофи́льною, ацидофи́льными, ацидофи́льном, ацидофи́лен, ацидофи́льна, ацидофи́льно, ацидофи́льны, ацидофи́льнее, поацидофи́льнее, ацидофи́льней, поацидофи́льней
Морфемно-орфографический словарь
Грамматический словарь
Словарь иностранных слов
ацидофильный
- ая, ое, лен, льна (< лат. acidus кислый + греч. phileō люблю).
биол. В сочетании: ацидофильные организмы - организмы, способные существовать в условиях кислой среды.
Ацидофильность - свойство ацидофильного.
|| Ср. ацидофобный.
Полезные сервисы
ацидофобные организмы
Энциклопедический словарь
Ацидофо́бные органи́змы (от лат. acidus - кислый и греч. phóbos - страх), не переносят значительной кислотности и развиваются только в нейтральной или щелочной среде. Например, уробактерии, из высших растений - свёкла, люцерна, фасоль.
* * *
АЦИДОФОБНЫЕ ОРГАНИЗМЫ - АЦИДОФО́БНЫЕ ОРГАНИ́ЗМЫ (от лат. acidus - кислый и греч. phobos - страх), не переносят значительной кислотности и развиваются только в нейтральной или щелочной среде. Напр., уробактерии (см. УРОБАКТЕРИИ), из высших растений - свекла, люцерна, фасоль.
Большой энциклопедический словарь
АЦИДОФОБНЫЕ ОРГАНИЗМЫ (от лат. acidus - кислый и греч. phobos - страх) - не переносят значительной кислотности и развиваются только в нейтральной или щелочной среде. Напр., уробактерии, из высших растений - свекла, люцерна, фасоль.
Полезные сервисы
ацидофобный
Слитно. Раздельно. Через дефис
Орфографический словарь
Морфемно-орфографический словарь
Словарь иностранных слов
ацидофобный
- ая, ое, бен, бна (< лат. acidus кислый + греч. phobos страх).
биол. В сочетании: ацидофобные организмы - организмы, которые не переносят значительной кислотности среды и развиваются лишь в нейтральной или щелочной среде.
Ацидофобность - свойство ацидофобного.
|| Ср. ацидофильный.
Полезные сервисы
ациклические соединения
Энциклопедический словарь
Ацикли́ческие соедине́ния - то же, что алифатические соединения.
* * *
АЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ - АЦИКЛИ́ЧЕСКИЕ СОЕДИНЕ́НИЯ, то же, что алифатические соединения (см. АЛИФАТИЧЕСКИЕ СОЕДИНЕНИЯ).
Большой энциклопедический словарь
АЦИКЛИЧЕСКИЕ соединения - то же, что алифатические соединения.
Энциклопедия Кольера
А. МОНОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ
1. С1-: металлоорганические соединения. Эти соединения обычно получают двумя методами: а) действием активного металла (Na, Li, Mg, Zn) на органический галогенид, например:
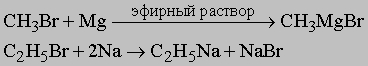
или б) действием галогенида менее активного металла на металлоорганическое соединение более активного металла, например:
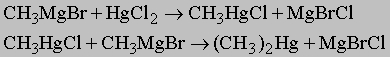
Металлоорганические соединения обычно называют, ставя на первое место название радикала и прибавляя к нему название металла (или соли металла), к которому присоединен радикал, например, метилнатрий CH3Na; диэтилцинк (C2H5)2Zn; этилртутьхлорид C2H5HgCl. Вообще говоря, реакционная способность этих соединений возрастает с ростом активности металла; так, реакции алкилпроизводных цинка или ртути протекают медленнее, чем реакции алкилпроизводных магния или натрия. Алкилпроизводные щелочных металлов (Li, Na, K) можно приготовить взаимодействием свободного металла с алкилгалогенидами или с диалкилртутью:
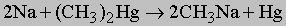
Метод (а) (см. выше) можно использовать для натрия и калия только в таком инертном растворителе, как пентан. Тонко раздробленный металл должен присутствовать в большом избытке, а реакционную смесь необходимо очень сильно перемешивать, в противном случае реакция
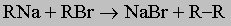
разрушает металлалкил по мере его образования. Для синтетической органической химии очень ценны алкилмагнийгалогениды RMgX (реактивы Гриньяра). Обычно их готовят непосредственным действием магния на соответствующий органический бромид (или иодид) в эфирном растворе, как сказано выше. Из них можно приготовить:
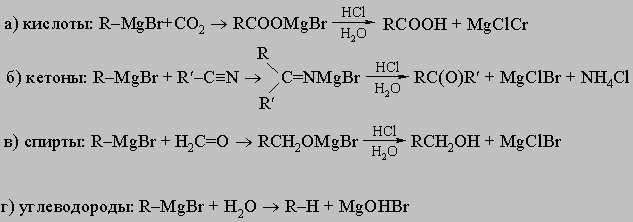
Реакции литийорганических соединений RLi очень похожи на реакции реактивов Гриньяра. Действием реактивов Гриньяра на соответствующие галогениды цинка, кадмия или ртути можно получить как моноалкил- (R-M-Cl), так и диалкилпроизводные (R-M-R ) этих металлов. Из этих соединений цинк- и кадмийалкилы почти так же реакционноспособны, как и реактив Гриньяра, хотя они слабо реагируют с более инертными карбонильными соединениями (кетонами, сложным эфирами). Ртутьалкилы инертны в большинстве реакций, в которые вступают реактивы Гриньяра. Они легко расщепляются только свободными галогенами и сильными неорганическими кислотами. Действием реактивов Гриньяра на хлориды алюминия, олова, германия и свинца можно приготовить частично или полностью алкилированные производные. Из них тетраэтилсвинец имел большое значение как антидетонатор (в этилированном бензине):
2. С0: углеводороды. Парафиновые углеводороды (алканы). Эти соединения, многие из которых встречаются в нефти, соответствуют общей формуле CnH2n + 2. Поскольку в них каждая из связей углерода имеет ковалентный характер, так как замыкается либо на углерод, либо на водород, валентная оболочка углерода полностью насыщена, в результате чего парафиновые углеводороды химически очень инертны. Синтетически парафины могут быть получены восстановлением алкилгалогенидов водородом на таких катализаторах, как палладий на карбонате кальция, действием цинка в спирте или магния (через RMgBr) с последующей обработкой водой:
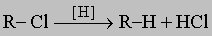
Их можно также приготовить прямым восстановлением спиртов водородом на медно-хромовых катализаторах при высоких температурах и давлениях, а также действием иодоводорода на спирты при 180° С или гидрированием олефинов и ацетиленов на таких катализаторах, как палладий, платина или никель. Технически важным методом получения низших гомологов, которые представляют собой ценное топливо, является крекинг. В этом процессе высшие гомологи, проходя через нагретую до 500-700° С трубку, расщепляются на более простые соединения, например:
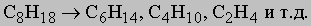
Смесь углеводородов, пригодных в качестве топлива, можно приготовить в промышленных масштабах по Фишеру - Тропшу. В этом процессе смесь СО и H2 (в отношении 1:2) пропускают над кобальтовым или никелевым катализатором при 200° С. Из-за их инертности к большинству химических реагентов углеводороды не представляют большого интереса для синтетической органической химии. На солнечном свету они реагируют с хлором, производя хлорированные углеводороды, например:
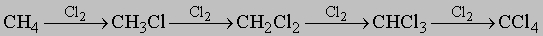
Обычно образуются смеси различных возможных продуктов, поэтому реакция имеет ценность главным образом для получения растворителей, где разделение компонентов несущественно. В некоторых случаях посредством фракционной перегонки получают чистые продукты. При высоких температурах парафины реагируют также с азотной кислотой, производя нитропарафины:
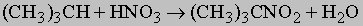
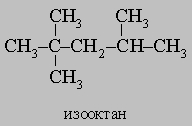
Образующееся вещество, 2-нитро-2-метилпропан, является ценным растворителем. Нормальные углеводороды часто удается изомеризовать в разветвленные углеводороды при действии безводного хлорида алюминия. Эта реакция важна для производства моторных топлив с низкой способностью к детонации. Мерой склонности к детонации (преждевременному воспламенению смеси горючего и воздуха в двигателях внутреннего сгорания) служит октановое число бензина, которое определяют сравнением со стандартными смесями гептана (октановое число 0) и 2,2,4-триметилпентана (т.н. "изооктана", октановое число 100):
Олефины (алкены). Эти соединения, простейшим представителем которых является этилен H2C=CH2, соответствуют общей формуле CnH2n. Они содержат двойную связь
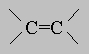
.
Такая связь способна присоединять реакционноспособные атомы и группы, причем каждый из участвующих в ней атомов углерода в результате образует четыре простые связи, поэтому двойная связь называется ненасыщенной. Олефины могут быть получены: а) каталитическим дегидрированием парафинов над оксидом хрома или другими катализаторами
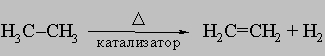
.
б) дегидрацией спиртов в присутствии серной кислоты или оксида алюминия при высоких температурах
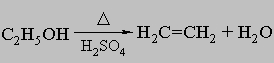
.
в) отщеплением галогеноводорода от алкилгалогенидов при помощи сильных оснований, например этилата калия:
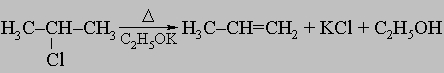
.
(когда может образоваться более одного олефина, преобладает наиболее разветвленный). Олефины вступают в следующие реакции: а) с водородом на платиновых и сходных с ними катализаторах, давая парафины (см. выше); б) с галогенами, давая вицинальные (виц) дигалогениды, в которых атомы галогенов присоединены к двум соседним углеродным атомам:
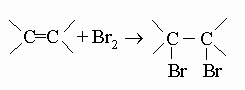
.
в) с пероксидом водорода, перманганатом калия или тетраоксидом осмия, давая гликоли:
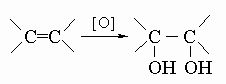
.
г) с серной кислотой, давая алкилсерные кислоты, которые можно прогидролизовать до спирта:
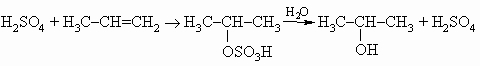
.
д) с галогеноводородами, давая алкилгалогениды:
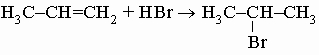
.
е) с хлорноватистой кислотой, давая хлоргидрины:
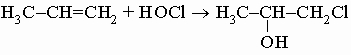
.
(По правилу Марковникова, при присоединении протонных кислот или воды к несимметричным алкенам или алкинам атом водорода присоединяется к наиболее гидрированному атому углерода.) В присутствии свободных радикалов, например радикалов, образующихся при разложении ацетилоксида H3C-C(O)-O-O-C(O)CH3, многие органические соединения гладко присоединяются к олефиновым связям, например,
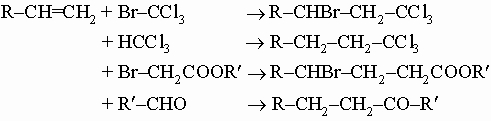
.
Простейший олефин - этилен - применяется как регулятор роста растений, ускоряющий созревание плодов (в том числе цитрусовых), и как исходное соединение в производстве полиэтилена, полиэтилен-пропиленовых каучуков, а также для синтеза этиленгликоля CH2OH-CH2OH. Во время Первой мировой войны его широко применяли для производства иприта (горчичного газа) ClCH2CH2SCH2CH2Cl, который получают действием дихлорида серы на этилен.
См. также ХИМИЧЕСКОЕ И БИОЛОГИЧЕСКОЕ ОРУЖИЕ. Многие диены, т.е. углеводороды, содержащие две двойные связи, представляют промышленный интерес. Бутадиен H2C=CH-CH=CH2, хлоропрен H2C=CCl-CH=CH2 и изопрен H2C=C(CH3)CH=CH2 полимеризуются, давая каучук. Природный каучук также можно рассматривать как полиизопреноиды природного происхождения (см. разд. IV-1.А.4 и IV-2.Б.1).
См. также КАУЧУК И РЕЗИНА.
Ацетилены. Карбид кальция CaC2 при обработке водой выделяет газ ацетилен C2H2, имеющий структуру H-C=C-H. Это вещество является первым членом гомологического ряда ацетиленовых углеводородов CnH2n - 2. Наиболее общий путь получения соединений этого ряда состоит в присоединении брома к соответствующим олефинам с последующей обработкой спиртовым раствором гидроксида калия. Присоединением воды в присутствии сульфата ртути и серной кислоты ацетилен превращается в уксусный альдегид, из которого можно получить уксусную кислоту и другие ценные технические продукты:
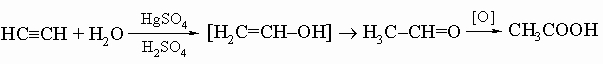
(Соединения со структурой
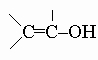
неустойчивы, так как самопроизвольно перегруппировываются в
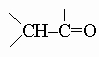
.)
Ацетилен и те из его гомологов, у которых имеется водород при связанном тройной связью углероде, ведут себя как очень слабые кислоты. Их соли со щелочными металлами можно получить действием амида натрия или амида калия:
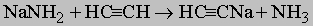
С аммиачным раствором серебра или одновалентной меди ацетилены образуют нерастворимые взрывчатые соли серебра и одновалентной меди. У всех соединений ряда тройная связь способна присоединять реагенты подобно двойной связи.
3. Окислительное состояние С+. Алкилгалогениды можно рассматривать как производные углеводородов, у которых водород заменен галогеном. Они имеют общую формулу R-X, где X может быть F, Cl, Br или I. Прямое замещение водорода галогеном редко может служить препаративным методом получения алкилгалогенидов (см. выше). Более подходящий метод состоит в обработке соответствующего спирта (ROH) галогеноводородом или галогенидом фосфора, чтобы заменить гидроксильную группу на галоген. По многим физическим свойствам, таким, как низкие температуры кипения и плавления, алкилгалогениды напоминают углеводороды, поскольку оба класса соединений относительно неполярны. Химически алкилгалогениды гораздо более реакционноспособны, причем иодиды наиболее активны, а хлориды - наименее. По реакционной способности, реакциям и методам получения алкилфториды сильно отличаются от других галогенидов. Получение металлалкилов, например реактивов Гриньяра, уже обсуждалось в разд. IV-1.А.1. Атом галогена можно также заменить на самые разнообразные простые неорганические или органические основания, например:

Такие реакции замещения лучше идут с алкилбромидами и алкилиодидами, хлор в алкилхлоридах заменить труднее. Параллельно с написанными выше идут побочные процессы - реакция с растворителем и отщепление HX с образованием олефина. Природа R оказывает сильнейшее влияние на скорость и состав продуктов реакции. Реакции замещения могут протекать по двум различным механизмам: мономолекулярному (SN1) или бимолекулярному (SN2). Согласно первому механизму сначала происходит диссоциация алкилгалогенида на галогенид-анион и ион карбения - нестабильную высокореакционноспособную частицу, которая немедленно реагирует с добавленным основанием или молекулой растворителя. Поскольку стабильность карбениевых ионов растет от первичных к третичным
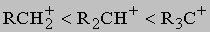
этот механизм замещения должен быть преобладающим для третичных алкилгалогенидов R3CX, его роль должна снижаться для вторичных алкилгалогенидов R2CHX. По второму механизму вступающая группа постепенно вытесняет уходящую, причем в переходном состоянии обе группы связаны с углеродом в реакционном центре приблизительно одинаково. Наиболее энергетически выгодным направлением атаки для вступающей группы является подход со стороны, обратной направлению, в котором удаляется входящая группа:
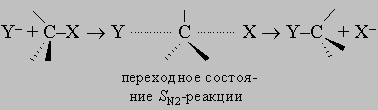
Поскольку в переходном состоянии электронная плотность на реакционном центре выше, чем в исходном и конечном, скорость такого процесса должна падать в ряду RCH2X > R2CHX > R3CX, т.е. в последовательности, обратной той, которая характерна для SN1-реакций.
Реальные процессы замещения являются чем-то промежуточным по отношению к двум описанным крайним идеальным случаям, причем реальный механизм замещения для первичных алкилгалогенидов RCH2X будет близок к SN2, а для третичных алкилгалогенидов R3CX - к SN1, тогда как для вторичных алкилгалогенидов R2CHX реальный механизм будет представлять собой нечто среднее. Поэтому наблюдаемые скорости замещения обычно уменьшаются при переходе от RCH2X к R2CHX. Одновременно при переходе от первичных алкилгалогенидов ко вторичным и третичным возрастает роль упомянутых выше побочных процессов - реакций с растворителем (водой, спиртом и т.п.) и образования олефинов, которые в случае некоторых вторичных и особенно третичных алкилгалогенидов могут стать преобладающими. Присутствие двойной связи вблизи галогена также сильно изменяет реакционную способность. Так, винилгалогениды R-CH=CH-X и арилгалогениды ArX исключительно малоактивны; наоборот, аллилгалогениды R-CH=CH-CH2X и бензилгалогениды Ar-CH2X необычайно реакционноспособны. Все перечисленные выше реагенты являются основаниями Льюиса и могут вызывать конкурирующую реакцию отщепления, в которой отщепляется галогеноводород и образуется олефин:
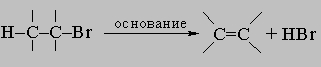
Эта реакция идет особенно хорошо с такими сильными основаниями, как OH- и RO-, и становится преобладающей, когда используются третичные галогениды или если реагентами являются спиртовые растворы сильных оснований:
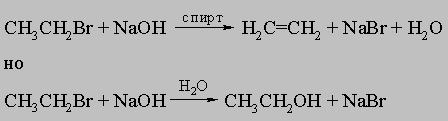
Простые полихлорированные углеводороды широко применяются в промышленности в качестве растворителей. Среди наиболее важных растворителей можно упомянуть хлороформ CHCl3, дихлорэтан ClCH2CH2Cl и тетрахлорэтан Cl2CHCHCl2.
Спирты и простые эфиры. Одноатомные спирты имеют общую формулу R-OH, представляющую углеводород, в котором водород заменен гидроксильной группой. Далее они могут быть подразделены на первичные RCH2OH, вторичные RR'CHOH и третичные спирты, RR'R "COH, в зависимости от того, одна, две или три алкильные группы присоединены к углероду, несущему гидроксильную группу. Низшие спирты находят широкое применение в промышленности в качестве растворителей и как промежуточные вещества для синтеза. Метанол (т. кип. 64,7° С) получают взаимодействием CO и H2 при высоком давлении над хромо-цинковым оксидным катализатором при 350-400° С. Этанол (обычный этиловый спирт, т. кип. 78,3° С) традиционно получают сбраживанием сахара или крахмала в присутствии дрожжей, хотя некоторое количество его производят путем поглощения этилена серной кислотой с последующим гидролизом образующейся этилсерной кислоты C2H5OSO3H водой. Оба процесса дают разбавленные спиртовые растворы, из которых получают перегонкой поступающий в продажу 95%-й спирт. Изопропиловый спирт (пропанол-2, т. кип. 82,3° С) обычно делают сернокислотным методом из пропилена CH3CH=CH2, побочного продукта производства бензина крекингом. Он находил некоторое применение как заменитель этанола в качестве растворителя и в спиртовых растираниях. Некоторые из высших спиртов, например 2-этилгексанол-1 (или "612"), действуют на насекомых как репелленты. Общие методы лабораторного получения спиртов включают а) гидролиз алкилгалогенидов; б) гидратацию олефинов в присутствии минеральных кислот, например описанным выше сернокислотным методом; в) действие реактивов Гриньяра RMgX на альдегиды R'-CHO и кетоны R'-CO-R ". Формальдегид дает первичные спирты, альдегиды - вторичные спирты, а кетоны - третичные:
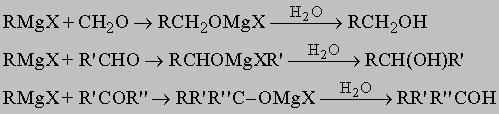
Спирты обнаруживают свойства очень слабых кислот. Водород гидроксильной группы в спиртах несколько менее кислый, чем водород воды. Он может быть замещен на активные металлы с образованием алкоголятов:

Эта реакция легче всего протекает с первичными спиртами и медленнее - с третичными. Na реагирует очень медленно с трет-бутиловым спиртом, но K (более активный) реагирует быстро. Вообще реакции спиртов, в которых рвется O-H-связь, легче всего протекают с первичными спиртами и медленнее всего - с третичными. Сложные эфиры можно получить следующим образом:
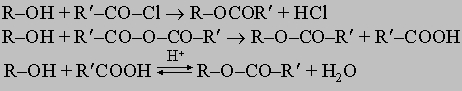
Образование сложных эфиров по первым двум из этих реакций идет быстро и необратимо и, как правило, не требует катализаторов (хотя обычно к реакционной смеси прибавляют такие основания, как пиридин или триэтиламин, которые связывают образующиеся кислоты в виде солей). Третий метод основан на обратимой равновесной реакции и требует катализатора, обычно кислоты (этерификация по Фишеру). Так, реакцию можно заставить протекать слева направо (гидролиз), если использовать избыток спирта и удалять воду по мере ее образования. Ни один из трех указанных выше методов не применим к третичным спиртам. Спирты, однако, амфотерны и в присутствии сильных кислот ведут себя как очень слабые основания:
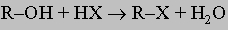
Способность к замещению группы -OH в этой и других реакциях убывает от третичных к первичным спиртам. В присутствии таких дегидратирующих агентов, как серная или фосфорная кислота, при более низких температурах из спиртов образуются простые эфиры R-O-R, тогда как при более высоких температурах путем отщепления воды получаются олефины. Этот метод не годится для получения простых эфиров из вторичных спиртов, а с третичными дает только олефины. Дегидратация спиртов с образованием олефинов может быть осуществлена каталитически в паровой фазе над такими оксидами металлов, как оксид алюминия. Окисление спиртов можно осуществить при помощи сильных окислителей (хромовая или азотная кислота). Продукты окисления различны по своей природе для первичных, вторичных и третичных спиртов. Так, первичные спирты сначала окисляются в альдегиды, которые, если их немедленно не удалить из окислительной среды, окисляются далее до кислот:
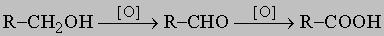
Вторичные спирты окисляются до устойчивых кетонов RCOR', тогда как третичные спирты окисляются только очень сильными окислителями, расщепляющими молекулу на кислоты и кетоны с меньшим числом углеродных атомов. Амины можно рассматривать как производные аммиака, получаемые последовательным замещением атомов водорода алкильными группами, аналогично тому, как спирты и просто эфиры можно представить как производные воды. В соответствии с числом замещенных атомов водорода различают первичные (R-NH2), вторичные (RR'NH) и третичные амины (RR'R "N). Дальнейшее алкилирование дает четвертичные аммониевые соли RR'R "R "'N+X-, которые можно рассматривать как полностью алкилированную аммониевую соль NH4+X-. Прямое алкилирование аммиака алкилгалогенидами имеет очень ограниченную ценность для получения первичных аминов, поскольку эту реакцию трудно контролировать и она ведет к смесям первичных, вторичных и третичных продуктов. Прямое алкилирование первичных аминов, однако, часто используют для получения вторичных и третичных аминов, а также четвертичных аммониевых солей. Для приготовления первичных аминов существует много хороших альтернативных методов, например: 1) расщепление амидов щелочным гипобромитом или гипохлоритом (реакция Гофмана). Промежуточными соединениями в этой реакции являются изоцианаты, и этот метод можно использовать для их получения:
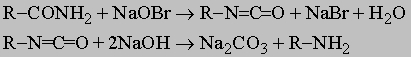
2) перегруппировка азидов кислот в изоцианаты (см. разд. IV-1.А.6) с последующим их гидролизом до аминов (реакция Курциуса):
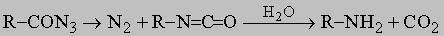
3) реакция алкилгалогенидов с фталимидом калия с последующим гидролизом продукта (реакция Габриэля):
Новый словарь иностранных слов
Полезные сервисы
ациклический
Орфографический словарь
Формы слов для слова ациклический
ацикли́ческий, ацикли́ческая, ацикли́ческое, ацикли́ческие, ацикли́ческого, ацикли́ческой, ацикли́ческих, ацикли́ческому, ацикли́ческим, ацикли́ческую, ацикли́ческою, ацикли́ческими, ацикли́ческом, ацикли́ческ, ацикли́ческа, ацикли́ческо, ацикли́чески
Синонимы к слову ациклический
прил., кол-во синонимов: 7
алифатический (1)
ацикличный (5)
жирный (79)
непериодический (4)
непериодичный (3)
нециклический (3)
нецикличный (3)
Морфемно-орфографический словарь
Грамматический словарь
Полезные сервисы
ацикличность
ацикличный
ацилакт
Синонимы к слову ацилакт
сущ., кол-во синонимов: 3
лекарство (1413)
лекарство (женские половые органы)}} (7)
лекарство (рот, гортань, носоглотка)}} (27)
Полезные сервисы
ацилирование
Энциклопедический словарь
Ацили́рование - введение в молекулы органических и неорганических соединений ацильной группы (ацила) - остатка карбоновой кислоты, например ацетила СН3С(О) (ацетилирование), бензоила C6H5C(O) (бензоилирование). Используется для получения, например, ацетатного волокна, красителей.
* * *
АЦИЛИРОВАНИЕ - АЦИЛИ́РОВАНИЕ, введение в молекулы органических и неорганических соединений ацильной группы (ацила) - остатка карбоновой кислоты, напр. ацетила СН3С(О) (ацетилирование), бензоила С6Н5С(О) (бензоилирование). Используется для получения, напр., ацетатного волокна, красителей.
Большой энциклопедический словарь
АЦИЛИРОВАНИЕ - введение в молекулы органических и неорганических соединений ацильной группы (ацила) - остатка карбоновой кислоты, напр. ацетила СН3С(О) (ацетилирование), бензоила С6Н5С(О) (бензоилирование). Используется для получения, напр., ацетатного волокна, красителей.