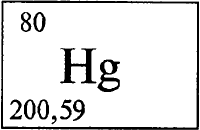РТУТЬ -и; ж. Химический элемент (Hg), жидкий тяжёлый металл серебристо-белого цвета (широко применяется в химии и электротехнике). Живой, как ртуть. (очень подвижный).
◊ Гремучая ртуть Взрывчатое вещество в виде белого или серого порошка.
* * *
ртуть (лат. Hydrargyrum), химический элемент II группы периодической системы. Серебристый жидкий металл (отсюда латинское название; от греческого hýdōr - вода и árgyros - серебро). Плотность при 20°C 13,546 г/см3 (тяжелее всех известных жидкостей), tпл -38,87°C, tкип 356,58°C. Пары ртути при высокой температуре и при электрическом разряде излучают голубовато-зелёный свет, богатый ультрафиолетовыми лучами. Химически стойка. Основной минерал - киноварь HgS; встречается также ртуть самородная. Используется при изготовлении термометров, манометров, газоразрядных приборов, в производстве хлора и гидроксида натрия (как катод). Сплавы ртути с металлами - амальгамы. Ртуть и многие её соединения ядовиты.
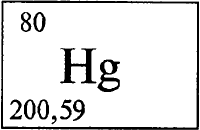
* * *
РТУТЬ - РТУ́ТЬ (лат. Hydrargyrum), Hg (читается «гидраргирум»), химический элемент с атомным номером 80, атомная масса 200,59.
Природная ртуть состоит из смеси семи стабильных нуклидов: 196Hg (содержание 0,146% по массе), 198Hg (10,02%), 199Hg (16,84%), 200Hg (23,13%), 201Hg (13,22%), 202Hg (29,80%) и 204Hg (6,85%). Радиус атома ртути 0,155 нм. Радиус иона Hg+ - 0,111 нм (координационное число 3), 0,133 нм (координационное число 6), иона Hg2+ - 0,083 нм (координационное число 2), 0,110 нм (координационное число 4), 0,116 нм (координационное число 6) или 0,128 нм (координационное число 8). Энергии последовательной ионизации нейтрального атома ртути равны 10,438, 18,756 и 34,2 эВ. Расположена во IIВ группе, 6 периода периодической системы. Конфигурация внешнего и предвнешнего электронных слоев 5s2p6d106s 2. В соединениях проявляет степени окисления +1 и +2. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,9.
История открытия
Ртуть известна человечеству с древнейших времен. Обжиг киновари (см. КИНОВАРЬ) HgS, приводящий к получению жидкой ртути, использовали еще в 5 в. до н. э. в Междуречье (см. МЕСОПОТАМИЯ). Использование киновари и жидкой ртути описано в древних документах Китая, Ближнего Востока. Первое подробное описание получения ртути из киновари описано Теофрастом (см. ТЕОФРАСТ) около 300 лет до н. э.
В древности ртуть использовали для добычи золота (см. ЗОЛОТО (химический элемент)) из золотых руд. Этот способ основан на ее способности растворять многие металлы, образуя жидкие или легкоплавкие амальгамы (см. АМАЛЬГАМА). При прокаливании амальгамы золота летучая ртуть испаряется, золото остается. Во второй половине 15 в в Мексике применяли амальгамирование для извлечения из руды серебра (см. СЕРЕБРО).
Алхимики считали ртуть составной частью всех металлов, полагая, что изменением ее содержания можно осуществить превращение ртути в золото. Только в 20 в. физики установили, что в процессе ядерной реакции атомы ртути действительно превращаются в атомы золота. Но такой способ чрезвычайно дорог.
Жидкая ртуть - очень подвижная жидкость. Алхимики называли ртуть «меркурием» по имени римского бога Меркурия, славившегося своей быстротой в перемещении. В английском, французском, испанском и итальянском языках для ртути используется название «mercury». Современное латинское название происходит от греческих слов «хюдор» - вода и «аргирос» - серебро, т. е. «жидкое серебро».
Ртутные препараты использовали в медицине в средние века (ятрохимия (см. ЯТРОХИМИЯ)).
Нахождение в природе
Редкий рассеянный элемент. Содержание ртути в земной коре 7,0·10-6% по массе. В природе ртуть встречается в свободном состоянии. Образует более 30 минералов. Основной рудный минерал киноварь. Минералы ртути в виде изоморфных примесей встречаются в кварце, халцедоне, карбонатах, слюдах, свинцово-цинковых рудах. Желтая модификация HgO встречается в природе в виде минерала монтроидита. В обменных процессах литосферы, гидросферы, атмосферы участвует большое количество ртути. Содержание ртути в рудах от 0,05 до 6-7%.
Получение
Первоначально ртуть получали из киновари (см. КИНОВАРЬ), помещая ее куски в вязанки хвороста и обжигая киноварь в кострах.
В настоящее время ртуть получают окислительно-восстановительным обжигом руд или концентратов при 700-800оС в печах кипящего слоя, трубчатых или муфельных. Условно процесс может быть выражен:
HgS + O2 = Hg + SO2
Выход ртути при таком способе составляет около 80%. Более эффективен способ получения ртути путем нагревания руды с Fe (см. ЖЕЛЕЗО) и CaO:
HgS + Fe = Hg- + FeS,
4HgS + 4CaO = 4Hg- + 3CaS + CaSO4.
Особо чистую ртуть получают электрохимическим рафинированием на ртутном электроде. При этом содержание примесей составляет от 1·10-6 до 1·10-7%.
Физические и химические свойства
Ртуть - серебристо-белый металл, в парах бесцветный. Единственный жидкий при комнатной температуре металл. Температура плавления -38,87°C, кипения 356,58°C. Плотность жидкой ртути при 20°C 13,5457 г/см3 , твердой ртути при -38,9°C - 14,193 г/см3.
Твердая ртуть - бесцветные кристаллы октаэдрической формы, существующая в двух кристаллических модификациях. «Высокотемпературная» модификация обладает ромбоэдрической решеткой a-Hg, параметры ее элементарной ячейки (при 78 К) а= 0,29925 нм, угол b = 70,74о. Низкотемпературная модификация b-Hg обладает тетрагональной решеткой (ниже 79К).
С использованием ртути голландский физик и химик Х.Камерлинг-Оннес (см. КАМЕРЛИНГ-ОННЕС Хейке) в 1911 впервые наблюдал явление сверхпроводимости (см. СВЕРХПРОВОДИМОСТЬ). Температура перехода a-Hg в сверхпроводящее состояние 4,153К, b-Hg - 3,949К. При более высоких температурах ртуть ведет себя как диамагнетик (см. ДИАМАГНЕТИК). Жидкая ртуть не смачивает стекло и практически не растворяется в воде (в 100 г воды при 25°C растворяется 6·10-6 г ртути).
Стандартный электродный потенциал пары Hg2+2/Hg0 = +0.789 B, пары Hg2+/Hg0 = +0.854B, пары Hg2+/Hg2+2= +0.920B. В неокисляющих кислотах ртуть не растворяется с выделением водорода (см. ВОДОРОД). (см. КИСЛОРОД)
Кислород (см. КИСЛОРОД) и сухой воздух при обычных условиях ртуть не окисляют. Влажный воздух и кислород при ультрафиолетовом облучении или электронной бомбардировке окисляют ртуть с поверхности с образованием оксидов.
Ртуть окисляется кислородом воздуха при температуре выше 300°C, образуя оксид ртути HgO красного цвета:
2Hg + O2 = 2HgO.
Выше 340°C этот оксид разлагается на простые вещества.
При комнатной температуре ртуть окисляется озоном (см. ОЗОН).
Ртуть не реагирует при нормальных условиях с молекулярным водородом, но с атомарным водородом образует газообразный гидрид HgH. Ртуть не взаимодействует с азотом, фосфором, мышьяком, углеродом, кремнием, бором, германием.
С разбавленными кислотами ртуть не реагирует, но растворяется в царской водке (см. ЦАРСКАЯ ВОДКА) и в азотной кислоте. Причем, в случае с кислотой продукт реакции зависит от концентрации кислоты и соотношения ртути и кислоты. При избытке ртути, на холоду, протекает реакция:
6Hg + 8HNO3 разбавл. = 3Hg2(NO3)2 + 2NO + 4H2O.
При избытке кислоты:
3Hg + 8HNO3 = 3Hg(NO3)2 + 2NO + 4H2O.
С галогенами (см. ГАЛОГЕНЫ) ртуть активно взаимодействует с образованием галогенидов (см. ГАЛОГЕНИДЫ). При реакциях ртути с серой (см. СЕРА), селеном (см. СЕЛЕН) и теллуром (см. ТЕЛЛУР) возникают халькогениды (см. ХАЛЬКОГЕНИДЫ) HgS, HgSe, HgTe. Эти халькогениды праrтически не растворимы в воде. Например, значение ПР HgS = 2·10-52. Сульфид ртути растворяется только в кипящей HCl, царской водке (при этом образуется комплекс [HgCl4]2-) и в концентрированных растворах сульфидов щелочных металлов:
HgS + K2S = K2[HgS2].
Сплавы ртути с металлами называют амальгамами (см. АМАЛЬГАМА). Стойкие к амальгамированию металлы - железо (см. ЖЕЛЕЗО), ванадий (см. ВАНАДИЙ), молибден (см. МОЛИБДЕН), вольфрам (см. ВОЛЬФРАМ), ниобий (см. НИОБИЙ) и тантал (см. ТАНТАЛ (химический элемент)). Со многими металлами ртуть образует интерметаллические соединения меркуриды.
Ртуть образует два оксида: оксид ртути(II) HgO и неустойчивый на свету и при нагревании оксид ртути(I) Hg2O (черные кристаллы).
HgO образует две модификации - желтую и красную, отличающиеся размерами кристаллов. Красная модификация образуется при добавлении к раствору соли Hg2+ щелочи:
Hg(NO3)2 + 2NaOH = HgOЇ + 2NaNO3 + H2O.
Желтая форма химически более активна, при нагревании краснеет. Красная форма при нагревании чернеет, но приобретает прежний цвет при охлаждении.
При добавлении щелочи к раствору соли ртути(I) образуется оксид ртути (I) Hg2O:
Hg2(NO3)2 + 2NaOH = Hg2O + H2O + 2NaNO3.
На свету Hg2O распадается на ртуть и HgO, давая осадок черного цвета.
Для соединений ртути(II) характерно образование устойчивых комплексных соединений (см. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ):
2KI + HgI2 = K2[HgI4],
2KCN + Hg(CN)2 = K2[Hg(CN)4].
Соли ртути(I) содержат группировку Hg22+ со связью -Hg-Hg-. Получают эти соединения, восстанавливая соли ртути(II) ртутью:
HgSO4 + Hg + 2NaCl = Hg2Cl2 + Na2SO4,
HgCl2 + Hg = Hg2Cl2.
В зависимости от условий, соединения ртути(I) могут проявлять как окислительные, так и восстановительные свойства:
Hg2Cl2 + Cl2 = 2HgCl2,
Hg2Cl2 + SnCl2 = 2Hg + SnCl4. (см. ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ)
Пероксид (см. ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ) HgO2 - кристаллы; неустойчив, взрывается при нагревании и ударе.
Применение
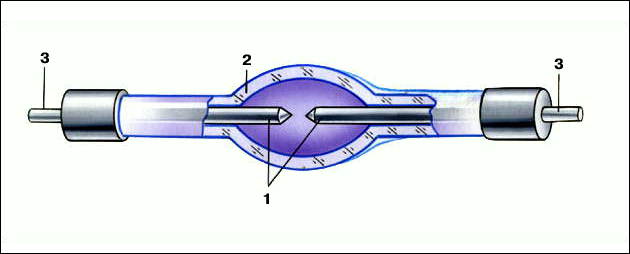
Ртуть используют для изготовления катодов при электрохимическом получении едких щелочей и хлора, а также для полярографов, в диффузионных насосах, барометрах и манометрах; для определения чистоты фтора и его концентрации в газах. Парами ртути наполняют колбы газоразрядных ламп (ртутных и люминесцентных) и источников УФ излучения. Ртуть применяют при нанесении золотых покрытий и при добычи золота из руды. (см. РТУТИ ХЛОРИДЫ)
Сулема (см. РТУТИ ХЛОРИДЫ) - важнейший антисептик, применяют при разбавлениях 1:1000. Оксид ртути (II), киноварь HgS применяются для лечения глазных и кожных и венерических заболеваний. Киноварь также используют для приготовления чернил и красок. В древности из киновари готовили румяна. Каломель (см. КАЛОМЕЛЬ) используется в ветеринарии в качестве слабительного средства.
Физиологическое действие
Ртуть и ее соединения высокотоксичны. Пары и соединения ртути накапливаясь в организме человека, сорбируются легкими, попадают в кровь, нарушают обмен веществ и поражают нервную систему. Признаки ртутного отравления проявляются уже при содержании ртути в концентрации 0.0002-0.0003 мг/л. Пары ртути фитотоксичны, ускоряют старение растений.
При работе с ртутью и ее соединениями следует предотвращать ее попадание в организм через дыхательные пути и кожу. Хранят в закрытых сосудах.
Hg (hydrargirum),
жидкий металлический элемент IIB подгруппы периодической системы элементов, член семейства цинка Zn, Cd, Hg. Символ ртути происходит от греческого слова, означающего "водное серебро". Ртуть известна с давних времен, она играла важную роль в алхимической практике. В настоящее время широко применяется в барометрах, термометрах, лампах дневного света, электрических переключателях, кварцевых лампах, амальгамах для лечения кариеса. Ртуть получают в основном обжигом киновари - руды, содержащей яркокрасный сульфид ртути (киноварь используется для получения красной краски). Известны также хлорид- и селенидсодержащие руды ртути, но они имеют ограниченное промышленное применение. Мировыми лидерами по добыче руды являются Италия и Испания, другие значительные производители руды - Китай, Мексика, страны СНГ и США. СВОЙСТВА РТУТИ
Атомный номер 80 Атомная масса 200,59 Изотопы
стабильные 196, 198-202, 204
нестабильные 191-195, 197, 199, 203, 205
Температура плавления, ° С -38,87 Температура кипения, ° С 356,6 Плотность, г/см3 13,546 Твердость жидкость Содержание в земной коре, % (масс.) 0,00005 Степени окисления +1, +2
Свойства. Ртуть - серебристый металл, единственный из металлов, жидкий при обычной температуре. При комнатной температуре ртуть медленно испаряется, что создает опасность ртутного отравления, так как пары ртути ядовиты, не имеют запаха, цвета и способны накапливаться в организме. Поэтому сосуды с ртутью должны быть плотно закрыты. Ртуть в коллоидном состоянии получается при восстановлении нитрата ртути(I) нитратом олова(II). При встряхивании ртути с разными жидкостями или при смешении с жирами либо порошками ртуть образует с ними тонкую дисперсию, которая используется в медицине как серая ртутная мазь. Чистая ртуть не тускнеет на воздухе при обычной температуре, но при нагревании медленно окисляется кислородом, образуя оксид HgO. Ртуть не реагирует с разбавленной хлороводородной кислотой и с холодной концентрированной серной кислотой, но разбавленная азотная и горячая концентрированная серная кислоты растворяют ртуть, причем при избытке металла образуются соединения ртути(I), а если кислота находится в избытке, то получаются соединения ртути(II). Ртуть хорошо растворяет многие металлы и образует с ними соединения и сплавы, которые называются амальгамами. Обычно амальгамы образуются уже при простом контакте металлов со ртутью. Особенно легко образуется амальгама золота, из-за чего не следует допускать контакта золотых изделий со ртутью. Co, Ni и Pt не образуют амальгам, железо также не образует амальгамы, если находится в компактной форме, поэтому ртуть можно перевозить в стальных сосудах. Амальгамы ряда металлов очень важны, например, с помощью амальгам извлекают золото и серебро (драгоценные металлы) из их руд. Амальгамы олова, серебра и золота применяют для пломбирования зубов, амальгамы натрия и калия используют как восстановители. Амальгамирование цинковых электродов используют для уменьшения их коррозии в период консервации аккумуляторных батарей.
Применение и основные соединения. Многообразно применение чистой ртути. Помимо вышеуказанных применений ее используют в ареометрах, вакуумных насосах, электроконтактах, жидких уплотнениях, выпрямителях, ультрафиолетовых и флюоресцентных лампах, как электролитический катод, катализатор органических синтезов, в химическом анализе по Кьельдалю и в производстве многих необходимых веществ. В ртутнопаровых турбинах используется много ртути, и небольшое количество ее необходимо каждый раз добавлять в цикл. Во время Второй мировой войны было найдено много новых областей применения ртути, а некоторые получили дальнейшее развитие. Среди них сухие батареи - одно из выдающихся достижений в технологиях с использованием ртути. К 1947 эти батареи были переделаны для использования в мирной продукции, например, для слуховых аппаратов. Другим достижением является применение ртутных муфт для миниатюрных электродвигателей в стиральных машинах, кондиционерах и холодильниках. В электролитическом методе производства хлора, разработанном в Германии и усовершенствованном в США, используется ртутный электрод. Соединения ртути применяют как средство защиты растений от милдью (ложная мучнистая роса), а также от плесени, гниения. Хлорид ртути(I) Hg2Cl2 (каломель) - тяжелый белый порошок без вкуса, без запаха, нерастворим в воде, медленно разлагается на свету. Он реагирует с гидроксидом аммония, образуя свободную ртуть в виде высокодисперсного черного порошка. Каломель используется как слабительное, диуретик, антисептик. В промышленности ее используют для производства бенгальских огней и художественного фарфора. В научных лабораториях часто применяется каломельный электрод. Иодид ртути(I) Hg2I2 - светложелтый порошок, темнеющий на свету в результате разложения и выделения высокодисперсной ртути, - используют как антисептик и лекарство. Нитрат ртути(I) Hg2(NO3)2 образует бесцветные кристаллы, растворимые в очень разбавленной азотной кислоте; его применяют как едкое вещество и антисептик, а также для чернения латуни. Сульфат ртути(I) Hg2SO4 - светложелтый порошок, который становится серым на свету. Он плохо растворим в воде. Его применяют в технологии аккумуляторов и электролитических ячеек. Хлорид ртути(II) HgCl2 (сулема, или дихлорид ртути) получают в виде бесцветных кристаллов или белого порошка, который заметно летуч при 100° C и полностью испаряется при 300° C. Он растворим в воде и образует кислые растворы в результате гидролиза и слабой ионизации. Сулема сильно ядовита, является эффективным антисептиком и протравой и применяется для обеззараживания одежды. Ее водные растворы 1:1000 или 1:5000 используют для обеззараживания и промывания ран и лечения кожных болезней. В промышленности сулему используют для консервации древесины и анатомических образцов, а также для бальзамирования, дезинфекции, дубления, крашения дерева, в гальваностегии и деполяризации сухих батарей и для многих других целей. Иодид ртути(II) HgI2 - яркокрасный ядовитый порошок - применяют как протраву и лекарство. Нитрат ртути(II) Hg(NO3)2 - белый кристаллический, растворимый в воде порошок, - применяют в медицине, производстве фетровых шляп, для синтеза фульмината ртути (гремучей ртути) Hg(CNO)2 - инициирующего ВВ для капсюлей-детонаторов и капсюлей-воспламенителей в снарядах, гранатах и торпедах. Тиоцианат ртути(II) Hg(CNS)2 - белый порошок без запаха, при нагревании во много раз увеличивается в объеме, что используют для демонстрации опыта "фараонова змея"; соединение в порошке и в парах ядовито. Ртуть образует много комплексных соединений. Например, щелочной раствор тетраиодомеркурата калия K2[[HgI4]] (реактив Несслера) используют для количественного определения аммиака, в присутствии которого образуется бурый осадок NH2Hg2I3. Этот метод позволяет обнаруживать до 10-8 долей аммиака в воде. Амидохлорид ртути HgNH2Cl (белый аморфный порошок), получается при добавлении гидроксида аммония к хлориду ртути(II); при нагревании не плавится, а испаряется в режиме слабокрасного нагрева. Это соединение используют для лечения кожных сыпей и раздражений (белая ртутная мазь).
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Мельников С.М. Металлургия ртути. М., 1971 Трахтенберг Т.М., Коршун М.Н. Ртуть и ее соединения в окружающей среде. Киев, 1990
- Металл со склонностью к ядовитым испарениям.
- «Живой металл».
- Металл, прикидывающийся жидкостью.
- Каким расплавленным металлом можно заморозить?
- Только в холодном декабре 1759 года в России Ломоносов и Браун окончательно установили, что она относится к металлам.
- В тёмной комнате Луи Дагер держал экспонированную пластину над парами этого металла, а закреплял изображение поваренной солью.
- Жидкий металл.
- Люминесцентные лампы содержат этот опасный химический элемент, потому-то выбрасывать их нужно только в специальные контейнеры.
- Какой металл встречается в природе реже, чем платина или уран, однако есть дома почти у каждого из нас?
- Что в старину называли живым серебром?
- У какого металла ядовитая атмосфера?
- Металл, который средневековые алхимики назвали Меркурием.
- Какой металл помог обнаружить сверхпроводимость?
- Металл, помогающий измерить температуру и давление.
- Металл из градусника.
- Металл, имеющий самую низкую температуру плавления.
- Самая тяжёлая жидкость.
- Текучий металл.
- Химический элемент, Hg.
- Металл, разрушающий алюминий.
- На генеральной репетиции «Волшебного зеркала» - одно из последних балетов Петипа - огромное зеркало на сцене треснуло, и серебряными струйками потекло это вещество.
- Зловещее озеро горных духов в рассказе Ивана Ефремова помогло открыть богатое месторождение этого металла.
- Самым первым способом её получения был обжиг киновари с конденсацией паров на свежевырубленных зелёных деревьев.
- Сопротивление столбика этого металла длиной 1063 миллиметра и сечением 1 квадратный миллиметр равно 1 ому.
- В рассказе Ивана Ефремова «Озеро горных духов» светящиеся призраки позволили открыть месторождение этого металла.
- Пулю для охоты на белого медведя капитан Гаттерас изготовил из этого содержимого барометра.
- Как мы сейчас называем то, что более 2000 лет назад греческий врач Диоскорид называл «серебряной водой»?
- Незадолго до нашей эры в Китае изготовили рельефную карту страны, а с помощью какого химического элемента изображали реки и моря?
- В 1708 году один физик из Данцига пришёл к выводу, что объём, на который этот химический элемент увеличивается при нагревании, пропорционален температуре, на которую его нагревают.
- Алхимики обычно очень образно зашифровывали названия веществ: «Костями Тифона» называли железо, «свернувшейся кровью» - медь, а что называли «беглецом» или «лёгкими облаками»?
- Этот металл пользовался особым уважением у алхимиков. Они как будто чувствовали, что если к нему добавить всего один электрон, то возможно получение золота.
- Фильм Анатолия Иванова «Осторожно! Красная ...!».