↑ в отношении, химическая реакция
сродство к электрону. | ряд напряжений.
Химическая и бактериологическая война
(chemical and biological warfare, CBW), применение синтет. отравляющих в-в или таких организмов, как болезнетворные микробы, в целях уничтожения или выведения из строя противника. К ним относятся хлор, иприт, или горчичный газ (впервые применен во время 1-й мировой войны), разл. нервно-паралитические газы, дефолианты (гербициды), вирусы и бактерии (напр., сибирской язвы). Применение хим. и биол. оружия запрещено Женевской конвенцией, но на его произв-во и хранение этот запрет не распространяется. В отличие от применявшегося в 1-й мировой войне, совр. хим. оружие стало более изощренным и может доставляться дальнобойной артиллерией или ракетами. Наибольший резонанс в последнее десятилетие вызвало применение хим. оружия Ираком против курдского меньшинства в 1988 г.; такое же оружие Ирак держал наготове, но не использовал во время войны в Персидском заливе в 1991 г. Согласно Конвенции 1972 г. биол. оружие запрещено, за иск. опытного произ-ва в оборонительных целях. Соглашение об ограничении произ-ва хим. и биол. оружия - один из гл. пунктов повестки дня Конференции по разоружению, однако мн. страны, особенно развивающиеся, не склонны от него отказываться, рассматривая этот вид вооружения как серьезный сдерживающий фактор. Проверка потенциала хим. и биол. оружия в к.-л. стране сопряжена с опред. трудностями: заявленный арсенал может быть предъявлен и уничтожен, но обнаружить незаявленное произ-во и хранение почти невозможно.
Скорость любой химической реакции зависит от условий, в которых она протекает: от концентрации реагентов (или их давления, если это газы), температуры, наличия катализатора или излучения и т.д. Одни реакции протекают практически мгновенно (например, нейтрализация кислоты основанием), другие при обычных условиях идут настолько медленно, что заметные изменения концентраций реагентов наблюдаются лишь через несколько лет (например, взаимодействие водорода с кислородом с образованием воды в отсутствие катализатора). При этом существует множество реакций, протекающих с вполне измеримыми скоростями в обычных условиях. Химическая кинетика занимается определением скоростей химических реакций и изучением их механизма. Это относительно молодая наука, и в ней имеется много нерешенных проблем. Во всех кинетических исследованиях фигурируют время и промежуточные продукты (вещества, образующиеся на промежуточных стадиях реакции). Этим они отличаются от исследований систем в условиях химического равновесия, когда рассматриваются только начальное и конечное состояния реагентов.
См. также ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА.
ХИМИЧЕСКАЯ КИНЕТИКА
В одном кинетическом эксперименте нередко участвуют одновременно две или несколько реакций, при этом их скорости могут зависеть от наличия загрязнений и следов катализаторов. В результате получаемые данные бывают плохо воспроизводимыми, что затрудняет их интерпретацию. Если с термодинамической точки зрения из одних и тех же исходных веществ возможно образование разных продуктов, следует подбором концентрации реагентов, температуры и специфического катализатора добиться, чтобы протекала именно та реакция, которая интересует исследователя. Скорость реакций обычно определяют при постоянной температуре, лучше при двух и более ее значениях, используя один или несколько высокоточных термостатов.
Измерение скоростей реакций. Скорости реакций измеряют разными способами. Можно отбирать пробы из термостатируемого реактора через строго определенные интервалы времени либо замедлять или полностью останавливать реакцию (быстрым охлаждением реактора или каким-либо иным способом) и анализировать пробы титрованием или другими аналитическими методами. Иногда одновременно запускают несколько идентичных реакций, а затем последовательно останавливают их быстрым охлаждением и анализируют продукты. Если один из реагентов или продуктов реакции обладает оптической активностью, то следят за его концентрацией с помощью поляриметра. Аналогично, если изменение концентрации реагента или продукта реакции либо их обоих сопровождается изменением электропроводности, для кинетических измерений используют электрические методы. Иногда концентрацию одного из реагирующих веществ определяют, измеряя оптическую плотность раствора при определенной длине волны и используя закон Ламберта - Бера.
См. также ХИМИЯ АНАЛИТИЧЕСКАЯ. Скорость реакции можно рассчитать исходя из данных об изменении давления или объема в газофазной системе либо объема газа, выделяющегося в ходе реакции. В случае газофазных реакций, протекающих в потоке, в реактор иногда вводят катализатор или повышают температуру, чтобы ускорить процесс. Входные и выходные трубки в таких системах делают достаточно малыми, чтобы газы поступали в реактор и выходили из него как можно быстрее и в области с неконтролируемым градиентом температуры находились непродолжительное время. Время нахождения газов в реакторе (время протекания реакции) определяют исходя из объема газов, проходящих через реактор в 1 с, отнесенного к объему реактора. Если общее число молекул в ходе реакции изменяется, то оценить время становится довольно трудно. В проточных системах используются большие количества реагентов и получаются большие количества продуктов, что облегчает моделирование соответствующих химических процессов в промышленных масштабах. Скорость реакции можно определить по уменьшению концентрации исходных веществ или по увеличению концентрации продуктов. Скорость уменьшения концентрации исходного вещества равна -dC/dt, а скорость увеличения концентрации продукта равна dC/dt, где С - концентрация, t - время. Концентрацию обычно измеряют в единицах молярности (моль/л), время - в секундах.
Порядок реакции. Порядок реакции - это эмпирическая величина, равная сумме показателей степеней, с которыми концентрации реагентов входят в выражение для скорости реакции. Так, для реакции aA + bB -> mM + nN скорость уменьшения концентрации С реагента А можно представить в виде
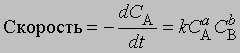
где СА и СВ - концентрации исходных веществ А и В соответственно. Порядок реакции в этом случае равен а + b. Коэффициент пропорциональности k, входящий в уравнение, называется константой скорости. Он равен скорости реакции при единичной концентрации реагентов.
Реакции первого порядка. Если скорость реакции зависит от концентрации только одного реагента в первой степени, то выражение для скорости принимает вид

О такой реакции говорят, что она является реакцией первого порядка. Чтобы найти зависимость концентрации от времени, нужно проинтегрировать уравнение (1). Разделив переменные и проинтегрировав, получим -ln C = kt + const
где ln - натуральный логарифм. Или, перейдя к десятичным логарифмам:
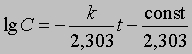
График зависимости lg C от t является прямой с тангенсом угла наклона -s, равным -k/2,303. Отсюда k = 2,303*s
Зная k и концентрацию С при данном t, можно найти константу интегрирования (const) и рассчитать концентрацию для любого момента времени. Константу интегрирования можно также определить из координат точки пересечения прямой с осью lg C при t = 0 (рис. 1).
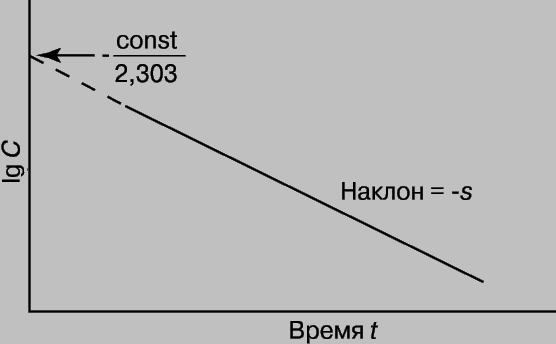
Рис. 1. ГРАФИК ЗАВИСИМОСТИ логарифма концентрации от времени.
Уравнение (1) можно проинтегрировать в пределах от С1 до С2, равных концентрациям реагента в моменты времени t1 и t2:

Отсюда
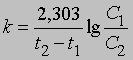
Размерность k равна размерности t -1. Если в начальный момент времени (t1 = 0) C1 = C0, то концентрация C в любой момент времени t в соответствии с уравнением (2) будет равна
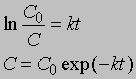
Уравнение (1) можно записать в другом виде, приняв, что а - это начальное количество реагента, x - его количество, прореагировавшее за время t. Тогда (а - x) равно количеству реагента, оставшемуся через время t, и уравнение реакции примет вид
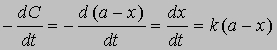
Разделив переменные и проинтегрировав, получим -ln(a - x) = kt + const
отсюда при t = 0, x = 0 и const = -ln a
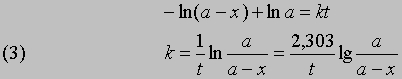
Часто представляет интерес характеристическая величина t1/2 - время полупревращения реакции, т.е. время, за которое концентрация исходного вещества уменьшается вдвое. При x = (1/2)a и t = t1/2 из уравнения (3) получим
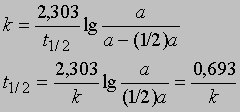
Это соотношение иллюстрирует важную особенность реакций первого порядка: время, за которое количество вещества уменьшается вдвое, не зависит от его количества в момент начала реакции и в любой данный момент реакции. Если известна константа скорости k, можно рассчитать количество вещества, прореагировавшего к данному моменту времени, или определить, за какое время прореагирует данное количество вещества. Уравнению первого порядка следуют многие химические реакции. Например, пентаоксид азота, растворенный в тетрахлориде углерода, разлагается при температуре 45° С в строгом соответствии с уравнением реакции первого порядка:
Реакции второго порядка. Когда скорость реакции пропорциональна квадрату концентрации отдельного реагента или концентрациям каждого из двух реагирующих веществ в первой степени, мы имеем дело с реакцией второго порядка. В дифференциальной форме выражения для скорости такой реакции имеют вид
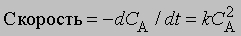
и
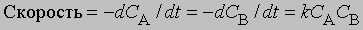
Пусть a - начальная молярная концентрация реагента А, x - число его молей в 1 л, прореагировавшее за время t; тогда скорость реакции будет равна dx/dt = k(a - x)2
или dx/(a - x)2 = kdt
Проинтегрировав, получим 1/(a - x) = kt + C
Поскольку x = 0 при t = 0, константа С = 1/а. Отсюда
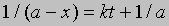
и
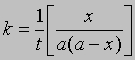
Если а и b - начальные молярные концентрации реагентов А и В соответственно и если за время t прореагировало x молей этих реагентов в 1 л, то, проинтегрировав соответствующее уравнение для скорости реакции, можно найти выражение для константы скорости:
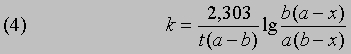
Размерность k - л/(моль*с). Численное значение k можно найти, подставив концентрации и время в уравнение (4) либо построив графики зависимости
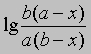
или
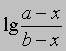
от времени. Умножение наклона полученной таким образом прямой на 2,303/(a - b) дает k.
Реакции третьего порядка. Скорость реакции третьего порядка может зависеть от концентрации одного реагента в третьей степени, либо концентрации одного реагента во второй степени и второго реагента в первой степени, либо от концентрации каждого из трех реагентов в первой степени. Так,
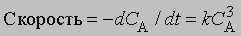
или dx/dt = k(a - x)3
Разделение переменных и интегрирование дают
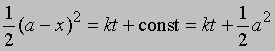
или
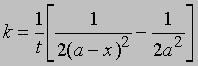
Здесь размерность k - л2/(моль2*с). Реакции нулевого порядка. Скорость реакций нулевого порядка не зависит от концентраций реагентов и определяется другими лимитирующими факторами, например площадью поверхности катализатора (в реакциях гетерогенного катализа) или поглощением света (в фотохимических реакциях). Уравнение для скорости такой реакции в дифференциальной форме имеет вид -dC/dt = k
или, выраженное через концентрацию x продукта, dx/dt = k
Проинтегрировав, получим x = kt + C
Значению x = 0 соответствует t = 0, откуда константа С = 0 и x = kt
В величину k могут входить различные константы, например интенсивность света, концентрация насыщенного раствора или пара. Размерность k - моль/(лЧс).
Реакции п-го порядка. В общем случае для реакции порядка п при п > 1 связь между концентрацией и временем для конечного времени наблюдения описывается уравнением
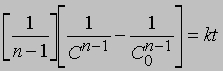
где С - концентрация реагента в момент времени t, C0 - начальная концентрация. График зависимости 1/(Сn - 1) от t представляет собой прямую с наклоном (n-1) k. Размерность k - (моль/л)1 - n/c. Реакции не всегда имеют целочисленный порядок. Показатели степени при концентрациях в выражении для скорости часто являются дробными. Однако и в этом случае порядок реакции равен сумме показателей степеней. Например, для реакции, скорость которой равна
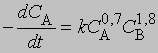
порядок п = 0,7 + 1,8 = 2,5. Часто порядок реакции, определяемый экспериментально, не соответствует порядку, который следует из стехиометрического уравнения. Большинство химических реакций включает две или несколько стадий, протекающих одновременно, что приводит к более сложным выражениям для скорости.
Определение порядка реакции. Подстановка в формулы. Если k остается постоянной при подстановке значений концентрации и времени в уравнение скорости реакции, значит, порядок реакции, задаваемый уравнением, верен. Если же расчеты не согласуются с экспериментальными данными, то реакция сложнее, чем предполагалось, и, вероятно, протекает в две или несколько стадий.
Графический метод. Для определения порядка реакции можно прибегнуть к графическому представлению функций, описывающих зависимость концентрации от времени. Если при построении зависимости С от t получается прямая, это означает, что реакция - нулевого порядка. Если линейна зависимость lg C от t, имеет место реакция первого порядка. При условии что начальная концентрация всех реагентов одинакова, реакция имеет второй порядок, если линейным является график зависимости 1/С от t, и третий - в случае линейности зависимости 1/С 2 от t.
Определение времени полупревращения. Для реакции первого порядка время, за которое прореагирует определенная часть реагента (например, половина), не зависит от начальной концентрации (см. выше),
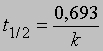
Для реакции второго порядка при равенстве начальных концентраций обоих реагентов, а = b, время, за которое прореагирует половина вещества, обратно пропорционально начальной концентрации. Из приведенного выше выражения для константы скорости реакции второго порядка получаем
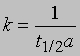
или
t1/2 = 1/ka
Изменение соотношения между реагентами. Если выражение для скорости представить как
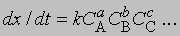
где СА, СВ, СС ... - концентрации участвующих в реакции веществ А, В и С ..., а а, b, с ... - соответствующие показатели степени в уравнении для скорости, то порядок реакции п можно определить, увеличив вдвое значение СА без изменения СВ и СС и экспериментально определив величину Dx/Dt для СА и 2СА. Так, если
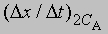
скорость при концентрации 2СА, а
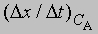
- скорость при концентрации СА, то, взяв отношение этих двух величин, получим
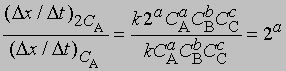
Предположим, что наблюдаемое отношение
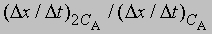
равно 4; тогда а = 2 и реакция является реакцией второго порядка относительно реагента А. Если это отношение равно 2, то а = 1 и имеет место реакция первого порядка относительно того же реагента. Аналогичным образом определяют b, с и т.д.
Добавление избытка реагентов. Добавив в реакционную смесь в большом избытке все реагирующие вещества, кроме одного, можно определить порядок реакции по этому реагенту, т.е. показатель степени, с которым концентрация данного реагента входит в уравнение скорости. Таким же образом определяют порядок реакции по каждому реагенту. Показатель степени для концентрации реагента А, не находящегося в избытке, устанавливают по графику зависимости dCA/dt от ln CA согласно уравнению
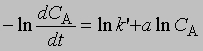
Наклон полученной прямой равен а. Константа kў является произведением константы скорости на концентрации реагентов, находящихся в избытке, взятые в соответствующих степенях. Молекулярность реакции определяется числом молекул, участвующих в самой медленной, лимитирующей стадии. Реакции бывают моно-, би-, три- и т.д. молекулярными. Порядок реакции и ее молекулярность не всегда можно предсказать исходя из стехиометрии реакции; для этого нужно провести кинетические измерения. В некоторых случаях порядок и молекулярность реакции, определенные исходя из ее стехиометрии, совпадают. Мономолекулярной называется такая реакция, в которой лимитирующей стадией является превращение одной молекулы, например распад ее на составляющие (диссоциация молекул иода I2 -> 2I) или превращение в другую молекулу в результате внутримолекулярной перестройки:
Бимолекулярная реакция - это взаимодействие двух молекул (например, молекулярного водорода с молекулярным иодом, H2 + I2 (r) 2HI). Реакция, протекающая одновременно с участием трех молекул, называется тримолекулярной. Поскольку вероятность столкновения сразу трех молекул, да еще в правильной взаимной ориентации, очень мала, такие реакции происходят редко.
Механизм химических реакций. При изучении механизма любой химической реакции рассматривают столкновение между отдельными реагирующими частицами (классическая теория столкновений) и другие элементарные акты с участием этих частиц. Учитывается также взаимная пространственная ориентация (стереохимия) реагирующих молекул. Считается, что реакция проходит через образование промежуточного комплекса, и для установления ее механизма необходимо знать состав и геометрию этого комплекса - межатомные расстояния и валентные углы. Реакции, называемые цепными, протекают через последовательность стадий. Продолжение цепи инициируют высокоэнергетические атомы или свободные радикалы. Рассмотрим фотохимическую реакцию образования хлороводорода. Под действием света молекула хлора распадается с образованием атомарного хлора. Атомы хлора реагируют с молекулой водорода с образованием HCl и атомарного водорода. Последний реагирует с молекулой хлора, вновь образуя HCl и высвобождая атом хлора:
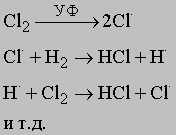
(точкой в верхнем индексе обозначается неспаренный электрон в валентной оболочке атомов; этим подчеркивается, что атомы и являются высокоактивными свободными радикалами). Иногда эта цепь взаимодействий продолжается до тех пор, пока не прореагируют более миллиона молекул на каждый образовавшийся при фотодиссоциации атом хлора. Если два атома, ответственные за рост цепи (и ),прореагируют друг с другом с образованием НCl или если один из них потеряет энергию в результате столкновений со стенками реактора либо с посторонними частицами, цепь прервется. Важным параметром, определяющим скорость газофазных реакций, является число столкновений между молекулами в единицу времени, которые имеют подходящую ориентацию и обладают достаточной для вступления в реакцию энергией. Частота и энергия соударений зависят от размера частиц и их средней скорости. В качестве иллюстрации того, как с помощью кинетических данных можно получить информацию о механизме химических реакций, рассмотрим образование HI и HBr: H2 + I2 = 2HI и H2 + Br2 = 2HBr
Стехиометрические уравнения этих реакций идентичны. Однако кинетические измерения скоростей реакций показывают, что их механизмы совершенно различны. Для первой реакции, в которой происходит столкновение молекул водорода и иода, увеличение концентрации HI во времени определяется уравнением d[[HI]]/dt = k[[H2]][[I2]] где [[H2]] и [[I2]] - молярные концентрации водорода и иода, k - константа скорости реакции. В то же время, как показывают кинетические измерения, увеличение во времени концентрации HBr следует уравнению
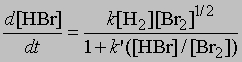
где [[H2]], [[Br2]] и [[HBr]] - молярные концентрации водорода, брома и бромоводорода, k и k' - константы. Реакция идет по цепному механизму, аналогичному тому, в соответствии с которым реагируют между собой хлор и водород с образованием хлороводорода: Br2 = 2Br, Br + H2 = HBr + H, H + Br2 = HBr + Br и т.д.
Выражение для скорости полной реакции можно получить, используя уравнения скоростей каждой из ее стадий. Температурные коэффициенты скоростей реакций. В диапазоне температур, близких к комнатной, скорость многих реакций удваивается или утраивается при повышении температуры на каждые 10°. С.Аррениус предложил следующее уравнение, описывающее зависимость константы скорости реакции от температуры: k = s exp(-DHa/RT)
Предэкспоненциальный множитель s называется аррениусовским частотным фактором и в бимолекулярной реакции определяется частотой столкновений молекул, которые имеют подходящую ориентацию для того, чтобы вступить в химическое взаимодействие, DНа - теплота (или энтальпия) активации, R - универсальная газовая постоянная [[1,987 кал/(град*моль), если DНа выражается в кал/моль]]. DНа равна кинетической энергии, которой должны обладать сталкивающиеся частицы, чтобы преодолеть их взаимное отталкивание и образовать продукты. Уравнение Аррениуса можно записать в дифференциальной форме:
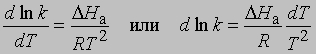
Интегрирование в предположении, что DНа не зависит от Т, дает
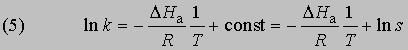
откуда
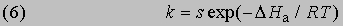
Интегрирование в предположении независимости DНа от Т дает
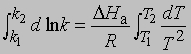
или
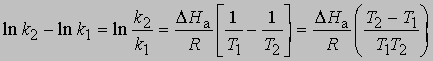
Из уравнения (5) следует, что график зависимости ln k от 1/Т является прямой с наклоном -DНа/R, откуда DНа можно определить как -RЧs (где s - тангенс наклона прямой). Используя данное значение DНа и значение k при одной температуре, можно найти частотный фактор и затем рассчитать k при любой другой температуре из температурного диапазона, в котором сохраняется постоянной величина DНа. Член ln s в уравнении Аррениуса можно также определить графически, экстраполяцией графика зависимости ln k от 1/T к 1/Т = 0. В этой точке ln k = ln s (рис. 2).
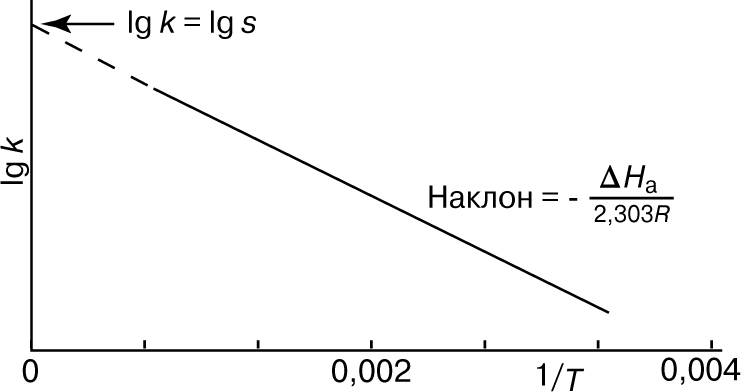
Рис. 2. ГРАФИК ЗАВИСИМОСТИ логарифма k от 1/Т.
Экспоненциальный член exp(-DНа/RT) в уравнении (6) равен доле молекул с энтальпией , т.е. молекул, обладающих достаточной энергией, чтобы вступить в реакцию. Для бимолекулярных реакций аррениусовский частотный фактор можно представить как число столкновений в единицу времени в единице объема между молекулами, имеющими нужную ориентацию. Таким образом, k определяется числом столкновений химически активных и ориентированных нужным образом молекул. В рамках теории абсолютных скоростей реакций (или термодинамической теории) частотный фактор можно представить как
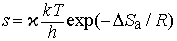
где x - трансмиссионный коэффициент, представляющий собой долю молекул, энергия которых превышает энергетический барьер на пути перехода от реагентов к продуктам, k - константа Больцмана, h - постоянная Планка, DSа - энтропия активации на моль реагента. DSа является мерой относительного числа степеней свободы молекул в активированном и исходном состояниях (т.е. числа независимых типов колебаний и вращений). Для некоторых мономолекулярных газофазных реакций распада активированный комплекс настолько близок по своей структуре к исходным реагентам, что изменение энтропии очень мало, т.е. DSа можно принять равным нулю. В этих случаях
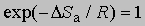
,
и если x = 1, то константа скорости реакции определяется выражением
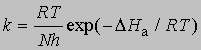
При 27° С (300 К)
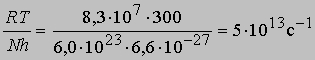
(N - число Авогадро). Отсюда получаем приближенное уравнение для мономолекулярных реакций:
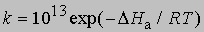
и менее точное уравнение для бимолекулярных реакций:
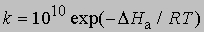
где 10 10 в первом приближении равно числу столкновений молекул при комнатной температуре, если концентрации выражены в моль/л.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Обратимость и равновесие. Обратимая химическая реакция - это реакция, в ходе которой происходят превращения как в прямом, так и в обратном направлениях. Первым, кто четко сформулировал представление об обратимости химических реакций, был К.Бертолле (1799). Участвуя в Египетской экспедиции Бонапарта, он обратил внимание на образование карбоната натрия в соляных озерах и пришел к заключению, что карбонат натрия образуется в результате взаимодействия между насыщенным раствором хлорида натрия и растворенным карбонатом кальция. Этот процесс обратен проводимой в лаборатории реакции между карбонатом натрия и растворенным хлоридом кальция с образованием карбоната кальция. В 1864 К.Гульдберг и П.Вааге открыли закон действующих масс, согласно которому скорость химической реакции прямо пропорциональна концентрации реагирующих веществ. Положение равновесия можно определить, зная скорости прямой и обратной реакций. Уравнение обратимой реакции имеет вид
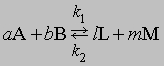
Если СА, СВ, СL и СМ - молярные концентрации веществ А, В, L и М; а, b, l и m - соответствующие стехиометрические коэффициенты, k1 и k2 - константы скорости прямой и обратной реакций, то
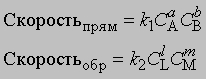
В равновесии скорости прямой и обратной реакций равны:
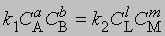
и
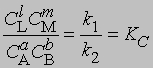
где С - равновесная концентрация соответствующего вещества, KС - константа химического равновесия, выраженная через концентрации. Более строгий подход к выводу выражения для константы равновесия основан на принципах термодинамики. Можно показать, что в условиях равновесия (при равновесных концентрациях реагентов и продуктов) стандартное изменение свободной энергии системы определяется уравнением
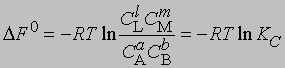
Поскольку DF0 при постоянной температуре является константой, то и KС тоже константа, равная
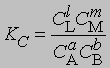
Для газофазных реакций константу равновесия можно выразить через парциальные давления реагентов:
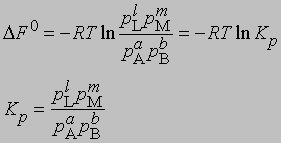
Представленная таким образом константа равновесия отличается от KС, выраженной через молярные концентрации, соответственно различаются и DF0 для этих двух случаев. Поясним, что такое изменение свободной энергии DF0 в ходе химической реакции. При постоянных температуре и давлении уменьшение свободной энергии является максимальной работой, которую можно совершить в ходе процесса, причем эта работа не связана с изменением объема или давления в системе. Стандартное изменение свободной энергии DF0 равно разности свободных энергий реагентов и продуктов в стандартных состояниях. Такое состояние для идеального газа - давление 1 атм, а для твердых веществ или жидкостей - их наиболее стабильная форма при давлении 1 атм и определенной температуре. Для идеального растворенного вещества стандартным является состояние при концентрации 1 моль на 1000 г растворителя (моляльная концентрация). Для газофазных реакций KС можно связать с Kр, используя уравнение состояния идеального газа: C = 1/V = p/RT
где V - объем, занимаемый одним молем газа, R - газовая постоянная, Т - абсолютная температура,
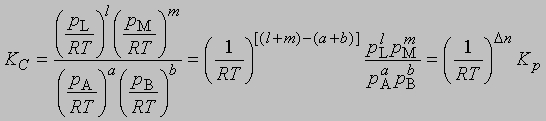
где Dn = (l + m) - (a + b) разность между суммой молей продуктов реакции и суммой молей исходных реагентов; эта разность определяется коэффициентами стехиометрического уравнения реакции. Следует иметь в виду, что DF0 - это разность свободных энергий реагентов и продуктов в их стандартных состояниях, а именно при концентрации растворенных веществ 1 М и давлении газов 1 атм, а рассчитывается эта разность свободных энергий по данным для равновесных концентрации и давления.
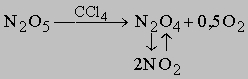
Равновесие в газофазных системах. Рассмотрим диссоциацию N2O4 (тетраоксид диазота) на две молекулы диоксида азота (NО2). Мол. масса N2O4 равна 92; это бурый газ с т. кип. 21,3° С. При нагревании цвет газа меняется до черного. При температуре 140° С происходит полная диссоциация N2O4 на NO2 с мол. массой 46 в соответствии с уравнением

Пусть a - мольная доля газа, подвергшегося диссоциации, а из каждого моля получается n молей газообразных продуктов; тогда общее число молей газа будет равно 1 - a + na = 1 + (n - 1)a
Плотность данной массы газа при постоянном давлении обратно пропорциональна числу молей. Обозначим через d1 плотность недиссоциированного газа, а через d2 - плотность смеси исходного и диссоциированного газа при том же давлении. Тогда
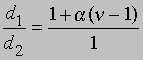
и
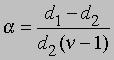
Заменив плотности на мол. массы, получим
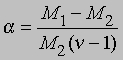
где М1 - мол. масса недиссоциированного газа, М2 - средняя мол. масса смеси исходного и диссоциированного газа. Поскольку для данной реакции n = 2 и общее число молей газа в смеси равно 1 - a + 2a = 1 + a, парциальные давления N2O4 и NO2 равны соответственно
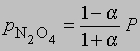
и
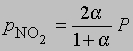
где Р - суммарное давление. Теперь
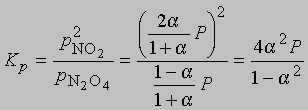
Если доля диссоциированного газа при 75° С равна 0,741 и суммарное давление 1 атм, то
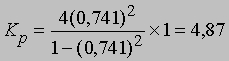
Отметим, что при повышении суммарного давления степень диссоциации будет уменьшаться в соответствии с уравнением (7) и принципом Ле Шателье, согласно которому система стремится сохранить состояние, в котором она находится, в противовес любым внешним воздействиям. Приведем в качестве примера несколько изученных газофазных реакций: N2 + 3H2 2NH3 H2 + I2 2HI N2 + O2 2NO CO2 + H2 CO + H2O В последних трех случаях изменение давления в системе не повлияет на ход реакции, поскольку число молекул исходных соединений и продуктов одинаково. Однако в первом случае при повышении давления будет наблюдаться ускорение процесса - образование большего количества продукта.
Равновесие в гомогенной жидкой системе. Одним из типичных примеров обратимой реакции в гомогенной жидкой системе является реакция между уксусной кислотой и этиловым спиртом с образованием этилацетата и воды:
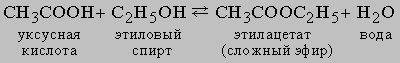
Константа равновесия KС этой реакции равна
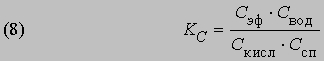
Если а молей кислоты и b молей спирта в смеси с l молями этилацетата и m молями воды образуют раствор объемом v и если x молей кислоты и x молей спирта дают x молей этилацетата и x молей воды, то можно записать уравнение (8) в следующем виде:
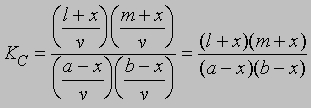
Разные электролиты диссоциируют в полярных растворителях в разной степени (см. ЭЛЕКТРОЛИТЫ). Для определения степени диссоциации электролитов чаще всего применяют достаточно простой и точный метод, основанный на измерении их электропроводности. Согласно Аррениусу, степень диссоциации электролита равна
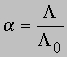
где A - эквивалентная электропроводность (т.е. проводимость, соответствующая одному "молю" заряда) электролита, концентрацию которого хотят определить, L0 - эквивалентная электропроводность электролита при бесконечном разбавлении, когда он полностью диссоциирован. Зная концентрацию и степень диссоциации, можно определить константу ионизации (для кислот - константу протолиза) слабого электролита. Обычно ионизация или диссоциация подавляется при добавлении в среду избытка продукта диссоциации. Кислота, образующаяся при захвате протона данным основанием, называется кислотой, сопряженной с этим основанием; соответственно основание, образующееся при отдаче протона данной кислотой, называется основанием, сопряженным с этой кислотой. Представим протолиз (или ионизацию кислоты в воде) как взаимные превращения сопряженных кислот и оснований: HA + H2O H3O+ + A-где НА и А- сопряженные кисло
Хими́ческая промы́шленность - объединяет ряд подотраслей: горно-химическую, основную химическую промышленность, промышленность минеральных удобрений, полимерных материалов (производство синтетического каучука, синтетических смол и пластических масс, химических волокон), синтетических красителей, промышленность бытовой химии, лакокрасочную, резиноасбестовую, фотохимическую и химико-фармацевтическую.
* * *
ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ - ХИМИ́ЧЕСКАЯ ПРОМЫ́ШЛЕННОСТЬ, объединяет ряд подотраслей: горнохимическую, основную химическую промышленность, промышленность минеральных удобрений, полимерных материалов (производство синтетического каучука, синтетических смол и пластических масс, химических волокон), синтетических красителей, промышленность бытовой химии, лакокрасочную, резино-асбестовую, фотохимическую и химико-фармацевтическую.
ХИМИЧЕСКАЯ промышленность - объединяет ряд подотраслей: горнохимическую, основную химическую промышленность, промышленность минеральных удобрений, полимерных материалов (производство синтетического каучука, синтетических смол и пластических масс, химических волокон), синтетических красителей, промышленность бытовой химии, лакокрасочную, резино-асбестовую, фотохимическую и химико-фармацевтическую.
ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ - выработка кислот, щелочей, солей, эфирных масл, парфюмерных и фармацевтических товаров и пр.
Хими́ческая пропо́лка - уничтожение гербицидами сорняков в посевах и посадках культурных растений.
* * *
ХИМИЧЕСКАЯ ПРОПОЛКА - ХИМИ́ЧЕСКАЯ ПРОПО́ЛКА, уничтожение гербицидами сорняков в посевах и посадках культурных растений. Улучшает условия жизнедеятельности возделываемых растений, повышает урожайность. Перечень препаратов для химической прополки ежегодно утверждается Госагропромом СССР.
ХИМИЧЕСКАЯ ПРОПОЛКА - уничтожение гербицидами сорняков в посевах и посадках культурных растений. Улучшает условия жизнедеятельности возделываемых растений, повышает урожайность. Перечень препаратов для химической прополки ежегодно утверждается Госагропромом СССР.
реакция - взаимодействие атомов, сопровождающееся качественной перестройкой
их электронных оболочек;
превращение одних веществ в другие;
процесс, связанный с изменением состава молекул.
химическое явление.
реагент.
реагировать.
химическое уравнение. | разъедать. есть. едкий.
↓ химическая технология, ВЕЩЕСТВА
см. превращение
Хими́ческая связь - взаимодействие атомов, обусловливающее их соединение в молекулы и кристаллы. Химическая связь имеет в основном электромагнитный характер. При образовании химической связи происходит перераспределение электронной плотности связывающихся атомов. По характеру этого распределения химическую связь классифицируют на ковалентную, ионную, координационную, металлическую, водородную. По числу электронных пар, участвующих в образовании данной химической связи, различают простые (одинарные), двойные, тройные химические связи, по симметрии электронного распределения - Σ- и π-связи, по числу непосредственно взаимодействующих атомов - двух-, трёх- и многоцентровые.
* * *
ХИМИЧЕСКАЯ СВЯЗЬ - ХИМИ́ЧЕСКАЯ СВЯ́ЗЬ, взаимодействие атомов, обусловливающее их соединение в молекулы и кристаллы. Химическая связь имеет в основном электромагнитный характер. При образовании химической связи происходит перераспределение электронной плотности связывающихся атомов. По характеру этого распределения химические связи классифицируют на ковалентную, ионную, координационную, металлическую. По числу электронных пар, участвующих в образовании данной химической связи, различают простые (одинарные), двойные, тройные химические связи, по симметрии электронного распределения - и -связи, по числу непосредственно взаимодействующих атомов - двух-, трех- и многоцентровые.
ХИМИЧЕСКАЯ связь - взаимодействие атомов, обусловливающее их соединение в молекулы и кристаллы. Химическая связь имеет в основном электромагнитный характер. При образовании химической связи происходит перераспределение электронной плотности связывающихся атомов. По характеру этого распределения химические связи классифицируют на ковалентную, ионную, координационную, металлическую. По числу электронных пар, участвующих в образовании данной химической связи, различают простые (одинарные), двойные, тройные химические связи, по симметрии электронного распределения - и -связи, по числу непосредственно взаимодействующих атомов - двух-, трех- и многоцентровые.
ХИМИЧЕСКАЯ СВЯЗЬ, взаимодействие атомов, обусловливающее их соединение в молекулы и кристаллы. Действующие при образовании химической связи силы имеют в основном электрическую природу. Образование химической связи сопровождается перестройкой электронных оболочек связывающихся атомов. Основные типы химических связей: ковалентная, ионная, координационная, металлическая, водородная.
Хими́ческая термодина́мика - см. Термодинамика химическая.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - рассматривает взаимосвязи между работой и энергией применительно к химическим превращениям. Поскольку химическое превращение обычно сопровождается высвобождением или поглощением определенного количества теплоты, оно, как и другие явления природы (в том числе электрические и магнитные), сопровождающиеся тепловыми эффектами, подчиняется фундаментальным принципам (началам) термодинамики. Химическая термодинамика определяет, в первую очередь, условия (такие, как температура и давление) протекания химических реакций и равновесных состояний, которых они достигают. Анализ тепловых явлений базируется на трех фундаментальных принципах, подтвержденных данными многочисленных наблюдений.
См. также ТЕРМОДИНАМИКА. Первое начало термодинамики. Первое начало термодинамики по существу выражает закон сохранения энергии. Для системы, окруженной замкнутой границей, через которую не происходит переноса вещества, справедливо соотношение

где U1 и U2 - энергии системы в состояниях 1 и 2; Q - теплота, полученная от внешних источников; W - работа, совершенная системой над внешними телами в процессе, посредством которого система переходит из состояния 1 в состояние 2. Если процесс - химическая реакция, то обычно ее проводят в таких условиях, чтобы можно было отделить энергию химического превращения от энергии, связанной с одновременными изменениями температуры или давления. Поэтому энергию (теплоту) химической реакции обычно определяют в условиях, в которых продукты находятся при тех же температуре и давлении, что и реагенты. Энергия химической реакции тогда определяется теплотой Q, полученной от окружающей cреды или переданной ей. Измерение Q может быть проведено с помощью калориметра подходящего типа. Реакцию можно было бы провести, например, в металлическом сосуде, погруженном в теплоизолированный объем воды, изменение температуры которой (обычно на несколько градусов) соответствует теплоте реакции. Для количественных измерений калориметр обычно градуируют с помощью независимого электронагревателя или проведения в сосуде химической реакции, теплота которой известна. Медленные реакции особенно трудны для калориметрических измерений, поскольку нужны сложные меры предосторожности для защиты калориметра от теплообмена с окружающей средой. Так называемый адиабатический калориметр целиком погружается в изотермическую оболочку с независимым нагревом, температура которой во время опыта поддерживается как можно более близкой к температуре внутри калориметра. Реакции, высвобождающие теплоту (отрицательная Q в уравнении (1)), называются экзотермическими, а реакции, в процессе которых теплота поглощается, - эндотермическими. Как показывает уравнение (1), внутренняя энергия реагирующей системы определяется не только количеством высвобожденной или поглощенной теплоты. Она также зависит от того, сколько энергии система затрачивает или приобретает посредством произведенной работы. При постоянном давлении p полная работа, совершенная системой, описывается выражением p (V2 - V1) +We, где первый член - работа расширения, связанная с изменением объема от V1 до V2, а We - дополнительная, или т.н. "полезная", работа, совершенная системой помимо работы расширения. Если работа совершается над системой, то оба члена имеют отрицательный знак. Поэтому уравнение (1) можно преобразовать к виду
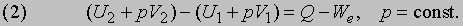
Вводят вспомогательную меру энергии системы Н, определяемую общим соотношением

Если давление постоянно (обычно в качестве стандартного берется давление 1 атм), то изменение функции Н, называемой энтальпией системы, отличается от изменения ее внутренней энергии на величину работы расширения:
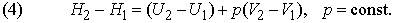
За исключением газофазных систем, это отличие пренебрежимо мало по сравнению с типичными тепловыми эффектами реакций. Однако для общего случая из формулы (2) следует, что теплота Q, измеренная при постоянном давлении и We = 0 (обычное условие протекания химической реакции, если она не происходит, например, в аккумуляторе или гальваническом элементе), равна изменению энтальпии системы:
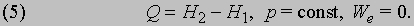
В любом случае, поскольку разность H2 - H1, как и U2 - U1, определяется, согласно первому началу термодинамики, исключительно начальным и конечным состояниями системы и не зависит от способа перехода из начального состояния в конечное, суммарное количество теплоты, поглощенное в процессе химического превращения при постоянных температуре и давлении (при We = 0), зависит только от исходных реагентов и конечных продуктов и не зависит от того, через какие промежуточные стадии протекает реакция. Этот вывод был сделан Г. И. Гессом в 1840 на основе экспериментальных фактов еще до классических опытов Джоуля, продемонстрировавших эквивалентность теплоты и других форм энергии. Гесс показал, что теплота реакции, протекающей через несколько последовательных стадий, равна алгебраической сумме теплот отдельных промежуточных реакций. Закон Гесса, как отметил Г.Гельмгольц в 1847, служит прямым экспериментальным подтверждением применимости закона сохранения энергии к энергетике химических реакций. В пределах ограничений, налагаемых уравнением (5), этот закон был многократно подтвержден многочисленными дальнейшими исследованиями.
Термохимические уравнения. Теплота, высвобождаемая или поглощаемая конкретной химической реакцией, пропорциональна степени превращения реагентов, определяемой по количеству любого из расходуемых либо образующихся продуктов. Изменение внутренней энергии или энтальпии реагирующей системы определяют по химическому уравнению реакции. Например, сгорание смеси газообразных метана и кислорода описывается термохимическим уравнением
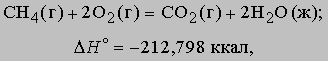
Здесь буквы в скобках обозначают агрегатные состояния веществ (газ или жидкость). Символом DH° обозначается изменение энтальпии в химическом превращении при стандартных давлении 1 атм и температуре 298 K (25° С) (знак градуса в верхнем индексе H указывает, что данная величина относится к веществам в стандартных состояниях (при p = 1 атм и T = 298 K)). Химическая формула каждого вещества в таком уравнении обозначает вполне определенное количество вещества, а именно его молекулярную массу, выраженную в граммах. Молекулярная масса получается сложением атомных масс всех элементов, входящих в формулу, с коэффициентами, равными числу атомов данного элемента в молекуле. Молекулярная масса метана равна 16,042, и, согласно предыдущему уравнению, при сгорании 16,042 г (1 моля) метана получаются продукты, энтальпия которых на 212,798 ккал меньше энтальпии реагентов. В соответствии с уравнением (5) такое количество теплоты высвобождается, когда 1 моль метана сгорает в кислороде при постоянном давлении 1 атм. Соответствующее уменьшение внутренней энергии системы в ходе реакции составляет 211,615 ккал. Разница между DH° и DU° равна -1,183 ккал и представляет работу p(V2 - V1), совершаемую, когда 3 моля газообразных реагентов сжимаются при давлении 1 атм до 1 моля газообразного диоксида углерода и 2 молей жидкой воды.
Стандартная теплота образования. Из закона сохранения энергии следует, что, когда вещество образуется из атомов и (или) более простых веществ, внутренняя энергия или энтальпия системы меняется на определенную величину, называемую теплотой образования данного вещества. Теплота образования может быть определена различными способами, в том числе прямыми калориметрическими измерениями и путем косвенного расчета (на основе закона Гесса) из теплоты реакции, в которой участвует данное вещество. При проведении расчетов пользуются стандартными (при p = 1 атм и T = 298 K) теплотами образования веществ, входящих в уравнение реакции. Например, стандартную теплоту (энтальпию) образования метана можно вычислить с помощью термохимического уравнения
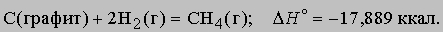
Хотя эта реакция практически неосуществима при 25° С, стандартная теплота образования метана косвенно рассчитывается по измеренным теплотам сгорания метана, водорода и графита. На основе закона Гесса устанавливается, что теплота реакции равна разности между теплотами сгорания веществ, указанных в левой части уравнения, и теплотами сгорания веществ, указанных в правой части уравнения реакции (взятых с соответствующими знаками и стехиометрическими коэффициентами). Помимо использования термохимических данных для решения проблем практического использования тепловой энергии, они широко применяются при теоретической оценке энергий химических связей. Этот вопрос подробно рассмотрен Л.Полингом в книге Природа химической связи (The Nature of the Chemical Bond, 1960).
Второе начало термодинамики. Второе начало термодинамики по существу определяет однонаправленность переноса теплоты в разнообразных процессах, происходящих спонтанно при определенных условиях, а именно - направление переноса теплоты от тел с высокой температурой к телам с низкой температурой. Второе начало термодинамики может быть сформулировано следующим образом: не может быть спонтанного общего переноса теплоты от тел менее нагретых к телам более нагретым. Перенос теплоты Q от источника с температурой Т можно охарактеризовать величиной Q/T. Для любого спонтанного процесса переноса теплоты, при котором источник с температурой Т1 отдает количество теплоты Q1, а в результате переноса система с температурой Т2 получает количество теплоты Q2, справедливо неравенство Клаузиуса Q1/Т1 Ј Q2 /Т2 . Таким образом, для того чтобы мог происходить перенос теплоты, Т1 должна быть больше Т2. Для перехода системы из одного состояния в другое более общая формулировка второго начала термодинамики гласит, что направление переноса теплоты определяется условием
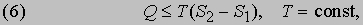
где S2 - S1 - разность энтропий системы в двух состояниях. Если скомбинировать это условие с уравнениями (2) и (3), получим соотношение, имеющее важное значение для описания химической реакции при постоянных температуре и давлении:
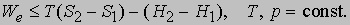
Если ввести функцию состояния системы

то формулировка второго начала термодинамики примет следующую форму:
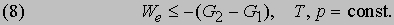
Это значит, что для системы, находящейся при постоянных температуре и давлении, могут происходить только такие переходы из одного состояния в другое, для которых полезная работа We не превышает определенной максимальной величины, равной разности DG двух значений G. Если G1 > G2, то переход из состояния 1 в состояние 2 (скажем, от реагентов к продуктам) может происходить самопроизвольно даже при We = 0. Если G2 больше G1, то переход из состояния 1 в состояние 2 может быть осуществлен только за счет внешней полезной работы; это значит, что работа We должна быть отрицательной величиной, как, например, электрическая энергия, затрачиваемая при электролитическом разложении воды. Если G1 = G2, то система находится в равновесии. Функция G называется гиббсовой энергией, или изобарно-изотермическим потенциалом. Разнообразными методами было показано, что величина DG°, "стандартная гиббсова энергия образования", по аналогии со стандартной энтальпией образования может быть определена для химических соединений относительно элементов из данных по химическим равновесиям и химическим процессам. Стандартная гиббсова энергия образования DG°, характеризующая какую-либо химическую реакцию, может быть установлена с помощью таблиц стандартных гиббсовых энергий образования путем вычитания суммы их значений для реагентов из суммы значений для продуктов. Значения DG° для чистых химических элементов при 25° С и давлении 1 атм принимаются равными нулю. Стандартная гиббсова энергия химической реакции по существу является мерой того, насколько реагенты и продукты далеки от равновесия друг с другом при данной температуре и стандартном давлении 1 атм. Согласно второму началу термодинамики, все самопроизвольные изменения системы и ее окружения стремятся привести их в конечное состояние равновесия. Следовательно, именно изменение гиббсовой энергии, а не изменение энтальпии или внутренней энергии определяет возможность протекания химической реакции. В частности, от изменения гиббсовой энергии в ходе химической реакции зависит разность потенциалов между электродами химических источников тока. Стандартное изменение гиббсовой энергии связано со стандартным изменением энтальпии, согласно (7), соотношением
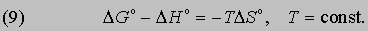
Можно показать, что функциональная связь между DG° для данной химической реакции и константой равновесия К, определяемой законом действующих масс, имеет вид
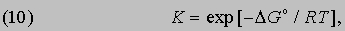
где R - универсальная газовая постоянная, равная 1,987Ч10-3 ккал/(KЧмоль). С учетом формулы (9) это соотношение можно представить в эквивалентной форме:
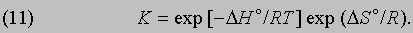
Таким образом, константа равновесия состоит из двух множителей, один из которых содержит энтальпию реакции (или, при определенных условиях, внутреннюю энергию реакции), а другой - энтропию.
См. также ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ. Важное следствие общей термодинамической теории состоит в том, что можно вывести уравнение, связывающее зависимость DG° (и следовательно, К) от температуры со значением DH°. Поэтому можно точно установить направление и равновесное состояние химической реакции при одной температуре из известных данных по химическому равновесию при другой температуре. В частности, изменение DG° с температурой пропорционально величине DH° и имеет противоположный знак. Так, все эндотермические реакции (DH° положительна) ускоряются (большая отрицательная величина DG° и большее значение К) с ростом температуры. Соответственно все экзотермические реакции замедляются с ростом температуры.
Третье начало термодинамики. Еще один важный принцип химической термодинамики был установлен в первой четверти 20 в. В. Нернстом. Он экспериментально установил, что, когда температура приближается к абсолютному нулю, стандартные энтропии DS° для многих химических реакций стремятся к нулю. Поскольку этот результат не следует из первого и второго начал термодинамики, он получил название третьего начала термодинамики. Оно не имеет столь же общего характера, как первые два начала, однако большинство очевидных исключений или аномалий получило удовлетворительное объяснение с учетом особенностей кристаллического строения конкретных веществ. Значение принципа Нернста состоит в том, что зависимость энтропии реакции от температуры может быть выведена, согласно термодинамической теории, исключительно из данных по теплоемкости для отдельных участвующих в реакции веществ. Это значит, что, если известно значение DS° при какой-либо одной температуре (при T = 0 DS° = 0), значения энтропии реакции при других температурах вычисляются исключительно из тепловых измерений. Аналогично этому, величина DH° может быть получена из калориметрических данных путем непосредственного измерения теплоты данной реакции либо косвенно, путем измерения теплот других реакций и применения закона Гесса. Следовательно, подстановка полученных значений DH° и DS° в уравнение (9) или (11) дает гиббсову энергию или константу химического равновесия исключительно из тепловых измерений. Это позволяет предвидеть направление и равновесное состояние химической реакции еще до того, как найден способ ее проведения. Для практического применения третьего начала термодинамики требуются точные результаты измерений теплоемкости вплоть до самых низких доступных температур, желательно до температуры жидкого гелия (около 4 К). Это направление термодинамических исследований химических явлений стимулировали криогенные исследования, выполненные в последние десятилетия.
См. также ФИЗИКА НИЗКИХ ТЕМПЕРАТУР.
ЛИТЕРАТУРА
Исаев С.И. Курс химической термодинамики. М., 1975 Киреев В.А. Методы практических расчетов в термодинамике химических реакций. М., 1975 Еремин Е.Н. Основы химической термодинамики. М., 1978 Термодинамика и кинетика химических процессов. Л., 1981 Глазов В.М., Павлова Л.М. Химическая термодинамика и фазовые равновесия. М., 1988
Хими́ческая техноло́гия - наука о методах и средствах рациональной химической переработки сырья, полуфабрикатов и промышленных отходов. Неорганичная химическая технология включает переработку минерального сырья (кроме металлических руд), получение кислот, щёлочей, минеральных удобрений; органичная химическая технология - переработку нефти, угля, природного газа и других горючих ископаемых, получение синтетических полимеров, красителей, лекарственных средств и др. Теоретические основы химической технологии - химия, физика, механика, математика (в частности, математическое моделирование). Современная химическая технология характеризуется созданием агрегатов большой единичной мощности, освоением процессов, в которых используются сверхвысокие и сверхнизкие температуры и давления, применением высокоэффективных катализаторов, получением веществ с необычными ценными свойствами (сверхчистых и сверхтвёрдых, жаростойких и жаропрочных и др.).
* * *
ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ - ХИМИ́ЧЕСКАЯ ТЕХНОЛО́ГИЯ, наука о методах и средствах рациональной химической переработки сырья, полуфабрикатов и промышленных отходов. Неорганическая химическая технология включает переработку минерального сырья (кроме металлических руд), получение кислот, щелочей, минеральных удобрений; органическая химическая технология - переработку нефти, угля, природного газа и др. горючих ископаемых, получение синтетических полимеров, красителей, лекарственных средств и др. Теоретические основы химической технологии - химия, физика, механика, математика (в частности, математическое моделирование). Современная химическая технология характеризуется созданием агрегатов большой единичной мощности, освоением процессов, в которых используются сверхвысокие и сверхнизкие температуры и давления, применением высокоэффективных катализаторов, получением веществ с необычными ценными свойствами (сверхчистых и сверхтвердых, жаростойких и жаропрочных и др.).
ХИМИЧЕСКАЯ технология - наука о методах и средствах рациональной химической переработки сырья, полуфабрикатов и промышленных отходов. Неорганическая химическая технология включает переработку минерального сырья (кроме металлических руд), получение кислот, щелочей, минеральных удобрений; органическая химическая технология - переработку нефти, угля, природного газа и др. горючих ископаемых, получение синтетических полимеров, красителей, лекарственных средств и др. Теоретические основы химической технологии - химия, физика, механика, математика (в частности, математическое моделирование). Современная химическая технология характеризуется созданием агрегатов большой единичной мощности, освоением процессов, в которых используются сверхвысокие и сверхнизкие температуры и давления, применением высокоэффективных катализаторов, получением веществ с необычными ценными свойствами (сверхчистых и сверхтвердых, жаростойких и жаропрочных и др.).
↑ использующий, химическая реакция
смолокурение. смолокурня.
обжиг.
отжиг. отжечь.
обезжирить.
реактор.
абсорбер.
адсорбер.
газогенератор.
пирогенизация.
пиролиз.
крекинг.
озонатор. озонировать.
хлоратор.
карбонизация. | элюирование.
выщелачивание. | этерификация.
мыловарение.
плавка. плавильный.
выплавка (# стали). выплавлять.
шихта.
галургия.
Хими́ческая фи́зика - раздел науки, пограничный между химией и физикой. Изучает электронную структуру молекул и твердых тел, молекулярные спектры, элементарные акты химических реакций, процессы горения и взрыва и др. с использованием методов теоретической и экспериментальной физики (оптическая и радиоспектроскопия, рентгеновский структурный анализ, масс-спектрометрия и др.). Сформировалась в конце 20-х - начале 30-х гг. XX в. в связи с развитием квантовой механики и использованием её представлений в химии. Граница между химической физикой и физической химией условна. Термин введён немецким химиком А. Эйкеном (А. Euken) в 1930.
* * *
ХИМИЧЕСКАЯ ФИЗИКА - ХИМИ́ЧЕСКАЯ ФИ́ЗИКА, раздел науки, пограничный между химией и физикой. Изучает электронную структуру молекул и твердых тел, молекулярные спектры, элементарные акты химических реакций, процессы горения и взрыва и др., с использованием методов теоретической и экспериментальной (оптическая и радиоспектроскопия, рентгеновский структурный анализ, масс-спектрометрия и др.) физики. Сформировалась в кон. 20-х - нач. 30-х гг. 20 в. в связи с развитием квантовой механики и использованием ее представлений в химии. Сейчас граница между химической физикой и физической химией условна. Термин введен немецким химиком А. Эйкеном в 1930.
-----------------------------------
«Хими́ческая фи́зика» - ежемесячный научный журнал РАН, с 1982. Москва. Учредители (1998) - Отделение общей и технической химии РАН, Институт химической физики РАН.
ХИМИЧЕСКАЯ ФИЗИКА - раздел науки, пограничный между химией и физикой. Изучает электронную структуру молекул и твердых тел, молекулярные спектры, элементарные акты химических реакций, процессы горения и взрыва и др., с использованием методов теоретической и экспериментальной (оптическая и радиоспектроскопия, рентгеновский структурный анализ, масс-спектрометрия и др.) физики. Сформировалась в кон. 20-х - нач. 30-х гг. 20 в. в связи с развитием квантовой механики и использованием ее представлений в химии. Сейчас граница между химической физикой и физической химией условна. Термин введен немецким химиком А. Эйкеном в 1930.
ХИМИЧЕСКАЯ ФИЗИКА, изучает электронную структуру молекул и твёрдых тел, элементарные акты химических реакций, процессы горения, взрыва и др. с использованием методов теоретической и экспериментальной физики. Сформировалась в конце 20-х - начале 30-х гг. 20 в. Существенный вклад в её развитие внесли Н.Н. Семёнов (СССР), С. Хиншелвуд (Великобритания) и др. Термин "химическая физика" предложен немецким химиком А. Эйкеном в 1930.
Хими́ческая фо́рмула - см. Формула химическая.
* * *
ХИМИЧЕСКАЯ ФОРМУЛА - ХИМИ́ЧЕСКАЯ ФО́РМУЛА, см. Формула химическая (см. ФОРМУЛА ХИМИЧЕСКАЯ).
нареч. качеств.-обстоят.
1. С точки зрения химического состава какого-либо вещества.
2. В соответствии с законами и принципами химии [химия I 1.].
3. Химическим путём.
Хими́ческие войска́ - специальные войска для обеспечения действий войск (сил) в операции (бою) в условиях радиоактивного, химического и биологического заражения. Состоят из подразделений и частей радиационной и химической разведки, специальной обработки и др.
* * *
ХИМИЧЕСКИЕ ВОЙСКА - ХИМИ́ЧЕСКИЕ ВОЙСКА́, специальные войска для обеспечения действий войск (сил) в операции (бою) в условиях радиоактивного, химического и биологического заражения. Состоят из подразделений и частей радиационной и химической разведки, специальной обработки и др.
ХИМИЧЕСКИЕ ВОЙСКА - специальные войска для обеспечения действий войск (сил) в операции (бою) в условиях радиоактивного, химического и биологического заражения. Состоят из подразделений и частей радиационной и химической разведки, специальной обработки и др.
Хими́ческие зна́ки - см. Знаки химические.
* * *
ХИМИЧЕСКИЕ ЗНАКИ - ХИМИ́ЧЕСКИЕ ЗНА́КИ, см. Знаки химические (см. ЗНАКИ ХИМИЧЕСКИЕ).
ХИМИЧЕСКИЕ ЗНАКИ - см. Знаки химические.
ХИМИЧЕСКИЕ ЗНАКИ - см. ХИМИЧЕСКИЕ ФОРМУЛЫ.
Хими́ческие исто́чники све́та (хемилюминесцентные источники света), устройства, генерирующие свет при протекании химической реакции (например, каталитические реакции некоторых эфиров щавелевой кислоты с пероксидом водорода в присутствии люминофора). Используют для сигнализации, при проведении аварийно-спасательных работ и др.
Хими́ческие исто́чники то́ка - устройства, вырабатывающие электрическую энергию за счёт окислительно-восстановительной реакции, протекающей на электродах. Различают химические источники тока однократного действия - гальванические элементы, многократного - аккумуляторы и с непрерывной подачей реагентов на электроды - топливные элементы. Применяются в электрических, электронных и радиоустройствах, измерительных приборах, на транспортных средствах, в бытовой технике, научно-исследовательской аппаратуре и др. Производство исчисляется миллиардами штук в год.
Равновесие. Вещества вступают в химические реакции потому, что при этом уменьшается энергия системы, т.е. электронная конфигурация продуктов реакции оказывается энергетически более выгодной, чем конфигурация исходных реагентов. (Правда, есть еще один фактор - энтропийный;
см. также ТЕРМОДИНАМИКА.)
При большой разности энергий (т.е. большом различии в стабильности исходных реагентов и продуктов) реакция происходит мгновенно. Например, если кислород и водород смешать в определенном соотношении и смесь поджечь, то газы прореагируют мгновенно без остатка с образованием воды:
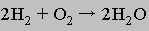
Молекула воды стабильнее, чем смесь водорода и кислорода, поскольку прочность двух связей О-Н больше, чем суммарная прочность связей Н-Н и О-О. Прочность связи определяется той энергией, которая выделяется при ее образовании.
См. также
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. Если разность энергий исходных реагентов и конечных продуктов химической реакции невелика, то в реакционной смеси присутствуют в заметных количествах и те, и другие, причем по прошествии определенного времени между ними устанавливается равновесие. В качестве примера можно привести растворение уксусной кислоты в воде:
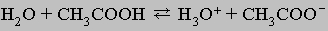
(Атомы водорода в группе СН3 соединены с атомом углерода прочными ковалентными связями и не являются кислотными.) Полной ионизации уксусной кислоты в этой реакции не происходит: когда примерно 1% ее молекул диссоциирует на ионы, скорость соединения последних с образованием исходных молекул становится равной скорости диссоциации и концентрация частиц в растворе перестает меняться. Устанавливается т.н. динамическое равновесие. Положение равновесия можно изменить (сдвинуть), добавляя или удаляя любое из веществ, участвующих в реакции. При этом равновесие сдвигается таким образом, чтобы эффект изменения концентрации был минимальным (принцип Ле Шателье).
Таким образом, добавление воды вызывает дополнительную ионизацию уксусной кислоты (поскольку при ионизации некоторое количество воды связывается в H3O+), а добавление ацетат-иона (СН3СОО-) дает обратный эффект. Каждая равновесная реакция характеризуется т.н. константой равновесия - величиной, равной отношению произведения концентраций продуктов к произведению концентраций исходных реагентов; при этом каждая из концентраций берется в степени, равной числу молекул данного типа, участвующих в реакции. Константа равновесия, как правило, не зависит от концентрации, но изменяется с температурой.
Кинетика. Скорости химических реакций сильно различаются. Например, смесь водорода и кислорода после того, как ее подожгут, буквально взрывается, а превращение алмаза в химически более устойчивую кристаллическую форму углерода, графит, происходит так медленно, что не завершается и за миллиарды лет. Скорость химических реакций определяется их механизмом. Многие реакции в действительности гораздо сложнее, чем это кажется из их суммарного уравнения. Так, оказалось, что разложение озона с образованием кислорода протекает в два этапа. На первом этапе диссоциирует одна молекула озона, при этом быстро достигается равновесие:
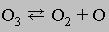
Второй этап гораздо более медленный, он и определяет скорость реакции:
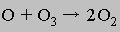
Сложение этих двух уравнений приводит к суммарному уравнению
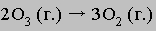
Не исключено, что впоследствии будут предложены другие механизмы, удовлетворяющие экспериментальным данным о скорости этой реакции. Наименьшая энергия, которой должны обладать взаимодействующие частицы для того, чтобы между ними началась химическая реакция, называется энергией активации. Как правило, чем она ниже, тем быстрее протекает реакция. Для протекания реакции большое значение имеет также энтропийный фактор.
Типы реакций. Реакции можно классифицировать, используя несколько схем, и каждая из них по-своему удобна. Здесь реакции разделены на три типа: ионные, в ходе которых ионы удаляются из зоны реакции путем образования нерастворимого, газообразного или ковалентно связанного продукта; окислительно-восстановительные, в которых происходит перемещение электронов; реакции (в том числе реакции между кислотой Льюиса и основанием Льюиса), сопровождающиеся перераспределением обобществленных электронов.
Ионные реакции. Простые ионные реакции без переноса электронов происходят, когда один из продуктов нерастворим (газ или твердое вещество) или является ковалентно связанным веществом, остающимся в растворе. Ионную реакцию, продукт которой - нерастворимое твердое вещество, можно представить в виде
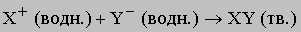
Сами ионы в ходе реакции не претерпели никаких изменений, но теперь они прочно удерживаются в кристаллической решетке. Для предсказания хода таких реакций важно знать растворимость участвующих в них веществ. Например, хлорид серебра плохо растворяется в воде, и можно сделать вывод, что реакция
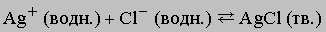
хотя и обратима, но равновесие сильно сдвинуто вправо. (Эту реакцию используют для обнаружения ионов хлора или серебра в растворе, а также для их количественного определения.
См. также ХИМИЯ АНАЛИТИЧЕСКАЯ.)
Ионы серебра могут находиться в составе любого из растворимых соединений: в виде нитрата, сульфата, ацетата и т.д.; ионы хлора могут быть компонентами таких солей, как соли натрия, калия, бария или алюминия. Таким образом, приведенное выше уравнение можно рассматривать как обобщенное представление реакции обменного разложения, когда два реагента разлагаются и обмениваются своими составляющими. Например, это могут быть такие реакции:
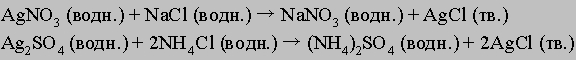
При образовании газообразного продукта вещество тоже выводится из зоны реакции. Этот тип ионной реакции можно представить в следующем виде:
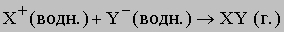
В данном случае ионы перестают существовать - из них образуются молекулы. В качестве примера можно привести растворение карбоната в кислом растворе. Вместе с образующимся газообразным диоксидом углерода из реакционной смеси уходят углерод и кислород:
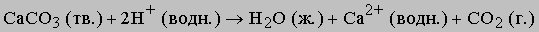
Реакции, в которых образуется ковалентно связанный (недиссоциирующий) продукт, можно представить следующим образом:
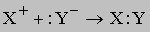
К этому типу относятся реакции нейтрализации. Когда соединение, которое диссоциирует с образованием ионов водорода (кислота), взаимодействует с основанием (источником гидроксильных ионов), образуется вода. В молекуле воды все атомы соединены ковалентными связями, поэтому реакция идет практически до конца (ее константа равновесия равна 10-14). Реакцию нейтрализации можно записать в виде
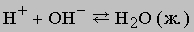
Приведем примеры реакций нейтрализации с участием сильной (HCl) и слабой (CH3COOH) кислот:
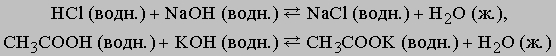
Сильные кислоты практически полностью диссоциируют в воде, высвобождая ионы водорода, слабые диссоциируют незначительно. Плохо диссоциируют и слабые основания. Ниже перечислены наиболее распространенные кислоты и основания. Отметим, что некоторые соединения обладают как кислотными, так и основными свойствами. Их называют амфотерными.
Слабые основания, представленные в таблице, не содержат ионов ОН-. Эти ионы образуются при взаимодействии с водой:
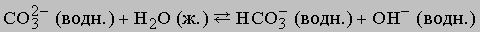
Поэтому раствор карбоната щелочной. Более общее определение кислот и оснований, которое используется и в случае неводных систем, например газов, было дано американским физикохимиком Г.Льюисом. Взаимодействие между льюисовыми кислотами и основаниями - это реакция между донором электронной пары, за счет которой образуется ковалентная связь (основание Льюиса), и акцептором этой пары (кислота Льюиса). В качестве примера можно привести следующие реакции:
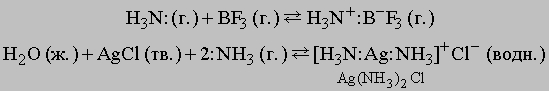
Окислительно-восстановительные реакции. Эти реакции сопровождаются переносом электронов между ионами, атомами или соединениями и могут быть представлены следующим образом:
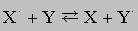
О соединении, которое отдает электроны, говорят, что оно окисляется; его называют восстановителем. Соединение, принимающее электроны, восстанавливается и является окислителем. Наиболее распространенные примеры окисления - реакции с участием элементного кислорода, например ржавление железа или горение любых горючих веществ. Уравнение горения магния имеет вид
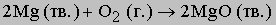
Примером окислительно-восстановительной реакции, протекающей без участия кислорода, является взаимодействие металлического натрия с газообразным хлором:
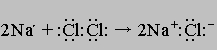
Этот способ написания уравнения показывает, что оба элемента по окончании реакции приобретают электронную конфигурацию инертного газа (на их внешних электронных оболочках - по 8 электронов). Направление этой реакции можно изменить на противоположное, приложив электрическое напряжение. Если пару электродов (графитовых стержней) погрузить в расплав хлорида натрия и соединить с источником постоянного тока, на отрицательном электроде произойдет реакция Na+ + e-> Na, а на положительном - 2Cl-> Cl2 + 2e- (здесь е- электрон). Этот процесс называют электролизом. (Устройство для проведения электролиза - электролитическая ячейка.)
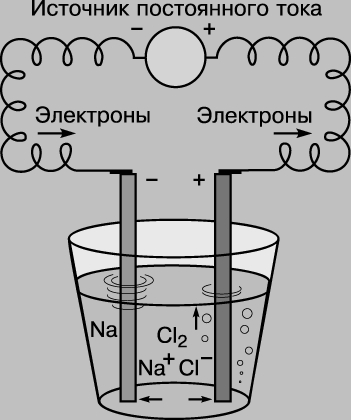
ЭЛЕКТРОЛИЗ РАСПЛАВА ХЛОРИДА НАТРИЯ, при котором ионы натрия Na+ собираются на катоде (отрицательном полюсе), а хлорид-ионы Cl- на аноде (положительном полюсе).
Процесс электролиза применяется для перезарядки свинцовых аккумуляторов и нанесения металлических покрытий (например, серебрение).
См. также
МЕТАЛЛОПОКРЫТИЯ. Окислительно-восстановительные реакции удобно представлять в виде суммы двух полуреакций, аналогичных тем, которые использовались для иллюстрации перемещения электронов между ионами натрия и хлора. Каждая полуреакция характеризуется электродным окислительно-восстановительным потенциалом, величиной которого определяется легкость передачи электронов. Этот потенциал зависит не только от природы соединения, но также от его концентрации, концентрации других веществ, вступающих в реакцию, и от температуры. Численные значения этих потенциалов обычно приводятся для конкретных условий: для растворенных веществ это эффективная концентрация 1 М; для газов - давление 1 атм (или парциальное давление 1 атм для каждого из газов, участвующих в реакции); для плохо растворимых твердых веществ и жидкостей - сами чистые твердые вещества и жидкости. В табл. 2 приведены значения стандартных потенциалов для некоторых распространенных полуреакций, представленных в виде реакций восстановления. Отметим, что для каждой полуреакции восстановленная форма вещества записывается в правой части уравнения, а окисленная - в левой. Паре ион водорода/газообразный водород приписан нулевой потенциал, потенциалы всех остальных пар измеряются по отношению к нему. Таким образом, пара с положительным потенциалом содержит лучший, чем ион водорода, окислитель, а пара, имеющая отрицательный потенциал, - лучший, чем газообразный водород, восстановитель. Величина окислительной или восстановительной способности вещества прямо пропорциональна стандартному потенциалу.
Таблицу 2 можно использовать для предсказания хода многих реакций. Нужно только помнить, что если полуреакцию записывают в противоположном направлении, чем это сделано в таблице, то ее потенциал следует брать с противоположным знаком. Обычно реакции идут до конца, если сумма потенциалов двух полуреакций (потенциал ячейки) положительна и превышает примерно 0,1 В. Если потенциал ячейки находится в интервале от +0,1 до -0,1 В, то между реагирующими веществами устанавливается равновесие, причем в реакционном объеме все они присутствуют в заметных количествах. Если же потенциал ячейки ниже -0,1 В, то реакция, по существу, не идет. Однако если полоску цинка погрузить в раствор, содержащий ион меди, будет протекать реакция
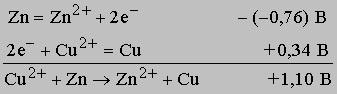
Поскольку потенциал представляет собой большую положительную величину, реакция идет до конца. Если же полоску меди поместить в раствор, содержащий ион цинка, то реакция Cu + Zn2+ -> Cu2+ + Zn не произойдет из-за высокого отрицательного потенциала ячейки (-1,10 В). Если смешать растворы, содержащие бихромат-ион и ион марганца(II), то между реагентами и продуктами установится равновесие, при этом оба иона и продукты реакции - оксид марганца(II) и ион хрома(III) - будут присутствовать в достаточно большой концентрации, поскольку потенциал этой реакции при стандартных условиях составляет лишь 0,1 В.
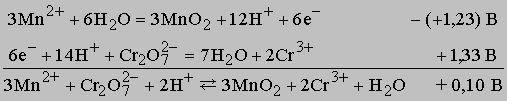
Отметим, что правая и левая части уравнения первой полуреакции умножены на три, чтобы получить число электронов, необходимое для второй полуреакции. Величина потенциала от этого не изменяется. В обеих частях суммарного уравнения должно быть одинаково не только число атомов каждого типа, но и суммарный электрический заряд (в данном случае он равен +6). В отличие от электролитической ячейки, во внешнюю цепь которой включен источник тока, гальванический элемент сам вырабатывает электричество. Гальваническими элементами являются, например, свинцовый автомобильный аккумулятор и батарейка для карманного фонарика. Напряжение, которое дает элемент, определяется потенциалами протекающих в нем полуреакций. Реакции с перераспределением обобществленных электронов. Приведем несколько примеров таких реакций:
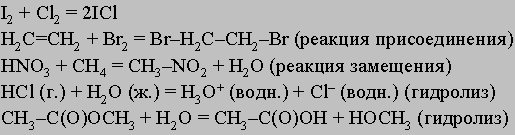
Более подробное обсуждение реакций с участием неорганических и органических соединений можно найти в статье
ХИМИЧЕСКИЕ РЕАКЦИИ, превращение одних веществ (реагентов) в другие (продукты), отличные по химическому составу и (или) строению; сопровождаются разрывом одних и образованием других химических связей. Протекают при смешении реагентов самопроизвольно, при участии катализаторов или при каком-либо энергетическом воздействии. Могут сопровождаться выделением тепла, испусканием света, изменением агрегатного состояния веществ и т.п. Изображаются с помощью химических уравнений, которые определяют количественные соотношения между реагентами и продуктами (стехиометрию реакции) и выражают закон сохранения массы. Направление, скорость и возможность осуществления химической реакции изучают методами химической кинетики и химической термодинамики. Химические реакции лежат в основе многих природных и технологических процессов.
Элементы, не обладающие стабильной электронной конфигурацией инертных газов, стремятся приобрести ее, вступая в химические реакции. Атомы, которым до стабильной конфигурации не хватает незначительного числа электронов или, напротив, у которых имеется небольшой их избыток, обычно образуют электрически заряженные частицы - ионы. Положительно заряженные ионы (образующиеся при потере электронов) называют катионами, отрицательно заряженные ионы (образующиеся при приобретении электронов) - анионами. Заряд ионов редко превышает 3, т.е. атомы редко теряют или приобретают более трех электронов. Атом натрия (см. схему), соединяясь с атомом хлора, теряет один наружный электрон и превращается в катион, а атом хлора приобретает этот электрон и становится анионом. Их внешние электронные оболочки становятся заполненными и содержат по восемь электронов. Катион и анион притягиваются, образуя хлорид натрия.
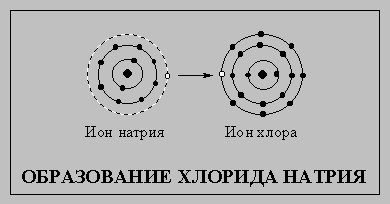
Электроны внешней оболочки, участвующие в образовании химических связей, называют валентными. (Валентность элемента равна числу связей, которые он способен образовать.) Некоторые элементы и их валентные электроны перечислены в приведенной выше таблице. В ней также указаны атомные номера элементов и наиболее распространенные ионы. Элементы, имеющие одинаковую электронную конфигурацию внешних оболочек и обладающие сходными физическими и химическими свойствами, объединены в периодической системе элементов в группы от I до VIII, причем номер группы совпадает с числом валентных электронов. Периодическая система элементов помогает понять, чем объясняется сходство элементов, принадлежащих данной группе, и почему эти элементы все-таки отличаются друг от друга. Открытие периодического закона и публикация периодической системы русским химиком Д.И.Менделеевым в 1869 явились важнейшим этапом в систематизации свойств известных и предсказании еще неоткрытых химических элементов.
См. также ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ.
Ионная связь. Противоположно заряженные ионы притягиваются друг к другу и сближаются, но лишь до определенного предела. Когда расстояние между ионами становится слишком мало, их электронные облака начинают отталкиваться, и дальнейшее сближение становится невозможно. Таким образом, есть определенное расстояние, на котором ионная пара наиболее стабильна. Его называют длиной ионной связи. Пространственное расположение заряженных частиц в веществе, имеющем ионный характер состояния, строго упорядоченно. В качестве примера ионных соединений можно привести обычную поваренную соль NaCl, в которой ион натрия Na+ связан с ионом хлора Cl-, или хлорид кальция CaCl2 с соотношением между ионами кальция Са2+ и хлорид-ионами Cl- 1:2. Как NaCl, так и CaCl2 электрически нейтральны.
Ковалентная связь. Другой распространенный тип связи - ковалентная связь - возникает, когда два атома обобществляют одну (или более) пару электронов. При образовании ковалентной связи атомы удерживаются вместе электростатическим притяжением ядер к общей электронной паре, в отличие от ионной связи, в основе которой лежит электростатическое притяжение между самими ионами. Ковалентные связи обычно образуются в тех случаях, когда ядра атомов притягивают электроны примерно с одинаковой силой. Такая связь существует, например, в молекуле хлора (см. схему). Есть удобное правило для определения типа связи между атомами двух элементов: если один элемент находится в левой части периодической таблицы, а другой - в правой, то связь между ними будет ионной (см. элементы, перечисленные в приведенной выше таблице).

Если валентные электроны обозначить точками, то различие между двумя типами связи станет более наглядным:

Соединения типа LiF, BeO или BeF2 ионные. Соединения, молекулы которых состоят из элементов - соседей по периодической таблице, как правило, ковалентные (CO2, CF4, NO2, N2, O2, F2). Правда, некоторые металлы образуют как ионные, так и ковалентные соединения. Два атома могут иметь две или даже три общие электронные пары, образуя двойную или тройную связь:

Полярная связь. Между чисто ковалентной (Cl2) и чисто ионной (LiF) связями есть еще одна, промежуточная. Она образуется, когда разные атомы притягивают общую электронную пару с неодинаковой силой. Способность атома оттягивать на себя электроны, участвующие в образовании химической связи, называется электроотрицательностью. Между атомами с существенно разной электроотрицательностью образуется чисто ионная связь; по мере уменьшения различий в электроотрицательности связь приобретает ковалентную "компоненту" и, наконец, становится чисто ковалентной. Электроотрицательность атомов хлора в молекуле Cl2 одинакова, поэтому связь между ними ковалентная. Связь Н-О в молекуле воды имеет в некоторой степени ионный характер, поскольку кислород более электроотрицателен, чем водород, и оттягивает на себя электронную пару. Такие связи называют полярными, причем полярность связи возрастает по мере увеличения ее ионного характера.
Степень окисления. Полярность связи Н-О иллюстрирует концепцию окисления (полной или частичной отдачи электронов), весьма полезную для наглядной иллюстрации картины распределения обобществленных электронов для механизма некоторых химических реакций. Атом кислорода сильнее притягивает общую электронную пару, поэтому можно сказать, что он как бы приобретает один лишний электрон за счет атома водорода. Обычно атом кислорода образует две связи, как в молекуле Н2О, следовательно, притягивает к себе два электрона и обладает степенью окисления -2. Поскольку атом водорода как бы теряет один электрон, его степень окисления +1. Степень окисления кислорода отличается от -2 в соединениях, называемых пероксидами, например в пероксиде водорода Н2О2. Здесь каждый атом кислорода делит один электрон с другим атомом и принимает от атома водорода один электрон. Поэтому степень окисления кислорода в пероксиде водорода -1. Степень окисления отдельного атома или молекулы (Mg, Cl2, O2) равна нулю. В нейтральном соединении сумма степеней окисления всех атомов равна нулю, в заряженном - суммарному заряду. Эти правила позволяют вычислить степень окисления атома в каждом конкретном соединении. В молекуле SO2 два атома кислорода в сумме дают степень окисления -4, а поскольку суммарная степень окисления молекулы должна равняться нулю, то степень окисления S равна +4. В анионе SO42- степень окисления серы +6, а в H2S она равна -2. Более электроотрицательному элементу приписывают знак минус.
Формулы. Поскольку количества атомов в молекуле относятся между собой как небольшие целые числа, состав молекулы можно представить, используя символы химических элементов и цифры, показывающие число атомов каждого элемента. Так, молекула воды, которая состоит из двух атомов водорода и одного атома кислорода, имеет формулу Н2О; пероксид водорода, в молекуле которого по два атома каждого элемента, - Н2О2. Формула оксида углерода - СО, диоксида - СО2, поскольку в молекулах этих соединений содержатся соответственно один атом углерода и один атом кислорода или один атом углерода и два атома кислорода. Формула FeSO4 отвечает сульфату железа(II); в молекуле этого соединения по одному атому железа и серы и четыре атома кислорода. Совокупность атомов, образующих определенную группу, обычно характеризуют одним словом. Например, SO42- это сульфатная группа, она входит в состав таких соединений, как сульфат алюминия Al2(SO4)3 и сульфат железа(III) Fe2(SO4)3. Другой пример - нитратная группа NO3-, входящая в состав нитрата аммония NH4NO3.
Ионы изображают, добавляя к символу элемента или группы знак "+" или "-". Например, Na+ - это ион натрия, Cl- хлорид-ион, SO42- сульфат-ион, Fe2+ - ион железа(II), Fe3+ - ион железа(III). Последние два иона получены из атома железа удалением двух и трех электронов соответственно. Структурные формулы наглядно показывают, из каких атомов состоят молекулы и какими связями они соединены; общие электронные пары или ковалентные связи обозначают черточками. В качестве примера рассмотрим этиловый спирт. Его обычная химическая формула С2Н5ОН. Такую же формулу имеет другое соединение - диметиловый эфир, и различие между этими соединениями можно увидеть, только записав их структурные формулы:
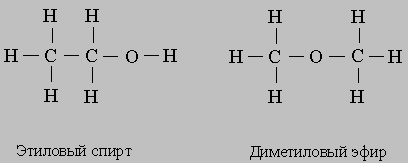
Конечно, такие формулы занимают больше места, чем обычные (CH3 -CH2 -OH и СН3 -О-СН3 или С2Н5ОН и СН3ОСН3). Поэтому в структурных формулах циклических соединений углерода химические символы часто опускают, изображая только кольцо из связей между атомами углерода. Ниже представлены полная структурная формула бензола (слева) и бензольное кольцо (справа):
Уравнения. Химические реакции можно представить в виде уравнений; при этом химические формулы реагентов находятся в левой части, продуктов реакции - в правой, а между ними стоит знак равенства (=), однонаправленная ((r)) или двунаправленная (") стрелка или двойные стрелки ( или ). Знак равенства означает, что из данных веществ образуются другие, а двунаправленная стрелка или двойные стрелки указывают, что реакция может протекать в обоих направлениях и между реагентами и продуктами устанавливается динамическое равновесие. Одинарная стрелка иногда заменяет знак равенства, но чаще означает, что реакция идет только в одном направлении. Таким образом, уравнение 2Cl Cl2 говорит о том, что два атома хлора, соединяясь, образуют молекулу и реакция может протекать в обратном направлении. На эту реакцию, как и на многие другие, влияют условия, в которых ее проводят, например температура. В реакции 2Cl Cl2 молекула хлора образуется при комнатной температуре, а атомарный хлор - при более высокой. Иногда эти условия указывают над стрелкой. Так, вместо приведенной выше реакции можно записать:

Если реакционную смесь нагревают, то над стрелкой иногда ставят греческую букву дельта, D. Физическое состояние реагентов и продуктов реакции указывают буквами г., ж., тв., водн., что означает соответственно газ, жидкость, твердое тело, водный раствор. Таким образом, уравнение
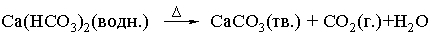
показывает, что при нагревании водного раствора бикарбоната кальция образуются твердый осадок карбоната кальция, газообразный диоксид углерода и вода (в виде паров или жидкости в зависимости от температуры).
См. также ХИМИЧЕСКИЕ УРАВНЕНИЯ. Сбалансированные уравнения. Реакцию между серной кислотой и гидроксидом натрия с образованием сульфата натрия и воды можно записать в виде NaOH + H2SO4 = H2O + Na2SO4. В действительности это уравнение не точное, поскольку число атомов одного и того же элемента в обоих частях равенства должно быть одинаковым, здесь же в левой части один атом натрия, а справа - два. Чтобы уравнять число атомов Na, перед NaOH нужно поставить коэффициент 2; аналогичным образом следует уравнять число атомов водорода и кислорода. В результате уравнение примет вид
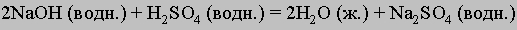
Подобные процедуры необходимо проводить до того, как уравнение будет использоваться для каких-либо вычислений.
Ионные уравнения. Многие вещества в растворе диссоциируют на ионы, которые могут вступать в химические реакции. В качестве примера рассмотрим приведенную выше реакцию между растворенными в воде гидроксидом натрия и серной кислотой. Реакция, записанная в ионной форме, будет иметь вид
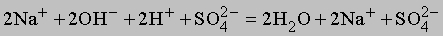
Ионизация воды здесь не показана. Отметим, что число ионов натрия и сульфат-ионов не изменяется, взаимодействуют только гидроксильные ионы и ионы водорода, поэтому суммарную реакцию можно записать в виде
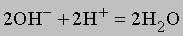
или еще проще
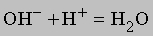
Массовые соотношения. Зная химическую формулу соединения и атомные массы, можно найти соотношения между массами элементов, входящих в состав соединения. Рассмотрим соединение Fe2O3 - оксид железа(III), обычную ржавчину. Найдем в периодической таблице атомные массы элементов и сложим их:
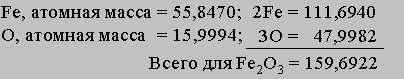
Доля железа в оксиде железа(III) составляет 111,6940/159,6922 = 0,6994, или 69,94%. 159,6922 - это мол. масса оксида железа(III).
См. также МОЛЕКУЛЯРНАЯ МАССА. Распространив этот принцип на химические уравнения, можно рассчитать, какое количество каждого из реагентов необходимо взять для того, чтобы по завершении реакции ни один из них не остался неизрасходованным, а также оценить, сколько разных продуктов образуется в ходе реакции. Так, в реакции окисления железа
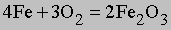
4*55,8470 = 223,3880 г железа взаимодействуют с 6Ч15,9994 = 95,9964 г кислорода, образуя 319,3844 г оксида железа(III). Зная количество железа, всегда можно рассчитать массу образовавшегося из него оксида.
Объемы газов и химические реакции. При постоянных давлении и температуре объемы реагирующих друг с другом газов, а также объемы газообразных продуктов реакции относятся как небольшие целые числа (закон Гей-Люссака). Эти отношения равны коэффициентам соответствующего химического уравнения. Рассмотрим, например, горение метана СН4, основного компонента природного газа. Как следует из уравнения реакции СН4 + 2О2 = СО2 + 2Н2О, для поддержания горения одного объема метана требуются два объема кислорода, а в результате образуются один объем диоксида углерода и два объема воды. Все объемы, конечно, приведены к одинаковым температуре и давлению.
Хими́ческие тра́нспортные реа́кции - обратимые химические реакции, сопровождающиеся переносом исходного твёрдого или жидкого вещества из одной температурной зоны в другую в результате образования и разложения промежуточных газообразных соединений. Применяют для очистки цветных, редких и рассеянных металлов, при получении полупроводников, монокристаллов, эпитаксиальных и монокристаллических плёнок и др.
* * *
ХИМИЧЕСКИЕ ТРАНСПОРТНЫЕ РЕАКЦИИ - ХИМИ́ЧЕСКИЕ ТРА́НСПОРТНЫЕ РЕА́КЦИИ, обратимые химические реакции, сопровождающиеся переносом исходного твердого или жидкого вещества из одной температурной зоны в другую в результате образования и разложения промежуточных газообразных соединений. Применяют для очистки цветных, редких и рассеянных металлов, при получении полупроводников, монокристаллов, эпитаксиальных и монокристаллических пленок и др.
ХИМИЧЕСКИЕ ТРАНСПОРТНЫЕ РЕАКЦИИ - обратимые химические реакции, сопровождающиеся переносом исходного твердого или жидкого вещества из одной температурной зоны в другую в результате образования и разложения промежуточных газообразных соединений. Применяют для очистки цветных, редких и рассеянных металлов, при получении полупроводников, монокристаллов, эпитаксиальных и монокристаллических пленок и др.
ХИМИЧЕСКИЕ УРАВНЕНИЯ - ХИМИ́ЧЕСКИЕ УРАВНЕ́НИЯ, см. Уравнения химические (см. УРАВНЕНИЯ ХИМИЧЕСКИЕ).
ХИМИЧЕСКИЕ УРАВНЕНИЯ - см. Уравнения химические.
ХИМИЧЕСКИЕ ФОРМУЛЫ - условно принятые знаки для обозначения состава химических соединений. Элементы простых тел обозначаются первыми буквами латинского названия элемента (напр. O - oxygenium, кислород, H - hydrogenium, водород, Fe - ferrum, железо). Для изображения состава химических соединений формулами ставятся рядом знаки образующих их элементов (напр. CO - окись углерода или угарный газ).
Они являются результатом последовательного действия различных желудочных соков на пищу.
слюна, желудочный сок, пепсин, лабфермент, слизистая оболочка желудка
прил.
1. соотн. с сущ. химия I, связанный с ним
2. Свойственный химии [химия I 1., 2.], характерный для неё.
3. Относящийся к явлениям, изучаемым химией [химия I 1.].
4. Содержащий в себе химические вещества.
5. Связанный с применением методов химии [химия I 1.] или продуктов химии [химия I 2.].
6. Изготовленный с использованием методов или средств химии [химия I 1.].
ХИМИ́ЧЕСКИЙ - прил., употр. сравн. часто
Морфология: нар. хими́чески
1. Химическим анализом какого-либо вещества называется исследование этого вещества на предмет содержания в нём продуктов химии.
Химический анализ воды, воздуха, почвы. | Химический метод исследования вещества. | Химический состав продуктов.
2. Химическим экспериментом называется испытание свойств какого-либо продукта химии.
Химические опыты.
3. Химической промышленностью называется такая отрасль хозяйства, которая использует в производстве или производит продукты химии.
Химический завод, комбинат. | Химическое производство.
4. Химическим процессом, явлением, элементом называют то, что является предметом изучения химии.
Химические законы, процессы, реакции. | Химические свойства атома. | Химический элемент. | Формулы химических соединений.
5. Химической обработкой, чисткой называют процесс улучшения качеств какого-либо объекта с помощью продуктов химии.
Химическая обработка дерева. | Химическая чистка одежды.
6. Химическая завивка - это способ обработки волос, при котором искусственно завитые волосы надолго сохраняют свою форму.
7. Химические удобрения - это продукты химии, которые используются в сельском хозяйстве для улучшения качественных характеристик почвы.
8. Химический карандаш - это чернильный карандаш, который оставляет нестираемый след на бумаге.
9. Химическим называют всё то, что связано с применением продуктов химии в военных целях.
Химическая война. | Химическая атака. | Захоронение химического оружия. | Военно-химический полигон. | Склад химических снарядов, боеприпасов.
10. Химическим называется всё то, что служит для занятий химией.
Химическая лаборатория. | Химическая посуда. | Школьный химический кабинет.
ХИМИ́ЧЕСКИЙ
химическая, химическое.
1. Прил. к химия. Химический факультет. Химическая лаборатория. Химическая специальность. Химические дисциплины. Химическая формула.
2. Прил., по знач. связанное с процессами и явлениями, присущими области химии. Химический элемент (простое, неразложимое вещество). Химическое соединение (сложное вещество из нескольких элементов). Химическая реакция (процесс превращения веществ). Химическое разложение. Химический процесс. Химическое сродство тел. Химическая физика. Химически (нареч.) чистый. Химически (нареч.) простое вещество.
3. Прил., по знач. связанное с применением методов химии и изготовлением продуктов этими методами. Химический анализ. Химическая обработка дерева. Химическая посуда. Химические удобрения. Химическое вещество. Химические препараты. Химическая чистка. Химическая промышленность. Химический карандаш (заменяющий при смачивании чернила).
4. Прил., по знач. связанное с применением химических препаратов в военных целях. Химическая война. Химическая атака. Химическая оборона. Химические снаряды.
ХИМИ́ЧЕСКИЙ, -ая, -ое.
1. см. химия.
2. Относящийся к явлениям и процессам, изучаемым химией. Х. элемент. Химическая реакция. Химическое разложение.
3. Относящийся к применению методов химии и к изготовлению продуктов этими методами. Х. анализ. Химические препараты. Химическая чистка одежды. Х. завод.
4. Относящийся к применению в военных целях препаратов, изготовляемых средствами химии. Химическое оружие.
5. О цвете: неестественный. Леденец химического цвета. Химическая блондинка.
Химический карандаш карандаш с особым графитом, к-рый при смачивании пишет, как чернила.
ХИМИ́ЧЕСКИЙ -ая, -ое.
1. к Хи́мия (1 зн.). Х. анализ крови. Х-ие опыты. Х-ая лаборатория. Х-ая посуда. Х. метод исследования вещества.
2. Относящийся к явлениям, процессам, изучаемым химией. Х-ие законы, процессы, реакции. Х. состав крови. Х-ие свойства атома. Х. элемент (простое вещество, которое нельзя разложить на более простые вещества).
3. Связанный с применением химикатов и методов химии. Х-ое производство. Х-ая обработка дерева. Х-ая чистка одежды. Х-ая завивка (волос). Х-ие удобрения. Х-ие краски. Х. завод. Х. карандаш (чернильный). Х-ие чернила (фиолетовые).
4. Связанный с применением продуктов химии в военных целях. Х-ая война. Х-ое оружие. Х-ое нападение. Х-ие снаряды. Х-ие войска.
5. Неестественный (о цвете).
◁ Хими́чески, нареч. Элемент х. чистый (с точки зрения своего химического состава). Х. обработанная ткань (химическим составом, методом).
-ая, -ое.
1. прил. к химия.
Химический метод исследования веществ.
◊
- Ну нет, - возразил Базаров, - кусок мяса лучше куска хлеба даже с химической точки зрения. Тургенев, Отцы и дети.
2. Относящийся к области химии, изучаемый химией.
Химические изменения вещества. Химические элементы. Химический опыт. Химическая реакция. Химический анализ воды.
◊
Химический состав крови дает нам мерку для оценки сравнительного достоинства всякой пищи. Писарев, Физиологические эскизы Молешота.
||
Предназначенный, служащий для занятий химией.
Школьный химический кабинет. Химическая лаборатория. Химическая посуда.
3. Связанный с применением методов химии в производстве, в различных отраслях хозяйства.
Химическая обработка дерева. Химическое производство.
||
Изготовленный методами, средствами химии.
Химические удобрения.
◊
Из гигантских водорослей можно извлекать ряд важных химических продуктов: альгин, ацетон, поташ, аммиак, йод и так далее. Н. Тарасов, Море живет.
4. Связанный с применением продуктов химии в военных целях.
Химическая война. Химическое оружие. Химические снаряды.
◊
химический карандаш
карандаш с особым графитом, который при смачивании пишет, как чернила.
химические чернила
чернила фиолетового цвета.
ХИМИЧЕСКИЙ, -ая, -ое.
Ненатуральный, вредный для здоровья, содержащий пестициды и т. п. (о продуктах). Химические помидорчики.
От химия, 3.
хими́ческий, хими́ческая, хими́ческое, хими́ческие, хими́ческого, хими́ческой, хими́ческих, хими́ческому, хими́ческим, хими́ческую, хими́ческою, хими́ческими, хими́ческом, хими́ческ, хими́ческа, хими́ческо, хими́чески
Хими́ческий ана́лиз - определение химического состава и строения веществ; включает качественный и количественный анализ. В химическом анализе используют химические методы, основанные на химических реакциях определяемых веществ в растворах, например гравиметрический и титриметрический анализ; физико-химические методы, основанные на измерении физических величин, изменение которых обусловлено химическими реакциями (потенциометрия, амперометрическое титрование и др.); в основе физических методов лежит измерение физических характеристик, обусловленных химической индивидуальностью веществ, например спектральный анализ, активационный анализ.
* * *
ХИМИЧЕСКИЙ АНАЛИЗ - ХИМИ́ЧЕСКИЙ АНА́ЛИЗ, включает качественный и количественный анализ. В химическом анализе используют химические методы, основанные на химических реакциях определяемых веществ в растворах, напр. гравиметрический и титриметрический анализ; физико-химические методы, основанные на измерении физических величин, изменение которых обусловлено химическими реакциями (потенциометрия, амперометрическое титрование и др.); в основе физических методов лежит изменение физических характеристик, обусловленных химической индивидуальностью веществ, напр. спектральный анализ, активационный анализ.
ХИМИЧЕСКИЙ анализ - включает качественный и количественный анализ. В химическом анализе используют химические методы, основанные на химических реакциях определяемых веществ в растворах, напр. гравиметрический и титриметрический анализ; физико-химические методы, основанные на измерении физических величин, изменение которых обусловлено химическими реакциями (потенциометрия, амперометрическое титрование и др.); в основе физических методов лежит изменение физических характеристик, обусловленных химической индивидуальностью веществ, напр. спектральный анализ, активационный анализ.
▲ анализ
качественный анализ.
количественный анализ.
микроанализ.
ацидиметрия. i полярография.
потенциометрия. i оксидиметрия.
акваметрия. i колориметрия.
алкалиметрия. i электроанализ.
кондуктометрия. i комплексонометрия.
активационный анализ.
пробировать.
↓ титрование.
газоанализатор. эвдиометр. i полярограф. стилометр.
Хими́ческий ла́зер - газовый лазер, в котором активная среда образуется в результате химических реакций. В непрерывном режиме мощность достигает нескольких кВт. Используется в лазерной спектроскопии, в лазерном разделении изотопов и др.
* * *
ХИМИЧЕСКИЙ ЛАЗЕР - ХИМИ́ЧЕСКИЙ ЛА́ЗЕР, газовый лазер, в котором активная среда образуется в результате химических реакций. В непрерывном режиме мощность достигает нескольких кВт. Используется в лазерной спектроскопии, в лазерном разделении изотопов и др.
ХИМИЧЕСКИЙ ЛАЗЕР - газовый лазер, в котором активная среда образуется в результате химических реакций. В непрерывном режиме мощность достигает нескольких кВт. Используется в лазерной спектроскопии, в лазерном разделении изотопов и др.
Хими́ческий потенциа́л - понятие, используемое для описания термодинамического равновесия в многокомпонентных и (или) многофазных системах. Обычно химический потенциал компонента системы вычисляют как частную производную энергии Гиббса по числу частиц (или молей) этого компонента при постоянной температуре, давлении и массах других компонентов. В равновесной гетерогенной системе химический потенциал каждого из компонентов во всех фазах, составляющих систему, равны (условие фазового равновесия). Для любой химической реакции сумма произведений химического потенциала всех участвующих в реакции веществ на их стехиометрический коэффициент равна нулю (условие химического равновесия).
* * *
ХИМИЧЕСКИЙ ПОТЕНЦИАЛ - ХИМИ́ЧЕСКИЙ ПОТЕНЦИА́Л, понятие, используемое для описания термодинамического равновесия в многокомпонентных системах. Обычно химический потенциал компонента системы вычисляют как частную производную гиббсовой энергии по числу частиц (или молей) этого компонента при постоянной температуре, давлении и массах других компонентов. В равновесной гетерогенной системе химические потенциалы каждого из компонентов во всех фазах, составляющих систему, равны (условие фазового равновесия). Для любой химической реакции сумма произведений химического потенциала всех участвующих в реакции веществ на их стехиометрический коэффициент равна нулю (условие химического равновесия).
ХИМИЧЕСКИЙ потенциал - понятие, используемое для описания термодинамического равновесия в многокомпонентных системах. Обычно химический потенциал компонента системы вычисляют как частную производную гиббсовой энергии по числу частиц (или молей) этого компонента при постоянной температуре, давлении и массах других компонентов. В равновесной гетерогенной системе химические потенциалы каждого из компонентов во всех фазах, составляющих систему, равны (условие фазового равновесия). Для любой химической реакции сумма произведений химического потенциала всех участвующих в реакции веществ на их стехиометрический коэффициент равна нулю (условие химического равновесия).
Хими́ческий раке́тный дви́гатель (термохимический), работает на химическом ракетном топливе. Основной двигатель всех ракет и космических летательных аппаратов. В камере сгорания образуется горячий газ, который затем вытекает из сопла. Максимальная скорость струи вытекающего газа около 4500 м/с, тяга - от долей Н до десятков МН. Основные типы химического ракетного двигателя - жидкостный, твердотопливный и гибридные ракетные двигатели.
* * *
ХИМИЧЕСКИЙ РАКЕТНЫЙ ДВИГАТЕЛЬ - ХИМИ́ЧЕСКИЙ РАКЕ́ТНЫЙ ДВИ́ГАТЕЛЬ (термохимический), работает на химическом ракетном топливе (см. РАКЕТНОЕ ТОПЛИВО). Основной двигатель всех ракет и космических летательных аппаратов. В камере сгорания (см. КАМЕРА СГОРАНИЯ) образуется горячий газ, который затем вытекает из сопла (см. СОПЛО). Максимальная скорость струи вытекающего газа ок. 4500 м/с, тяга - от долей Н до десятков МН. Основные типы химических ракетных двигателей - жидкостные ракетные двигатели (см. ЖИДКОСТНЫЙ РАКЕТНЫЙ ДВИГАТЕЛЬ) (ЖРД), ракетные двигатели твердого топлива (см. РАКЕТНЫЙ ДВИГАТЕЛЬ ТВЕРДОГО ТОПЛИВА (РДТТ)) (РДТТ) и гибридные ракетные двигатели (см. ГИБРИДНЫЙ РАКЕТНЫЙ ДВИГАТЕЛЬ) .
ХИМИЧЕСКИЙ РАКЕТНЫЙ двигатель (термохимический) - работает на химическом ракетном топливе. Основной двигатель всех ракет и космических летательных аппаратов. В камере сгорания образуется горячий газ, который затем вытекает из сопла. Максимальная скорость струи вытекающего газа ок. 4500 м/с, тяга - от долей Н до десятков МН. Основные типы химических ракетных двигателей - жидкостные ракетные двигатели (ЖРД), ракетные двигатели твердого топлива (РДТТ) и гибридные ракетные двигатели.